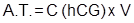Introducción
La Gonadotropina Coriónica Humana (hCG) es una hormona glicoproteica, con una masa molar de 39,5 kDa, sintetizada por el tejido trofoblástico y por algunas células malignas. Estas hormonas gonadotrópicas, entre las que se encuentran la hormona luteinizante, la folículo estimulante, la hCG, y la tirotropina u hormona estimulante del tiroides, constituyen un grupo de heterodiméricas formadas por dos subunidades asociadas no covalentemente, la subunidad alfa y la subunidad beta. La subunidad alfa es común en todas las hormonas gonadotrópicas, mientras que la subunidad beta es diferente, y es la responsable de la actividad biológica y la especificidad inmunológica de cada una de ellas.1 La determinación de hCG en suero u orina resulta de gran interés en el diagnóstico temprano del embarazo, la evaluación de algunos trastornos durante la gestación, como marcador tumoral en la enfermedad trofoblástica, coriocarcinoma y otros tipos de cáncer y como marcador de riesgo para el Síndrome de Down (SD).2
Desde 1987 se han reportado concentraciones elevadas de hCG en el suero de embarazadas portadoras de un feto con SD.3 La combinación de marcadores ha demostrado ser más efectiva, como el pesquisaje combinado de alfafetoproteína y hCG, más edad materna, para calcular el riesgo de Síndrome de Down entre las 15 y 19 semanas de gestación, con niveles de detección que oscilan entre 55 y 65 % hasta el 80 %, con 5 a 7 % de falsos positivos.4 En las últimas dos décadas se han realizado importantes avances en el pesquisaje de SD empleando técnicas no invasivas, la determinación combinada de edad materna, parámetros ultrasonográficos como la traslucencia nucal, y marcadores séricos como la beta hCG libre y la concentración de la proteína placentaria A asociada al embarazo, permite detectar aproximadamente el 90% de los casos, con 3 a 5 % de falsos positivos, y si se complementa con la determinación de ADN libre de células, podrían identificarse hasta el 99 % de los casos.5 Se han reportado diferencias en los valores de estos marcadores en los embarazos logrados mediante tecnologías de reproducción asistida 6 y en diferentes etnias.7
Los niveles de hCG y beta hCG, determinados por diferentes métodos, se emplean como biomarcadores tumorales para el diagnóstico temprano de neoplasia trofoblástica y su seguimiento posterior a la evacuación, tanto en la mola hidatiforme completa como parcial.8
Teniendo en cuenta la importancia de la detección de hCG, el Centro de Inmunoensayo (CIE), de La Habana, Cuba, produce el inmunoensayo enzimático UMELISA HCG, que detecta la presencia de la hormona y es utilizado para el diagnóstico temprano del embarazo en muestras de orina y la detección en muestras de suero del embarazo ectópico, tumores trofoblásticos, coriocarcinomas y el tamizaje prenatal del Síndrome de Down.9
Para la obtención de los reactivos biológicos empleados en este ensayo se requiere hCG. Se presentan limitaciones en su importación por su elevado precio y disponibilidad en el mercado internacional, así como por el monopolio de la información acerca de los procesos de obtención. Por tanto, la purificación en Cuba de hCG, con la calidad bioquímicaque permita su empleo en la inmunización de animales para la obtención de anticuerpos de elevada actividad biológica y afinidad, y en la producción de los sueros estándar y control del UMELISA HCG es de gran importancia.
Considerando resultados anteriores obtenidos en la purificación de hCG mediante cromatografía de inmunoafinidad en el CIE 10, la necesidad de cambiar la fuente primaria de obtención de la hormona, y la posibilidad de emplear un algoritmo de purificación que ofrezca ventajas metodológicas, económicas y que permita resultados reproducibles; se realizó esta investigación con el objetivo de purificar y caracterizar gonadotropina coriónica humana para uso diagnóstico, a partir de orina de gestantes.
Materiales y métodos
Se realizó un estudio experimental de desarrollo tecnológico para obtener hCG con la calidad adecuada para uso diagnóstico.
Métodos analíticos:
La cuantificación de la concentración de proteínas en la muestra se realizó utilizando albúmina de suero bovino como estándar según el método de Lowry.11
En todas las etapas del proceso, se determinó la concentración de hCG mediante el inmunoensayo tipo ELISA, desarrollado y producido por el CIE, UMELISA HCG.9 El UMELISA HCG es inmunoensayo enzimático heterogéneo de doble anticuerpo que emplea como fase sólida tiras de ultramicro ELISA (10 μL por pocillo) revestidas con anticuerpos monoclonales que reconocen a la hormona intacta a través de la región carboxilo terminal de la subunidad beta. Las muestras se incuban en los pocillos de las tiras y la hCG presente en las muestras se une a los anticuerpos del recubrimiento. Posteriormente se eliminan los componentes de las muestras no fijados con la disolución reguladora Tris 0,371 mol/L, NaCl 3,76 mol/L, NaN3 0,071 mol/L, Tween 20 0,01 mol/L pH 7,8. Se añade un conjugado anti-cadena alfa hCG/Fosfatasa Alcalina, el cual se une a la hCG fijada en la reacción anterior; y mediante un nuevo lavado con la misma disolución reguladora se elimina el conjugado en exceso. Finalmente se añade el sustrato fluorigénico (4-metilumbeliferil fosfato 0,05 mol/L, disuelto en dietanolamina 0,92 mol/L pH 9,8) a cada pocillo, cuya reacción de hidrólisis es catalizada por la enzima del conjugado y la intensidad de la fluorescencia emitida por el producto de la reacción enzimática es proporcional a la concentración de hCG de las muestras. Los lavados se realizan con el lavador MAS 201 y la lectura de la fluorescencia se realiza en el Lector PR 521 (λexcitación= 365 nm y λemisión= 450 nm).9
Metodología experimental:
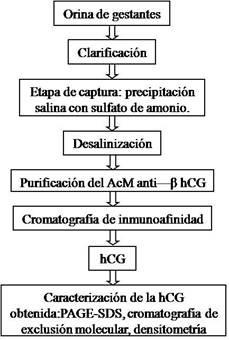
La estrategia utilizada para aislar y purificar hCG a partir de orina de embarazadas constó de diferentes etapas: clarificación, captura mediante precipitación con sulfato de amonio y cromatografía de inmunoafinidad previa purificación del anticuerpo monoclonal anticadena β-hCG. La hCG obtenida se caracterizó mediante PAGE-SDS, cromatografía de exclusión molecular y densitometría. Esta estrategia experimental se resume en la figura 1 y los procedimientos experimentales de cada una de sus etapas se describen también.
Material inicial:
Laorina de embarazadas (5ta -11na semana de gestación) fue colectada en el CIE, La Habana, Cuba. Se mezcló y almacenó a -20 ºC con azida sódica al 0,2 % como preservante.
Aislamiento y purificación de la hCG:
Clarificación de la orina: se realizó por filtración a través de papel de filtración rápida Whatman grado 4:20-25 μm (Whatman plc, Reino Unido), a una temperatura de 22 ( ( 2 (C.
Precipitación de la hCG: en la etapa de captura se empleó la precipitación con sulfato de amonio calidad analítica (Merck, Alemania).12 La precipitación se llevó a cabo según el procedimiento experimental que se describe a continuación durante el estudio de la influencia del porcentaje de saturación del sulfato de amonio.
Estudio de la influencia del porcentaje de saturación del sulfato de amonio: a muestras de 10 mL de orina se les añadió sulfato de amonio bajo agitación constante hasta alcanzar el 10, 20, 30, 40, 50, 60, 70 y 80 % de saturación. La determinación de la masa de sulfato de amonio añadido a la orina para lograr los porcentajes de saturación referidos se realizó según las tablas y procedimiento descrito por Paul T. Wingfield.13 Todas las alícuotas se agitaron durante 30 minutos, y luego se dejaron 1hora en reposo. Los experimentos se realizaron a 22 (C. Posteriormente las muestras se centrifugaron (centrifuga Beckman J2-HC, USA) a 1710 x g y 4 (C durante 15 min. El sobrenadante se eliminó y el precipitado se resuspendió en 1 mL de PBS y se dializó en una membrana Spectra/Por((Spectrum Laboratories, USA) con un tamaño de poro de 12 -14 kDa contra 2 L de PBS durante 24 h a 4 ºC, realizando cambios cada 8 h, la velocidad de agitación durante la diálisis fue de 300 min-1.13)
Estudio de la influencia de la temperatura y el tiempo de reposo en la etapa de precipitación: se realizó la precipitación con el porcentaje de saturación del sulfato de amonio en el cual se obtuvo el mayor porcentaje de hCG en el precipitado. Las temperaturas empleadas en el estudio fueron 4 ºC y 22 ºC y los tiempos de reposo de 1 h, 3 h, 5 h y 8 h. El resto del procedimiento fue igual al descrito en el acápite anterior.
Purificación de la hCG: la hCG obtenida a partir de la fracción precipitada con sulfato de amonio se purificó por cromatografía de inmunoafinidad con el anticuerpo monoclonal (AcM) murino 4G1C5, de isotipo IgG1, específico para la cadena beta de la hCG, desarrollado en el Laboratorio de Anticuerpos Monoclonales del Centro de Inmunoensayo (La Habana, Cuba). Su constante de afinidad es de 1,96 ± 0.46 x 109 L/mol y su producción se realizó según el procedimiento descrito por Baluja.14
Purificación del AcM 4G1C5 anti-β hCG para su inmovilización en la columna cromatográfica: el AcM anti-β hCG se purificó a partir de líquido ascítico(conservado a -20ºC)por cromatografía de afinidad con Proteína A-Sepharose CL 4B (Amersham-Pharmacia, Suecia).15 El líquido ascítico se diluyó 1:2 con la disolución reguladora de acoplamiento (NaCl 3 mol/L, glicina 1,5 mol/L pH 8,9) y se aplicó a una columna XK16/20 (16 x 20 cm) empaquetada con Proteína A Sepharose CL 4B y volumen de lecho 12,7 mL, equilibrada previamente con esa misma disolución. Después la columna se lavó con la disolución reguladora de acoplamiento hasta que la densidad óptica (DO) a 280 nm hasta que se alcanzó la línea base del cromatograma. Posteriormente se eluyó la IgG1 enlazada con la disolución reguladora ácido cítrico 0,1 mol/L pH 6. A continuación la matriz se regeneró con la disolución reguladora ácido cítrico 0,1 mol/L pH 3 y se equilibró con PBS. El pico de AcM obtenido se dializó a 4ºC frente a la disolución reguladora PBS, utilizando una membrana Spectra/Por((Spectrum Laboratories, USA) con un tamaño de poro de 12-14 kDa, con tres cambios de 1 L cada 8 h. La velocidad de agitación durante la diálisis fue de 200 min-1.15 El proceso se llevó a cabo en un gabinete refrigerado (Banfrio, España) a 4 ºC. La estimación de la concentración del AcM se realizó en un espectrofotómetro Ultrospec II (Pharmacia-LKB, Suecia) y se determinó mediante la lectura de la densidad óptica a 280 nm a través de la ecuación:10,14
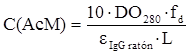 donde: C(AcM): Concentración de AcM (mg/mL) DO: Densidad óptica de la muestra a 280 nm en una cubeta de cuarzo de 1 cm de paso de luz. (: Coeficiente de extinción porcentual de la IgG de ratón (14,4), dado para una disolución de IgG de ratón al 1 % (masa/volumen), 1 cm de paso del luz y una longitud de onda de 280 nm. f: Factor de dilución L: Paso de luz en cm (1 cm)
donde: C(AcM): Concentración de AcM (mg/mL) DO: Densidad óptica de la muestra a 280 nm en una cubeta de cuarzo de 1 cm de paso de luz. (: Coeficiente de extinción porcentual de la IgG de ratón (14,4), dado para una disolución de IgG de ratón al 1 % (masa/volumen), 1 cm de paso del luz y una longitud de onda de 280 nm. f: Factor de dilución L: Paso de luz en cm (1 cm)Evaluación de la pureza del AcM 4G1C5 anti-β hCG obtenido: Se evaluó por inmunoelectroforesis, y por electroforesis en gel de poliacrilamida en presencia de dodecil sulfato de sodio (PAGE - SDS) y (-mercaptoetanol. Se empleó el estuche de calibradores de electroforesis de proteínas de baja masa molar (Amersham-Pharmacia, Suecia) y suero de conejo contra proteínas totales de suero de ratón (CIE, Cuba).10,16
Preparación de la columna de inmunoafinidad: se empleó como soporte cromatográfico la Sepharose CL 4B activada con bromuro de cianógeno (CNBr) (Amersham-Pharmacia, Suecia). La reacción de inmovilización del AcM a la matriz de Sepharose 4B activada con CNBr se realizó según el método recomendado por el fabricante.17 La eficiencia del proceso de inmovilización se determinó mediante el cálculo del porcentaje de anticuerpo fijado, según la siguiente expresión:
 donde: Y: Porcentaje de inmovilización. Af: Masa de anticuerpos no inmovilizados (mg) Ai: Masa de anticuerpos iniciales (mg)
donde: Y: Porcentaje de inmovilización. Af: Masa de anticuerpos no inmovilizados (mg) Ai: Masa de anticuerpos iniciales (mg)Purificación de la hCG: Se prepararon 3 mL de Sepharose CL 4B-AcM anti-cadena beta hCG en las siguientes condiciones: concentración de la disolución reguladora de acoplamiento NaHCO3/Na2CO3= 0,175 mol/L, masa de anticuerpo monoclonal= 3,5 mg, pH 8,35, temperatura de inmovilización 4 oC, velocidad de agitación 100 rpm, tiempo de reacción 2 h, concentración de NaCl en la disolución reguladora de acoplamiento 0,5 mol/L.
Para el estudio de la reproducibilidad de la purificación de la hormona se partió de 6,2 L de orina. La orina se descongeló, homogeneizó y luego se clarificó por filtración a través de papel de filtro. Posteriormente se dividió en tres porciones de 2 L con los que se realizaron tres purificaciones consecutivas, con el objetivo de estudiar la reproducibilidad del proceso. La precipitación salina se realizó bajo las condiciones experimentales seleccionadas durante este estudio. La disolución reguladora empleada durante la etapa de adsorción de la cromatografía de inmunoafinidad fue PBS. El lavado de la matriz se realizó con NaCl 1 mol/L, glucosa 10 mmol/L y la elución selectiva se efectuó con la disolución reguladora glicina 0,2 mol/L pH 2,8.
La hCG purificada en las tres corridas cromatográficas se mezcló y se caracterizó mediante: PAGE-SDS en condiciones reductoras y no reductoras y cromatografía de exclusión molecular.Se empleó el estuche de calibradores de electroforesis de proteínas de baja masa molar (Amersham-Pharmacia, Suecia) y hCG comercial (Sigma, USA).
Los valores de concentración de hCG y de proteínas totales se utilizaron para el cálculo de los parámetros de control del proceso de purificación: actividad específica, grado de purificación, actividad total de hCG y rendimiento.
Actividad específica:
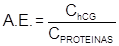 donde: A.E.: Actividad específica (UI/mg). C: Concentración de hCG (UI/mL). C: Concentración de proteínas (mg/mL). Grado de purificación:
donde: A.E.: Actividad específica (UI/mg). C: Concentración de hCG (UI/mL). C: Concentración de proteínas (mg/mL). Grado de purificación:
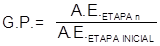 donde: G.P.: Grado de purificación. A.E.: Actividad específica (UI/mg) de la etapa n (n=1,2,3,…). A.E.: Actividad específica (UI/mg) de la etapa inicial. Actividad total o masa total de hCG:
donde: G.P.: Grado de purificación. A.E.: Actividad específica (UI/mg) de la etapa n (n=1,2,3,…). A.E.: Actividad específica (UI/mg) de la etapa inicial. Actividad total o masa total de hCG:
Rendimiento
Se obtuvo a partir de los valores de actividad total o cantidad total de hCG en cada etapa, considerando la primera etapa como el 100 %.
Cada experimento se repitió tres veces y se determinó la media, la desviación estándar y el coeficiente de variación.
El ajuste de la mejor recta de las curvas de calibración de las columnas de Superose 12 y las electroforesis en gel de poliacrilamida en presencia de SDS y (-mercaptoetanol se realizó por análisis de regresión lineal simple.
Todo el procesamiento estadístico se realizó con el programa Statgraphic 5.1.
Resultados y discusión
El proceso de purificación se inició a partir de una mezcla de orina de embarazadas, almacenada a -20 ºC con azida sódica al 0,2 % como preservante.
Para la realización de purificaciones anteriores de hCG en el CIE se contaba con un crudo enriquecido de la hormona 10, obtenido en el mercado nacional y que dejó de producirse. La selección de la orina de embarazadas como fuente para el aislamiento y purificación de la hCG, se realizó sobre la base de su facilidad de recolección a través de un método no invasivo, su disponibilidad por ser un producto de desecho y por su contenido limitado de contaminantes proteicos. Además, la orina de mujeres embarazadas ha sido la fuente empleada fundamentalmente para el aislamiento y purificación de hCG por otros investigadores 18,19, aunque también se ha obtenido a partir de otras fuentes, como orina de pacientes con tumores trofoblásticos 20, la placenta, tejido de mola hidatiforme, la hipófisis 21 y mediante ingeniería genética.22
La hCG producida por la hipófisis de individuos sanos, las personas con coriocarcinomas y otros tipos de neoplasias, así como las mujeres con enfermedades trofoblásticas o embarazos patológicos, posee diferencias en la composición de sus glúcidos y en el contenido de ácido siálico 23, por lo que los estándares elaborados con ella rinden resultados diferentes con respecto al estándar internacional, y su empleo como inmunógeno no es conveniente.24 Por el contrario, la hormona presente en la orina de mujeres embarazadas no posee estas modificaciones estructurales, razón por la cual, seleccionamos la misma como fuente para purificarla. Para colectar la orina con fines de su utilización como materia prima de purificación de hCG debe considerarse que la máxima concentración de la hormona en la orina de embarazadas se alcanza entre las 7 y 12 semanas después del primer día de la última menstruación.2
En el estudio realizado durante la etapa de captura (figura 2) se observa que a concentraciones inferiores y superiores del 50 % de saturación del sulfato de amonio, disminuye la masa de hCG en el precipitado. Una saturación del 50 % de la sal, es la mejor concentración para obtener la mayor masa de hCG (64,45 UI) en el precipitado (64,17 % de hCG precipitada).
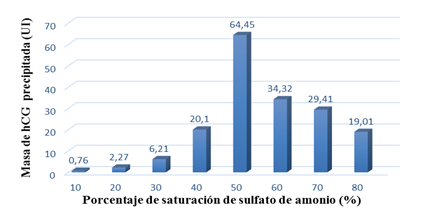
Fig. 2 Efecto del porcentaje de saturación del sulfato de amonio en la cantidad de gonadotropina coriónica humana (hCG) precipitada
Con esta concentración final del 50 % de saturación del sulfato de amonio se estudió la influencia del tiempo de reposo y la temperatura en la cantidad de hCG precipitada (figura 3). Se encontró que a temperatura ambiente (22 (C) se logra en menor tiempo la precipitación de la hCG que a 4 (C, es decir, a las 3 h de reposo se obtiene el 74,27 % de hCG y en el caso de la temperatura más baja se logra a partir de las 5 h. Las condiciones en las que se obtuvo una mayor masa de hCG en el precipitado (74,6 ± 0,57 UI ) fueron una temperatura de 22 (C y 3 h de reposo.
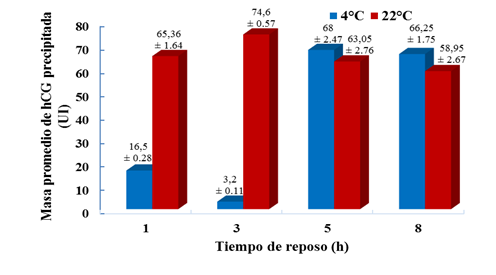
Fig. 3 Efecto de la temperatura y el tiempo de reposo en la cantidad de gonadotropina coriónica humana (hCG) precipitada. En cada barra se proporciona el dato de la masa promedio de hCG precipitada ± la desviación estándar para 3 repeticiones
La etapa de captura tiene gran importancia en el aislamiento de la hCG de la orina, debido a que se encuentra a bajas concentraciones en este fluido, por lo que es necesaria su concentración. La precipitación salina con sulfato de amonio como etapa de captura se seleccionó por las ventajas de esta sal de ser muy soluble en agua, su adición no afecta la conformación nativa de las proteínas y se puede redisolver el precipitado sin pérdidas apreciables de la actividad biológica. Un precipitado proteico de sulfato de amonio es frecuentemente una de las mejores formas de conservar una proteína durante el proceso de purificación o cuando se encuentra pura.12 Otro aspecto importante a considerar es que no es necesario realizar el proceso a 4 (C, como en el caso del uso de solventes orgánicos (como la acetona o el etanol) que es imprescindible para evitar la desnaturalización de la proteína.20
El cromatograma típico del proceso de elución selectiva, mediante decrecimiento del pH utilizando ácido cítrico 0,1 moL/L pH 6, del AcM 4G1C5 anti-β hCGse muestra en la figura 4.
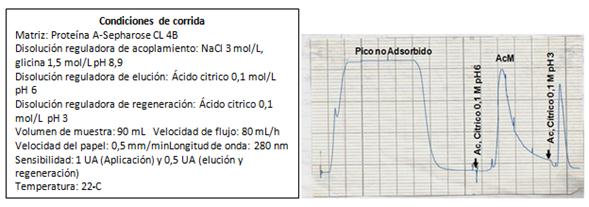
Fig. 4 Perfil cromatográfico de la obtención del anticuerpo monoclonal (AcM) murino anticadena beta de la gonadotropina coriónica humana 4G1C5,obtenido por cromatografía de afinidad en Proteína A Sepharose CL-4B
Tras la realización de 5 corridas, con 50 mL de líquido ascítico en cada una de ellas, el rendimiento promedio obtenido fue de 1,41 mg de AcM/mL de líquido ascítico, con una desviación estándar de 0,11 mg de AcM/mL de muestra inicial y un coeficiente de variación de 6,87 %.
El AcM se purificó por cromatografía de afinidad mediante la matriz Proteína A Sepharose CL 4B, aprovechando la afinidad existente entre la región Fc (fragmento cristalizable) de la inmunoglobulina G (IgG) de ratón y la Proteína A (componente de la pared celular producida por varias cepas de Staphylococcus aureus). La elución se realizó a través de un gradiente discontinuo de pH. La IgG1 es la subclase de inmunoglobulina de ratón que menos afinidad presenta por la Proteína A, por lo tanto, su elución se produce con una disolución que posee un pH cercano a la neutralidad (pH 6).25
Existen diversos métodos que permiten la purificación de un AcM, pero la cromatografía de afinidad empleando como soporte Proteína A Sepharose CL 4B es el recomendado por la literatura cuando se va a purificar anticuerpos a partir de líquido ascítico, debido a las ventajas que ofrece como son su reproducibilidad, sencillez y eficiencia.25) Este hecho fue corroborado durante la purificación del anticuerpo monoclonal, pues las 5 purificaciones llevadas a cabo arrojaron un coeficiente de variación bajo (6,87 %) con un rendimiento promedio de 1,41 mg de AcM/mL de líquido ascítico, lo cual permitió disponer con la cantidad suficiente de AcM (350,29 mg) para su empleo en la preparación de la matriz de inmunoafinidad. Los valores de rendimiento promedio, DE y CV se mantienen estables respecto a los obtenidos anteriormente durante la purificación de este monoclonal en el laboratorio.10
La figura 5 presenta la inmunoelectroforesis del AcM 4G1C5, frente al antisuero de conejo contra proteínas séricas totales de ratón. Se observa que la muestra resultó pura, por la presencia, en los pozos del 2 al 7, de un único arco de precipitación frente al antisuero utilizado. La muestra mostró además la movilidad electroforética característica de la IgG de ratón.16
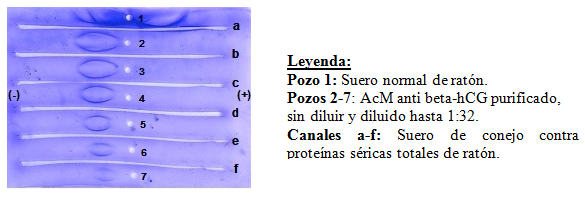
Fig. 5 Inmunoelectroforesis delanticuerpo monoclonal murino anticadena beta de la gonadotropina coriónica humana 4G1C5 obtenido por cromatografía de afinidad
En la figura 6-A (PAGE-SDS en condiciones reductoras) puede observarse, en las posiciones 1, 3, 5 y 7 las bandas características de la cadena pesada y ligera de la IgG. Por la interpolación de sus valores de movilidad relativa en la curva de calibración (Figura 6-B), construida con las proteínas patrones, se estimaron las masas molares de dichas cadenas. Se obtuvieron valores de 52,44 kDa para la cadena pesada y 25,62 kDa para la cadena ligera. Las masas molares obtenidas se corresponden con lo reportado por la literatura.25
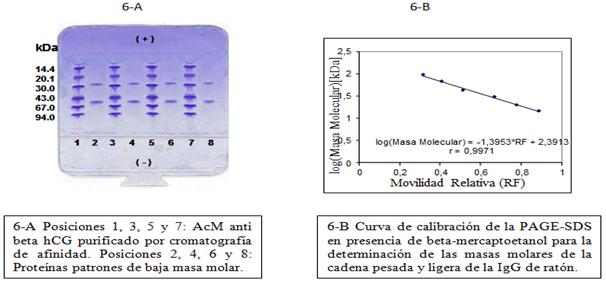
Fig. 6 Electroforesis en gel de poliacrilamida en presencia de SDS y beta-mercaptoetanol del anticuerpo monoclonal anticadena beta de la gonadotropina coriónica humana 4G1C5 purificado
Bajo las condiciones de reacción se logró un porcentaje de inmovilización del AcM 4G1C5 anti-β hCGa la matriz cromatográfica del 93,8 % (65,66 mg de AcM inmovilizado). Este proceso de inmovilización se realizó según las recomendaciones del fabricante, consideramos que el estudio de las condiciones óptimas de esta reacción podría aumentar el rendimiento del proceso de purificación.
El cromatograma típico de la purificación de la hCG mediante cromatografía de inmunoafinidad se muestra en la figura 7.
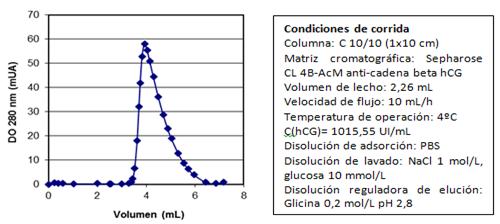
Fig. 7 Cromatograma típico de la elución de la extracción de la hCG en la cromatografía de inmunoafinidad
En la tabla 1 se resumen los valores de los rendimientos promedios de las etapas del proceso de aislamiento y purificación de la hCG. El rendimiento promedio durante la etapa de inmunoafinidad fue de 87,7 %, y los coeficientes de variación fueron inferiores al 5 %.
Tabla 1 Reproducibilidad del proceso de aislamiento y purificación de la gonadotropina coriónica humana
| Etapa | Rendimiento (%) | Rendimiento promedio (%) | DE* (%) | CV† (%) | ||
| Corrida 1 | Corrida 2 | Corrida 3 | ||||
| Captura | 74,33 | 72,54 | 74,12 | 73,66 | 0,978 | 1,33 |
| Inmunoafinidad | 88,07 | 86,78 | 88,24 | 87,70‡ | 0,798 | 0,91 |
* Desviación estándar
† Coeficiente de variación
‡Considerando el precipitado como 100%
Con los valores promedios de las tres corridas se construyó la tabla 2, que refleja los resultados globales del proceso de obtención de hCG.La actividad específica de la hCG obtenida por el método propuesto fue de 12 417,65 UI/mg.
Tabla 2 Resultados globales del proceso de producción de gonadotropina coriónica humana (n=3)
| Etapa | Volumen (mL) | Masa de proteínas (mg) | Masa de hCG (UI) | A.E. * (UI/mg) | G.P. † | Rendimiento (%) |
| Orina | 2 000 | 3 720 | 29 600,00 | 7,96 | 1 | 100 |
| Precipitación con sulfato de amonio | 21,13 | 91,81 | 21 804,35 | 237,49 | 29,83 | 73,66 |
| Cromatografía de inmunoafinidad | 7,37 | 1,54 | 19 123,19 | 12 417,65 | 1 560 | 64,6‡ |
*Actividad específica
† Grado de purificación
‡Considerando la fuente inicial (orina de embarazadas) como el 100%.
A pesar de que la afinidad reportada para el monoclonal empleado en la preparación de la matriz de inmunoafinidad es de media a alta (1,96 ± 0,46 x 109 L/mol) 14 el método empleado para la elución de la hCG permitió un rendimiento promedio de 87,7% (Tabla 1), superior al obtenido en el laboratorio de 84,18 % cuando se realizó la purificación a partir de un crudo de hCG 10 y semejantes a los obtenidos por Xu y colaboradores que fue del 87 % 19 y por Yuki y colaboradores que oscila entre 80-93 %.18 El coeficiente de variación de cada etapa del proceso de aislamiento y purificación de la hCG es menor del 5 %, lo que indica que el proceso es reproducible, y que la metodología empleada garantiza consistencia en la obtención de la hCG necesaria para la producción de los reactivos biológicos del estuche UMELISA HCG.
El rendimiento promedio obtenido a partir de la fuente inicial (orina) fue del 64,6 % (tabla 2), semejante a los reportados por Cole, quien plantea que en su experiencia se mantiene entre 60-70 %.20
La actividad específica de la hCG obtenida por el método propuesto (12 417,65 UI/mg), es superior a la de 9 705,36 UI/mg obtenida en procesos anteriores 10,así como a la obtenida por Sakakibara y colaboradores, que fue de 8 000 UI/mg 26 y es similar a la actividad específica de la hCG ofertada por las firmas comerciales, como por ejemplo la de Sigma-Aldrich (USA) obtenida de orina de embarazadas que es de 13 000 UI/mg.27
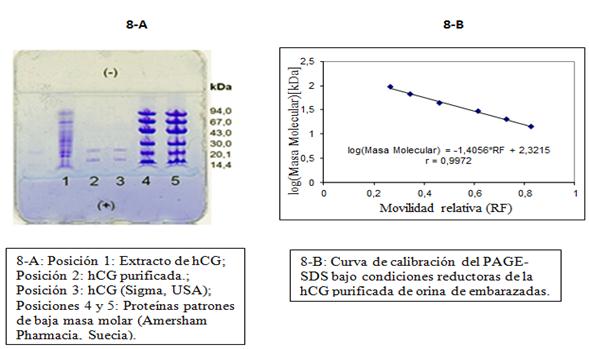
Los resultados del PAGE-SDS en condiciones reductoras se presentan en la figura 8-A. En la posición 2, correspondiente a la hormona purificada, se aprecian las dos bandas características de sus 2 cadenas (α y β), cuya movilidad fue similar a la mostrada por las subunidades de la hormona comercial empleada como control (posición 3). Las masas molares estimadas como resultado de la interpolación de los valores de RF de la muestra de hCG en la curva de calibración (Figura 8-B) para las subunidades alfa y beta respectivamente fueron 14,6 kDa y 23,5 kDa.
La hCG es una hormona glicoproteica de 39,5 kDa y los glúcidos representan aproximadamente del 30-35 % de su masa total. La cadena alfa está conformada por 92 aminoácidos y presenta 5 puentes disulfuro en su estructura terciaria, y posee una masa molar de 14 kDa. La subunidad beta diferencia a la hCG de las otras hormonas glicoproteicas; tiene una masa molar de 22,5 kDa está compuesta por 145 aminoácidos y presenta 6 puentes disulfuro.28 Los valores de las masas molares de las cadenas alfa y beta obtenidos en nuestro estudio (14,6 kDa y 23,5kDa, respectivamente), corresponden con reportes de la literatura de 14,9 kDa y 23 kDa reportados por SIGMA.29
La banda correspondiente a la hCG (figura 9) mostró una pureza del 97,3 % por densitometría.

Fig. 9 PAGE-SDS bajo condiciones no reductoras y tinción con plata de la hCG purificada a partir de orina de embarazadas
La pureza obtenida para la hCG purificada (97,3 %) es excelente para el uso final de esta proteína en la preparación de los sueros estándar y control del UMELISA HCG, como inmunógeno y el tamizaje de líquido ascítico anti-cadena beta de la hCG. Para estos objetivos, según la literatura consultada, se considera aceptable una pureza mínima del 90 % 30, y la descrita en este estudio es superior a este valor.
El cromatograma de la filtración sobre gel en una columna empaquetada con Superose 12 HR mostró un pico, con una Kav de 0,197. Este valor se interpoló en la curva de calibración y se obtuvo una masa molar de 40 kDa. El análisis de las fracciones del cromatograma mostró que toda la actividad de la hCG estaba contenida dentro del único pico observado (Figura 10).
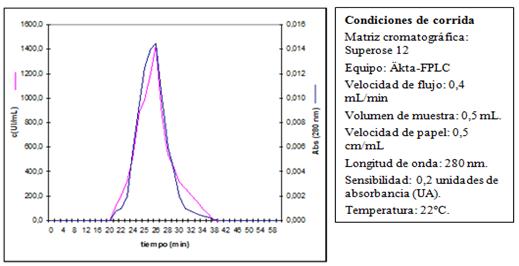
Fig. 10 Cromatograma de la filtración sobre gel en Superose 12, de la hCG purificada a partir de orina de embarazadas
La masa molar obtenida de la hCG purificada (40 kDa), se corresponde con la masa molar de la hCG informada por otros investigadores (39,6 kDa).30
Los resultados obtenidos en esta investigación aportan evidencias sobre la utilidad y ventajas del empleo de sulfato de amonio como agente precipitante cuando se emplea orina como fuente primaria para la obtención de hCG. Se demostró además que el empleo del AcM anti-β hCG obtenido en el Grupo de Anticuerpos Monoclonales del CIEes efectivo para la purificación de la hCG, al ser la obtención del anticuerpo monoclonal la etapa más costosa de la purificación, puede tener un efecto importante en la reducción del costo de operación. La escala utilizada y la reproducibilidad del proceso garantizan la demanda anual de hCG para la obtención de la cadena beta de la hCG, su uso como inmunógeno, en la evaluación del hibridoma productor del AcM anti-cadena beta de la hCG, en la determinación del título de AcM en el tamizaje del líquido ascítico anti-cadena beta hCG producido y la producción de los estuches UMELISA HCG por el CIE.
Conclusiones
La metodología empleada resultó efectiva para la purificación de la hCG a partir de orina de mujeres embarazadas con la calidad bioquímica requerida en cuanto a pureza y actividad biológica total para su empleo en la obtención de los reactivos biológicos del estuche diagnóstico UMELISAHCG