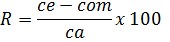Introducción
El proceso de producción de biogás por Digestión Anaerobia (DA) de materia orgánica, es una tecnología que ha ganado gran popularidad hoy en día y es adoptada extensamente por sus amplias aplicaciones.1 La misma ha demostrado ser un proceso económicamente viable para la utilización cíclica de desechos orgánicos a gran escala 2 y una tecnología atractiva por la cual el metano (CH4) es almacenado y utilizado como fuente renovable de energía.3 También produce un residual resultante conocido como digestato que es considerado un valioso abono orgánico. Éste se caracteriza por ser rico en nutrientes esenciales para el crecimiento y desarrollo de las plantas.4,5 Generalmente el rango de concentración de ortofosfato (PO4 3-) en el digestato es de 1-2,2 kg t-1.6 En estudios realizados en Cuba, se reporta fósforo (P)-Total en un rango de 0,08-0,1% en digestatos líquidos, mientras que el sólido se encuentra entre 1,2 y 2,5 %.7
El fósforo (P) es una parte esencial del proceso de fotosíntesis y respiración de las plantas.8 Este es accesible en forma de iones ortofosfato, fortaleciendo la estructura de la planta y aumentando su resistencia a las enfermedades. Permite la transformación de la energía solar en energía química y la formación de azúcares para su maduración apropiada. La fuente de este nutriente para fertilizantes minerales es la roca de fosfato, cuyas reservas actuales en el mundo se estiman para 300 años.9,10 También es conocido que la producción de fertilizante de P es costosa y requiere mucha energía. Se usa una cantidad excesiva de ácido sulfúrico (H2SO4) para convertir el fosfato de la roca en un fertilizante conocido como superfosfato. En consecuencia, el efluente de las industrias productoras de fertilizantes de P es altamente ácido 11 y esto tiene serias implicaciones ambientales en los ecosistemas.
La cuantificación del ortofosfatos presente en el digestato es importante ya que permite proporcionarle al suelo y al cultivo la cantidad necesaria del mismo. Y de esta forma mantener la calidad de los cultivos, optimizar los rendimientos, y minimizar los impactos potenciales del uso de los fertilizantes inorgánicos sobre el medio ambiente. En el Laboratorio de Biogás e Ingeniería Ambiental de la Universidad de Sancti Spíritus, se realizan análisis para la cuantificación de nutrientes a partir de técnicas validadas de Métodos estándares.12 Sin embargo, para la determinación de ortofosfatos es necesario verificar el procedimiento analítico dado, porque se trabaja con una nueva matriz. Es por ello que el objetivo del presente trabajo es verificar la determinación de ortofosfatos por el método espectrofotométrico del ácido vanadomolibdofosfórico, en las fracciones sólida y líquida del digestato, generado a partir de residual porcino en la provincia de Sancti Spíritus, Cuba.
Materiales y métodos
Muestreo
El digestato fue recolectado de 10 biodigestores Cúpula fija (digestor tipo Chino) alimentados con residuales porcinos, situados en la provincia. Todos con más de tres años de operación y funcionamiento ininterrumpido, para garantizar la estabilidad del digestato. Con esta tecnología y sustrato se aseguró que los digestatos fueran los más representativos de la provincia teniendo en cuenta que este biodigestor a escala rural es el más común junto con los residuales porcinos, esto puede ser atribuido a la gran producción descentralizada de cerdos en Cuba, la necesidad de tratamiento in situ de estiércol y la alta diseminación de biodigestores de este tipo.13

Fig. 1 Secciones de un biodigestor tipo chino. Izquierda: salida de lodos (digestato sólido), derecha: tanque de compensación (digestato líquido)
Las muestras se recolectaron por separado en fracciones líquida y sólida puesto que este tipo de tecnología así lo permite. Como se muestra en la figura 1, la fracción líquida fue tomada en el tanque de compensación, previo a la salida para la laguna de oxidación, mientras que la sólida fue recolectada por la salida de los lodos de la planta. Todas las muestras fueron almacenadas en botellas de vidrio estériles y guardadas a -20˚C para su conservación. Para la determinación de ortofosfatos se empleó el método descrito en los Métodos Estándares 4500-P-C 12 y fueron realizados en el Laboratorio de Biogás e Ingeniería Ambiental de la Universidad de Sancti Spíritus.
Procedimiento para la determinación de ortofosfatos (PO4 3-) por el Método espectrofotométrico del ácido vanadomolibdofosfórico
El digestato es altamente coloreado y turbio debido a la presencia de materia suspendida. Para la eliminación de materia orgánica, ambas fracciones se convirtieron en cenizas como se describe en Métodos estándares 14 sección 3030 J. Con este procedimiento, más económico, la validación a la vez que garantiza que los minerales se conserven en las cenizas, sobre todo los de la digestión anaerobia donde previamente es eliminada gran parte de la materia orgánica. Para la fracción líquida se empleó una dilución 1: 50, mientras que para la sólida debido a la mayor concentración de ortofosfato se diluyó 1: 625. En la medición de la absorbancia se utilizó un espectrofotómetro (RAYLEIGH). Se escogió la longitud de onda intermedia (420 nm) por ser la de mejor desempeño en el rango de concentraciones esperadas en el digestato.
El material de ensayo fue lavado con ácido clorhídrico diluido y caliente, para evitar la adsorción de fosfatos en la superficie del vidrio. No se utilizaron detergentes comerciales que contienen fosfatos. Después que se lavó la cristalería, se enjuagó con agua corriente abundantemente y luego tres vece con agua destilada. Se reservó esta cristalería sólo para la determinación de fosfato.
Preparación de la curva de calibración
A varios matraces aforados de 50 mL, se transfirieron alícuotas de 0; 2,0; 6,0; 10,0; 14,0 y 18,0 mL de la solución patrón de dihidrogenofosfato de potasio (KH2PO4) 50 mg/L y se enrasaron con agua destilada para preparar patrones en el rango de concentraciones de 0 a 18 mg/L. Luego de cada patrón se tomaron 35 mL y se transfirieron a un matraz de 50 mL. Se agregaron 10 mL de reactivo vanadato-molibdato preparado según indicó 4500-P C 12 y se enrasaron en 50 mL con agua destilada. Se dejó desarrollar el color durante 10 min. Se ajustó el espectrofotómetro con el blanco de reactivos y se medió la absorbancia a la longitud de onda seleccionada. Posteriormente se realizó la curva de calibración llevando a un gráfico la absorbancia de los patrones vs. concentración de fosfatos en cada patrón. La concentración de fosfato en el digestato fue determinada siguiendo el mismo procedimiento que para la curva de calibración.
Se prepararon tres curvas de calibración para verificar su linealidad en el intervalo de concentraciones del analito estudiado. A cada punto de la curva se le realizaron tres réplicas. Con los valores experimentales, empleando la herramienta de cálculo Microsoft Excel 2016, se calculó el coeficiente de correlación lineal (R) y la desviación estándar de la pendiente (Sb). Se realizaron también las pruebas de linealidad y de proporcionalidad mediante la evaluación estadística de la prueba t- Student, la prueba F-Fisher y se calculó el coeficiente de calidad (QC), como un mejor indicador del modelo lineal.
Verificación del desempeño del método espectrofotométrico de determinación de fosfatos
Para la verificación de la técnica analítica de determinación de ortofosfatos se utilizaron los parámetros estadísticos: precisión y veracidad, para ambas fracciones del digestato, de acuerdo a la Norma cubana.15
Precisión
Se utilizó el diseño experimental basado en la evaluación de la repetibilidad y la reproducibilidad intermedia. Se evaluó el comportamiento del primero mediante el método de determinación de fosfatos, a seis réplicas de una muestra de digestato, bajo las mismas condiciones. Con los resultados obtenidos se calculó la desviación estándar (D.E) y el porciento de coeficiente de variación (CV%). Los resultados de los estudios de precisión se expresaron en términos de CV%.
Para el segundo se midieron los mismos parámetros estadísticos a seis mediciones realizadas bajo las mismas condiciones medidos en 3 días consecutivos. Con los resultados se determinó la desviación estándar (S) 16 y el coeficiente de variación entre los días (CV%). El análisis de varianza de un solo factor también se realiza para determinar el valor de Fcalculado con el objetivo de conocer si existen o no diferencias significativas entre los resultados de los diferentes días. Otro parámetro estadístico que dio criterio sobre la reproducibilidad intermedia fue el coeficiente de variación teórico según Horwitz (CV% Horwitz), el cual se calculó según ecuación 1.
donde: C = media de las concentraciones de los tres analistas expresada en m/m como en este trabajo C está expresada en (mg/L) se realizó la siguiente conversión: 1 mg/L = 0,001 g/kg = 0,001 g/1000 g = 1*10-6 g/g.
También se realizó la prueba estadística C de Cochran (denominada en honor a su creador) que se utilizó como otro criterio para una verificación de los datos estadísticos en la prueba de reproducibilidad intermedia. La cual indica si existen variaciones en las determinaciones realizadas en los tres días bajo estudio.
Veracidad
Para determinar la veracidad se realizó el ensayo de Recuperación (R) mediante el método de adición de estándar. A partir del patrón de fosfato de 50 mg/L se prepararon, por triplicado, muestras patrones que cubrieron el rango de concentraciones de la técnica analítica: 2,0; 10,0; 18,0 mg /L, debido a que la concentración de ortofosfato es muy variable. A cada una de ellas se le adicionó 5 mL de digestato y se procedió al desarrollo de color. Con los resultados se calculó el % R según la ecuación 2:
donde: ce = cantidad ensayada /muestra con analito añadido, com = cantidad original de la muestra /sin analito añadido, ca = cantidad de analito añadido
Se realizó la prueba t-Student y la t experimental se calculó según la ecuación 3:
donde: R = % de recuperación n = número de determinaciones CV = coeficiente de variación del por ciento de recuperación
Luego se compara con el valor t tabulado, t ((1-α), n-1), donde α = 0,05 para un 95 % de confianza y n-1 son los grados de libertad. Si el valor de texp ≤ ttab significa que no existen diferencias significativas entre la recuperación media experimental (R) y el 100 por ciento, demostrando así la adecuada veracidad del método.15
Resultados y discusión
Estudio de la linealidad en la curva de calibración
La ecuación de la recta de la curva de calibración se muestra en la ecuación 4. En la tabla 1, se indican los valores experimentales correspondientes al estudio de linealidad para la determinación del contenido de ortofosfatos. Tanto el coeficiente de correlación lineal (r) como el coeficiente de determinación (R2) son mayores que los criterios de aceptación correspondientes, por lo que se puede concluir que existe una correlación estadística entre las variables estudiadas. Se cumple la condición de proporcionalidad pues los límites de confianza del intercepto incluyen el cero, lo que indica que no se cometen errores de tipo sistemático en el método. La desviación estándar relativa a la pendiente también cumple con lo establecido en la literatura 17, indicando que las curvas de calibración analizadas en días diferentes no sufren cambios.
Tabla 1 Resultados estadísticos del estudio de la linealidad de la curva de calibración
| parámetros | criterios de aceptación | resultados |
|---|---|---|
| Coeficiente de correlación lineal (r) | > 0,990 | 0,998 7 |
| Coeficiente de determinación (R2) | > 0,980 | 0,997 5 |
| a+t*Sa | Debe incluir el cero | -0,000 3 |
| a-t*Sa | 0,0127 | |
| Desviación estándar relativa a la pendiente (Sbrel) | < 5% | 0,77% |
| Test F-Fisher | Fcal > Fcrítica | 1,71E04 > 1,89E-56 |
| Coeficiente de Calidad (QC) | < 5% | 3,69% |
Por otro lado, se realizó la prueba F-Fisher obteniéndose como resultado que Fcal > Fcrítica, lo cual es un elemento adicional que reafirma que la variabilidad en la curva no afecta la linealidad. Esto lo corrobora también el coeficiente de calidad que al ser menor que el 5 % indica la dependencia lineal entre la absorbancia y el intervalo estudiado de concentración.
Verificación de la precisión
La precisión del método se analizó a través de la determinación del coeficiente de variación (CV), en condiciones de repetibilidad y reproducibilidad.
Repetibilidad
En la tabla 2 se muestran los resultados de la concentración de ortofosfatos obtenidos para el estudio de repetibilidad en seis réplicas de las muestras de digestatos, realizadas por el mismo analista, en un mismo día, con el mismo espectrofotómetro y sin variaciones en reactivos. En estos resultados se aprecia una baja dispersión en cuanto a los valores de concentración, debido a que el CV % es inferior al 3%, lo que muestra que el método es preciso en términos de repetibilidad en el intervalo estudiado.
Tabla 2 Valores medios obtenidos en el estudio de repetibilidad de digestatos
| PO4 3- (mg/ L) | |||
|---|---|---|---|
| fracciones | |||
| líquida | sólida | ||
| media | 14,23 | 14,90 | |
| SD | 0,09 | 0,07 | |
| CV % | 0,66 | 0,50 | |
La concentración de ortofosfato en el digestato teniendo en cuenta las diluciones fue de 0,07 % en la fracción líquida y 0,09 % en la sólida, lo anterior está en correspondencia con lo reportado.18 Por otra parte es ligeramente inferior a lo informado por 6 donde plantea que generalmente el rango de concentración de ortofosfato en el digestato es de 0,1-0,22 %. La fracción sólida fue las más ricas en este nutriente, en correspondencia con lo reportado por.19
Teniendo en cuenta los resultados obtenidos se puede plantear que: el digestato es un buen candidato para ser utilizado como abono orgánico, debido a su aporte de ortofosfato, forma química de mejor absorción por las plantas. Usando el digestato se puede contribuir a la agricultura sostenible en la provincia de Sancti Spíritus, dándole valor de uso a un residual, con el cual se aprovechan los nutrientes para mejorar la calidad del suelo y los cultivos.
Reproducibilidad intermedia
Para determinar la reproducibilidad intermedia del método variando el factor tiempo, un mismo analista determinó la concentración de ortofosfatos en seis réplicas por muestras, tres días diferentes. El coeficiente de variación para cada uno de los días (tabla 3) presentó valores inferiores al 3 %. Teniendo en cuenta que el valor crítico para métodos espectrofotométricos es CV superiores al 3 %, se pudo demostrar la reproducibilidad del método.
Tabla 3 Valores medios obtenidos en el estudio de reproducibilidad intermedia para las fracciones líquida y sólida
| Día 1 | Día 2 | Día 3 | |||||
|---|---|---|---|---|---|---|---|
| concentración de las fracciones (mg/L) | |||||||
| líquida | sólida | líquida | sólida | líquida | sólida | ||
| Media | 9,10 | 14,90 | 9,38 | 15,02 | 9,65 | 15,08 | |
| SD | 0,17 | 0,07 | 0,12 | 0,04 | 0,12 | 0,03 | |
| CV% | 1,88 | 0,50 | 1,72 | 1,72 | 1,49 | 1,49 | |
Como se muestra en la tabla 4, los cálculos realizados para el coeficiente de variación entre los días y de Horwitz, confirman que, para todos los casos el CV%(entre días) < CV% (Horwitz), por tanto, se considera que el factor día influye en la reproducibilidad. Al comparar los valores obtenidos en el análisis de varianza de un solo factor se muestra que el valor de Fcalculado > Fcrítico, para las fracciones del digestato analizado. Según lo reportado en la literatura 15,16, aunque el valor de Fcalculado es mayor Fcrítico, si el CV% Entre días < CV%/(Horwitz), el método es también considerado de precisión aceptable.
Tabla 4 Parámetros estadísticos obtenidos para el estudio de reproducibilidad intermedia en las fracciones sólida y líquida
| criterios de aceptación | fracciones | |
|---|---|---|
| líquida | sólida | |
| Cv%entre días < Cv%Horwitz | 4,83 < 10,73 | 4,34 < 10,64 |
| Fcalculado < Fcrítico | 8,87 > 3,68 | 18,35 > 3,68 |
| C calculado< Ccrítico | 0,09 <0,71 | 0,18 < 0,71 |
Por otro lado, según la prueba de Cochran, la variación del método se considera igual para los tres días de estudio, ya que el valor calculado es menor que el valor crítico; este criterio confirma la reproducibilidad del método entre días. Por lo anterior expuesto se puede afirmar que los resultados obtenidos en los diferentes días no difieren entre sí y que el método es preciso para las fracciones líquida y sólida del digestato analizado.
Verificación de la veracidad
Para el análisis de la veracidad se realizó un ensayo de Recuperación (R) mediante el método de adición de estándar, según la (ecuación 1). En la tabla 5 se muestran los resultados para este análisis. A 5 mL de digestato se le añadieron volúmenes suficientes de la solución patrón dihidrogenofosfato de potasio 50 mg/L, de forma que las concentraciones finales se correspondieron a valores mínimo, medio y máximo de la curva de calibración (2, 10, 18 mg/L). Los CV % presentaron valores inferiores al 3 % como valor crítico para este tipo de método, lo que demuestra la reproducibilidad en las determinaciones. La media de los porcentajes de recuperación para los tres niveles de concentración bajo, medio y alto, está dentro del intervalo establecido como criterio de aceptación de buena exactitud (80 %-110 %).15
Tabla 5 Resultados obtenidos en el estudio de veracidad para n* = 5, por el método de adición de estándar
| fracciones | |||
|---|---|---|---|
| líquida | sólida | ||
| 2 (mg/L) | Media | 3,39 | 3,47 |
| SD | 0,10 | 0,10 | |
| CV% | 2,98 | 2,88 | |
| 10 (mg/L) | Media | 11,29 | 11,34 |
| SD | 0,25 | 0,34 | |
| CV% | 2,20 | 2,96 | |
| 18 (mg/L) | Media | 19,38 | 19,40 |
| SD | 0,14 | 0,17 | |
| CV% | 0,74 | 0,88 | |
n* número de réplicas
Tablas 6 Parámetros estadísticos del estudio de veracidad por el método de adición del estándar para las fracciones enriquecidas con cantidades crecientes de analito
| Criterios de aceptación | KH2PO4 (mg*L-1) | fracciones | ||
|---|---|---|---|---|
| líquida | sólida | |||
| 80 <R /%)> 110 | 2 | 98,4 | 99,1 | |
| 10 | 98,6 | 98,5 | ||
| 18 | 99,7 | 99,5 | ||
| texp<ttab ttab α=0,05:1,397 | 2 | 1,231 | 0,674 | |
| 10 | 0,273 | 1,375 | ||
| 18 | 0,668 | 0,763 | ||
Se desarrolló un test de Student (t) para n-1 grados de libertad y α=0,05, con el objetivo de demostrar si los recobrados obtenidos son o no significativamente diferentes de 100, (tabla 6). En este análisis se obtuvo para todos los casos se cumple que la texp < ttab en las fracciones del digestato bajo estudio, por lo que se puede concluir que no existen diferencias significativas al 100% en el recobrado en todo el intervalo de concentraciones analizadas (2 a 18 mg/L). Con lo anterior se confirmó la veracidad, con un 95 % de confianza, de la técnica analítica empleada.
Conclusiones
Se verificó la técnica para la determinación de ortofosfatos por el Método Espectrofotométrico del ácido vanadomolibdofosfórico, en las fracciones líquida y sólida, generadas en biodigestores tipo Chino y residual porcino, obteniéndose que el método sea preciso y veraz en todo el rango de concentraciones (2 a 18 ppm). Se determinó la linealidad a la curva de calibración de fosfatos, desmostando que la variabilidad en la determinación de días diferentes no afecta la linealidad del método. Ambas fracciones pueden ser utilizadas como abono orgánico en suelos con déficit de fósforo aportando mayor contenido la fracción sólida