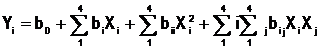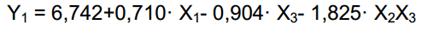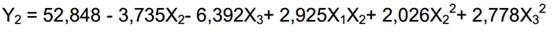Introducción
Los hongos están emergiendo como un componente vital de la dieta humana y varias reseñas abarcadoras de sus valores nutricionales han sido presentadas.1,2,3 En la naturaleza existen más de 2000 especies de hongos, pero solo alrededor de 25 son aceptan como alimento y algunos de ellos se cultivan comercialmente.4
Las investigaciones respecto a la producción biotecnológica de hongos del género Pleurotus están relacionadas principalmente con el empleo de medios alternativos para la producción de polisacáridos antitumorales; sin embargo, otros metabolitos con potencial terapéutico han sido menos explorados.5 Dentro de estos metabolitos secundarios se encuentran los polifenoles, compuestos antioxidantes con actividad en la inhibición de la peroxidación lipídica (POL), la captación de radicales hidroxilo y superóxido, y la actividad quelante de iones férricos.6) Estos compuestos han recibido especial atención por su papel en la prevención de varias enfermedades asociadas con el estrés oxidativo.7,8
La producción de biomasa del hongo Pleurotus ostreatusse realiza por fermentación en estado sólido o en estado líquido. La fermentación en sólido no se emplea en procesos de gran escala debido a problemas ingenieriles.9 La fermentación sumergida (o en estado líquido) permite la producción eficiente de biomasa fúngica en condiciones controladas, espacio y tiempo reducidos y con menores probabilidades de contaminación.10,11
El papel del medio de cultivo es proveer de nutrientes y precursores al organismo cultivado.12 Existe una relación entre la composición del medio y la biosíntesis de metabolitos. La elección del nutriente limitante puede tener efectos metabólicos y regulatorios específicos.13
La aplicación de técnicas de diseño experimental estadístico en el desarrollo de procesos de fermentación puede resultar en un mejor rendimiento de los productos, menor variabilidad del proceso, además de disminuir el tiempo de desarrollo y los costos generales.14 La metodología de superficie de respuesta (MSR) permite evaluar el efecto combinado de todos los factores involucrados, incluso en presencia de interacciones complejas.15
En este trabajo se analizará la influencia de las concentraciones de las fuentes de carbono y nitrógeno sobre la producción de biomasa micelial y fenoles totales, en cultivo sumergido de Pleurotus ostreatus, aplicando la metodología de superficie de respuesta.
Materiales y Métodos
Microorganismo empleado
Se empleó la cepa de Pleurotus ostreatus CCEBI 3024 perteneciente a la colección de cultivos del CEBI, conservada en medio Papa Dextrosa Agar (PDA). Este medio se esterilizó en una autoclave a 126 °C y a 1 atm durante 25 minutos. La cepa se mantuvo a una temperatura de 6 °C.
Preparación del inóculo
La siembra se realizó en placas Petri con 6 mL de medio de cultivo (Agar-Malta) las cuales fueron incubadas en oscuridad y a temperatura ambiente entre 27 y 30°C hasta lograr un crecimiento micelial a los10 días.
Medio de cultivo a optimizar
Se empleó el medio YPG (Yeast Peptone Glucose, por sus siglas en inglés), que contiene glucosa, 20 g·L-1; peptona, 4 g·L-1; extracto de levadura, 4 g·L-1; KH2PO4, 1 g·L-1; Na2SO4.7H2O, 1 g·L-1.
Fermentación en fase sumergida
Se añadió el micelio cultivado a un Erlenmeyer de 500 mL con 220 mL de solución de NaCl al 0,1% y se homogeneizó la solución a 3200 rpm con un dispersador de laboratorio (T50 digital ULTRA-TURRAX® - IKA, China). Se añadieron 10 mL de inóculo líquido a Erlenmeyers de 250 mL con 200 mL de medio YPG previamente preparado con la composición correspondiente para cada ensayo. Se suplementaron los medios de cultivo con cloranfenicol, 50 μg·mL-1 para prevenir el crecimiento de bacterias16. Se agitó en zaranda (HDL, China) a 120 rpm. Los cultivos permanecieron 10 días entre 19°C y 22°C. (figura 1).
Obtención de los extractos
Los cultivos se filtraron con papel de filtro (Whatman #1, Sigma-Aldrich, USA) y el micelio resultante se lavó exhaustivamente con agua destilada y se pesó en una balanza analítica. Se suspendió 1 g de biomasa de cada experimento en 5 mL de agua destilada. Se realizó la extracción durante 6 h a 95°C en un baño de agua termostático (Ningbo Scientz SC-15, China). Los extractos se centrifugaron a 3000 rpm (centrífugaHealForceNeofuge 15, China) durante 10 min, se filtraron a través de membranas de 0,2 μm (Merck Millipore, Alemania) y se conservaron a 4°C por 10 horas.
Cuantificación de fenoles totales
La determinación del contenido de polifenoles en los extractos de Pleurotus ostreatus CCEBI 3024, se llevó a cabo según la técnica de Folin-Ciocalteau. 17 Se usó una curva de calibración realizada con ácido gálico; (18-78 µg·mL-1; Yab = 0,0066 · Xc; R² = 0,9922); donde Yab es la absorbancia medida por espectrofotometría visible (espectrofotómetro Rayleigh VIS-723G, China) y Xc es la concentración de ácido gálico. Los resultados fueron expresados como μg en equivalentes de ácido gálico por mL de los extractos.
Cuantificación de la biomasa
El peso de la biomasa micelial fue determinada por gravimetría, centrifugando el cultivo a 5000 rpm, luego se lavó el micelio con agua destilada 3 veces y posteriormente se secó en estufa a 100°C hasta peso contante por 12 horas y posterior cuantificación.
Diseño experimental y análisis estadístico
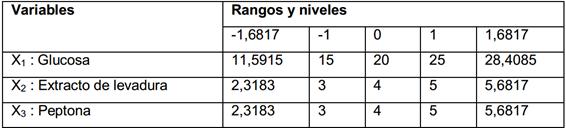
Se varió la concentración de glucosa, peptona y extracto de levadura, debido a que son las fuentes de carbono y nitrógeno. Los restantes componentes del medio se mantuvieron constantes. Se empleó un diseño compuesto central. Los valores centrales (nivel cero) elegidos para el diseño experimental fueron: glucosa 20 g·L-1, extracto de levadura 4 g·L-1 y peptona 4 g·L-1. Las variables de respuesta fueron ajustadas a un modelo de segundo orden. (12
Donde Yi es la respuesta predicha, Xi, Xj son variables de entrada que influyen en la variable de respuesta Y; b0 es el término de compensación; bi es el iésimo coeficiente lineal; bii es el coeficiente cuadrático y bij es el ij-ésimo coeficiente de interacción. Los rangos y niveles de las variables independientes investigadas en este estudio se presentan en la tabla 1.
Se utilizó un diseño compuesto central factorial 23 para las tres variables independientes, cada una a cinco niveles, con ocho puntos estrellas y seis réplicas en los puntos centrales. Se necesitaron veinte corridas para completar el diseño experimental.
Se usó el software STATGRAPHICS Centurion XV (StatPoint, Inc, USA) para la regresión y análisis gráfico de los datos obtenidos. Las concentraciones óptimas de los componentes del medio estudiado se obtuvieron mediante un procedimiento de optimización numérica y mediante el análisis de las curvas de contorno de superficie de respuesta. El análisis estadístico del modelo se realizó mediante el análisis de varianza (ANOVA). Este análisis incluyó la prueba F de Fisher (del significado estadístico de cada término), su probabilidad asociada p(F), coeficiente de correlación R, y el coeficiente de determinación R2.
Resultados y discusión
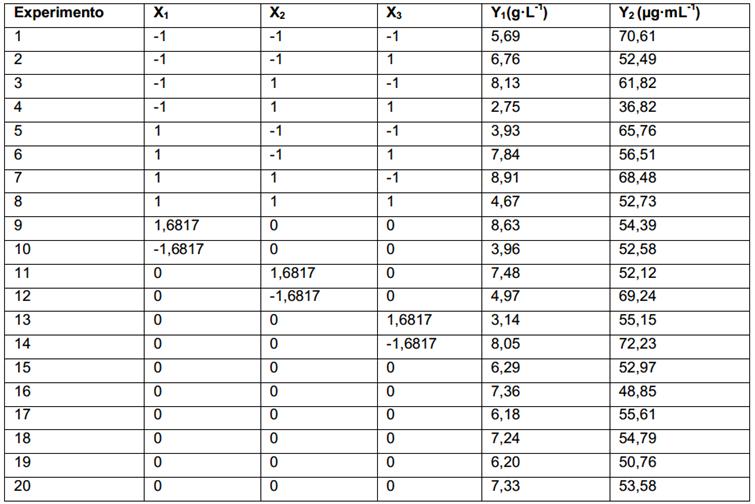
En la tabla 2 se presenta el diseño experimental y los resultados de la obtención de biomasa micelial de Pleurotus ostreatus (Y1) expresada en gramos de biomasa seca por litro de medio cultivo agotado y las concentraciones de fenoles totales (Y2) expresados como ácido gálico en µg·mL-1.
Efecto de la concentración de glucosa, extracto de levadura y peptona en la producción biomasa
En la figura 2A se puede apreciar que la región de mayor producción de biomasa (12-16 g) se encuentra extendida a lo largo del eje de la glucosa, alcanzándose los mayores valores para concentraciones de glucosa por encima de los 25 g·L-1. Estos resultados coinciden con los obtenidos por Horincar y col. 10 quienes estudiaron el crecimiento de Pleurotus ostreatus en fermentación sumergida, empleando glucosa como fuente de carbono. El aumento en la concentración de dextrosa de 20 a 60 g·L-1, tuvo un efecto poco significativo en la concentración de biomasa, con un ligero incremento de 21,55 a 25,71 g·L-1.
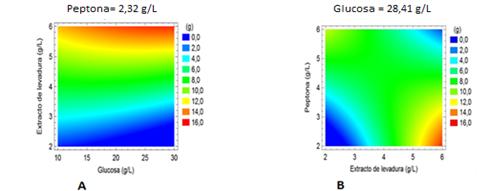
Fig. 2 (A) Efectos combinados de la concentración de glucosa y extracto de levadura (B) Concentración de peptona y extracto de levadura en la producción de biomasa micelial de Pleurotus ostreatus.
El nitrógeno es importante en la síntesis de proteínas, ácidos nucleicos, purinas, pirimidinas y polisacáridos18 constituyentes de la pared celular de muchos hongos.19 Se ha demostrado20 que la producción de biomasa micelial de Pleurotus ostreatus fue generalmente mayor con fuentes de nitrógeno orgánico. Esto es consistente con los resultados de estudios realizados 21 donde se demuestra que la mayoría de los basidiomicetos muestran un crecimiento preferencial en presencia de fuentes complejas de nitrógeno orgánico. Ello se atribuye a que ciertos aminoácidos esenciales no pueden ser sintetizados a partir de nitrógeno inorgánico.
En el presente trabajo se empleó peptona y extracto de levadura como fuentes de nitrógeno, y sus concentraciones tuvieron un efecto significativo en la formación de biomasa. Aunque la concentración de extracto de levadura no tuvo un efecto estadísticamente significativo en la formación de biomasa se observa en la (Fig.2A) que el aumento de la concentración de extracto de levadura tuvo una tendencia a incrementar la formación de biomasa, alcanzándose mayores valores para concentraciones superiores a 5 g·L-1. Por otra parte, el aumento de la concentración de peptona tiende a reducir los valores de biomasa (Fig. 2B). En este caso los mejores valores se encontraron para concentraciones mínimas de peptona por debajo de los 3,5 g·L-1.
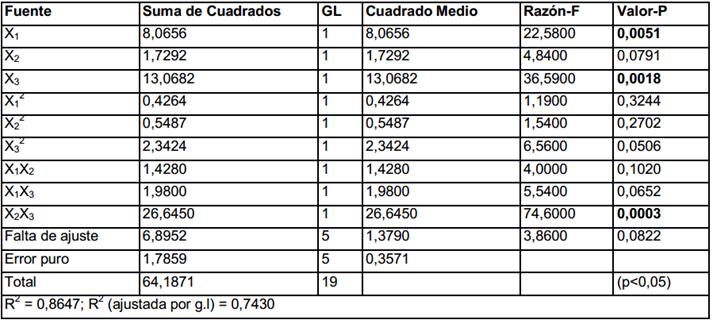
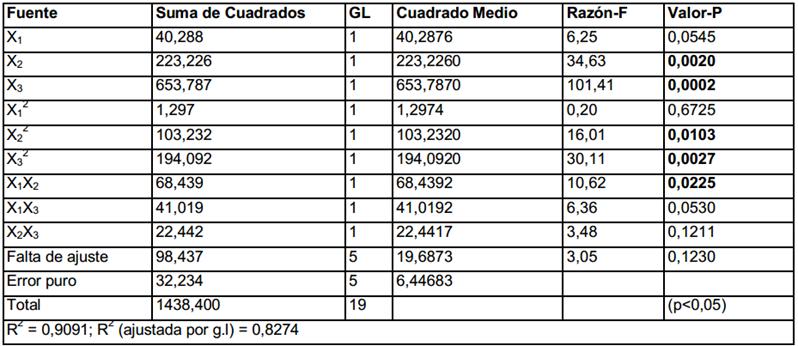
En la tabla 3 se presenta el análisis de varianza del modelo ajustado a los datos de la obtención de biomasa y el coeficiente de determinación (R2) igual a 0,8647 indica que el modelo ajustado explica el 86,47 % de la variabilidad total en la respuesta y el 13,53 % de variabilidad restante corresponde al error total.
Se obtuvo un modelo polinomial de segundo orden para obtención de biomasa, considerando solo los términos significativos (p<0,05) el cual se presenta en la ecuación 2 para valores codificados de las variables independientes.
El coeficiente positivo de la concentración de glucosa (X1) indica que un aumento en la misma produce un incremento en la formación de biomasa. Mientras que los coeficientes negativos de la concentración de peptona (X3) y el múltiplo entre las concentraciones de peptona y extracto de levadura (X2X3) indican que un aumento en los mismos presenta un efecto reductor de la formación de biomasa.
El valor máximo de biomasa predicho por el modelo, para el intervalo estudiado de las variables independientes, es de 15,28 g·L-1, que representa un incremento del 226 %, con respecto al valor de concentración de biomasa correspondiente al medio de cultivo sin optimizar. La combinación óptima de los valores codificados de las variables independientes es como sigue: X1=1,6817, X2=1,6817, X3=-1,6817. Los valores reales correspondientes son: glucosa = 28,41 g·L-1, extracto de levadura = 5,68 g·L-1 y peptona = 2,32 g·L-1. Como se aprecia, el valor óptimo de biomasa se alcanza para valores máximos de glucosa y extracto de levadura y el valor mínimo de peptona. Este resultado indica que el pico óptimo en la superficie de respuesta se encuentra fuera del intervalo estudiado. Partiendo del análisis anterior, es recomendable que, en próximos estudios, se realice una nueva exploración en otro intervalo de la superficie, fijando nuevos niveles para las variables independientes. Los nuevos niveles de las variables independientes, deberán fijarse tomando los valores óptimos obtenidos en este estudio como los nuevos valores centrales (Xi=0), y partiendo de estos realizar el nuevo diseño compuesto central.
Algunos autores 10 variaron las concentraciones de peptona y extracto de levadura entre 2,5 y 7,5 g·L-1. Estos cambios tuvieron un efecto significativo en la concentración de biomasa de Pleurotus ostreatus. Las mayores concentraciones de biomasa 21,55 y 25,71 g·L-1, se alcanzaron en ambos casos para concentraciones de extracto de levadura y peptona igual a 7,5 g·L-1, otros 22 obtuvieron una concentración máxima de biomasa de G. lucidum de 15,4 g·L-1 empleando una relación peptona/extracto de levadura de 1:2 y glucosa como fuente de carbono.
En el presente estudio se alcanzó la mayor concentración de biomasa (8,91 g·L-1) para una proporción C/N de 14,26, mientras que el valor óptimo de biomasa predicho (15,28 g∙L-1) corresponde a una proporción C/N de 17,5. Kimety col 23 encontraron que para el crecimiento micelial deP. tuberregium, son adecuados valores de la relación C/N alrededor de 20/1, mientras que valores inferiores producen menos biomasa. Resultados semejantes se obtuvieron para P. sinclairi.i24 Este comportamiento puede deberse a los valores de concentración de la fuente de carbono empleada (10 - 30 g·L-1), los cuales coinciden con los niveles fijados para la concentración de glucosa en el presente estudio. Para el hongoG. applanatum se demostró que la relación C/N entre 20 y 50 no afecta significativamente la producción de biomasa, si se emplean concentraciones de fuente de carbono de 40 g·L-1.25 Del anterior análisis se puede inferir que una concentración de 40-50 g·L-1 de la fuente de carbono es importante para independizar el efecto de la relación C/N sobre la producción de biomasa, mientras que a concentraciones bajas de la fuente de carbono el efecto de la relación C/N sobre la biomasa es significativo.26
Efecto de la concentración de glucosa, extracto de levadura y peptona en la producción de compuestos fenólicos
La figura 3 revela que las tres variables tienen un efecto similar sobre la producción de fenoles totales. La interacción de la concentración de glucosa con ambas fuentes de nitrógeno es de naturaleza lineal. Sin embargo, en este caso, el efecto de la glucosa es contrario, ya que los mayores valores en la concentración de fenoles (>80 µg·mL-1) se alcanzaron para concentraciones de glucosa por debajo de los 20 g·L-1. El aumento de la concentración de extracto de levadura y peptona tuvo un efecto inhibidor de la producción de compuestos fenólicos y los niveles óptimos para ambas variables se encuentran por debajo de los 4 g·L-1.
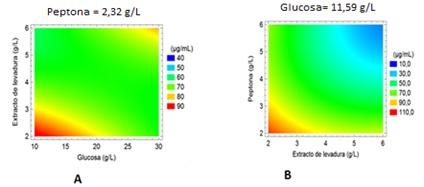
Fig. 3 (A) Efectos combinados de la concentración de glucosa y extracto de levadura (B) Concentración de peptona y extracto de levadura en la producción de compuestos fenólicos a partir de Pleurotus ostreatus.
Estos resultados son lógicos dado que los compuestos fenólicos son metabolitos secundarios del hongo. Los metabolitos secundarios son aquellos compuestos orgánicos sintetizados por el organismo, que no tienen un rol directo en el crecimiento o reproducción del mismo.27 A pesar de que no se conocen bien los factores que activan la producción de metabolitos secundarios, se sabe que este proceso ocurre en la fase en que el microorganismo deja de crecer, pero continua metabólicamente activo.28 La razón por la cual el microorganismo deja de crecer, suele deberse a la falta de algún nutriente esencial, como puede ser el carbono, el nitrógeno o el fósforo. 13 De este análisis se puede concluir que el hongo producirá una mayor cantidad de compuestos fenólicos en aquellos medios de cultivo donde primero se vea privado de las condiciones ideales para su crecimiento.
En el análisis de varianza (tabla 4) se puede apreciar que existen cinco términos significativos (p<0,05): la concentración de extracto de levadura (X2) y su cuadrado (X2 2), la concentración de peptona (X3) y su cuadrado (X3 2) y la interacción entre glucosa y el extracto de levadura (X1X2). Estos resultados indican que, para este intervalo de concentraciones, la formación de fenoles totales parece ser especialmente sensible a la cantidad de nitrógeno total presente en el medio. El valor de R2 = 0,9091 indica que el modelo ajustado explica el 90,91% de la variabilidad total en la respuesta y el 9,09% de variabilidad restante corresponde al error total. Estos valores son adecuados para este tipo de modelo, teniendo en cuenta la complejidad del metabolismo de los hongos superiores.
Se obtuvo un modelo polinomial de segundo orden para la producción de compuestos fenólicos, considerando solo los términos significativos (p<0,05) el cual se presenta en la ecuación 3 para valores codificados de las variables independientes.
El tiempo de cultivo también es una de las variables que más influye en la producción de compuestos fenólicos. Barros y col. 29 reportaron que el contenido de fenoles y flavonoides producidos por Leucopaxillus giganteus en fermentación sumergida, se incrementó de 6,21 mg·g-1 y 0,69 mg·g-1 a 21,9 mg·g-1 y 1,01 mg·g-1 respectivamente, al variar el tiempo de cultivo de 15 a 60 días. El contenido fenoles totales expresados como ácido gálico en el presente trabajo, alcanzó valores relativamente menores, entre 36,82 µg·mL-1 (0,18 mg·g de biomasa-1) y 72,23 µg·mL-1 (0,36 mg·g de biomasa-1) para un tiempo de cultivo menor, de 10 días. Otro factor que contribuye a esta diferencia, es la fuente de nitrógeno empleada. En el presente estudio se emplearon fuentes de nitrógeno orgánicas, fáciles de asimilar, a diferencia de las fuentes inorgánicas empleadas por Barros y col.29, las cuales representan una fuente de estrés para el hongo, cuyo metabolismo se ve afectado al tener que adaptarse a estas condiciones.
El modelo predice que la concentración máxima de fenoles totales que se puede obtener, en el intervalo estudiado de las variables independientes, es 104 µg·mL-1 197% mayor que el valor correspondiente al medio de cultivo sin optimizar. Los valores óptimos codificados de las variables independientes son: X1= -1,6817, X2= -1,6817, X3= -1,6817. Los valores reales correspondientes son: glucosa = 11,59 g·L-1, extracto de levadura = 2,32 g·L-1 y peptona = 2,32 g·L-1.
Los resultados obtenidos en el presente trabajo sientan bases para la obtención, extracción y purificación de compuestos bioactivos antioxidantes con aplicaciones en la industria alimentaria y biofarmacéutica, de forma más eficiente, partiendo de la optimización de las condiciones de cultivo empleando la metodología de superficie de respuesta.
Conclusiones
Las concentraciones de las fuentes de nitrógeno tuvieron una mayor influencia significativa en la producción de biomasa, que la de la fuente de carbono. Las concentraciones de las fuentes de carbono y nitrógeno, influyeron significativamente sobre la concentración de fenoles totales.
El máximo valor de biomasa predicho por el modelo fue de 15,28 g·L-1, para un medio de cultivo compuesto por glucosa, 28,41 g·L-1; extracto de levadura, 5,68 g·L-1 y peptona, 2,32 g·L-1. La mayor concentración de fenoles totales es de 104 µg·mL-1 para la siguiente composición del medio de cultivo: glucosa, 11,59 g·L-1; extracto de levadura, 2,32 g·L-1 y peptona, 2,32 g·L-1.