Introducción
El quito quito también llamado lulo o naranjilla (Solanumquitoense Lam) es una fruta nativa considerada el “fruto dorado de los andes” y el “néctar de los dioses”; 1) es cultivada principalmente en Ecuador, Colombia y Perú.2
Esta fruta pertenece a la familia de las Solanaceas, reconociéndose dos variedades: quitoense(Solanumquitoense Var. quitoense), cuyo fruto no presenta espinas y es cultivada en Colombia y Ecuador, y septentrionale(Solanumquitoense Var. septentrionale) la cual presenta espinas y esmás resistente, crece de 1000 a 1900 m, principalmente en Colombia, Panamá y Costa Rica; la variedad septentrionale es posiblemente más nativa que la variedad quitoense.3
El quito quito lo es una de las frutas exóticas más apetecidas en los mercados nacionales e internacionales, debido a su sabor y color que la hacen atractiva en comparación con otros frutos.4Tienen un amplio mercado en la industria de alimentos, principalmente en la fabricación de jugos, néctares, pulpas y mermeladas. Además, se caracteriza por su olor y sabor agridulce.5
El fruto de lulo, representa una fuente importante de nutrientes como vitaminas y minerales, que hacen de este fruto, un recurso fundamental para la nutrición; 6,7asimismo presenta cantidades importantes de carotenoides precursores de la vitamina A y de compuestos bioactivos como polifenoles totales, de mucho interés en salud pública. 8
En ese sentido, este fruto es altamente promisorio, que lo hace importante en la realización de futuras investigaciones, por lo que se planteó como objetivode la presente investigación determinar el contenido de los compuestos físico-químicos, nutricionales y bioactivos y su capacidad antioxidante de los frutos de quito quito como una fuente potencial de nutrientes en el desarrollo de alimentos funcionales.
Materiales y métodos
Muestra y muestreo
Los frutos procedieron de la selva alta de Oxapampa, del departamento de Pasco, Perú. El tipo de muestreo fue probabilístico, por conveniencia. El tamaño de muestra se consideró como una población infinita.
Materiales, equipos y reactivos
Materiales de vidrio, utensilios, licuadora, termómetro (360 °C), refrigerador (0 °C), balanza analítica (200 g) y espectrofotómetro marca Hitachi U-2800 A. Los reactivos fueron de grado analítico y comprados en Merck (Darmstadt, Germany) y Sigma Chemicals Co. (St. Louis, USA).
Preparación de las muestras
Se procedió a preparar las muestras, realizando una selección de las mismas, para luego ser lavadas, peladas y cortadas para su homogeneización. Se estabilizaron y conservaron en frascos ámbar herméticamente cerrados para los análisis respectivos.
Análisis físico-químicos
El contenido de agua, proteínas totales, extracto etéreo, cenizas y fibra cruda fueron determinados utilizando los métodos de la AOAC.9El factor utilizado para calcular la proteína fue de 6,25. Los carbohidratos fueron obtenidos por diferencia, es decir sustrayendo de 100 la suma de agua. Las determinaciones de azúcares totales, sólidos solubles, pH y acidez total se realizaron utilizando los métodos de la AOAC. 9Asimismo, se determinó el valor calórico según el CENAN. 10El índice de madurez se determinó mediante la relación de los sólidos solubles entre la acidez total.
Determinación del contenido de minerales
El contenido mineral se determinó en muestras de cenizas secas en una mufla a 550 °C y disuelto en HCl. Los extractos de minerales se midieron utilizando un espectrofotómetro de absorción atómica (Perkin Elmer modelo 3030-B). Los minerales: Ca, Mg, Zn, Cu, Mn, Fe fueron analizados por Espectrometría de Absorción Atómica con Llama (FAAS) con llama, y los minerales K y Na por espectrometría de emisión atómica con llama (FAES). Para cada mineral se preparó una curva estándar y un blanco respectivo. El contenido de fósforo fue medido usando la técnica espectrofotométrica con azul de molibdeno y el boro usando la técnica colorimétrica con curcumina. 11
Determinación de compuestos bioactivos y capacidad antioxidante
Determinación de vitamina C
La determinación de vitamina C(Ácido ascórbico), fuedeterminado por el método modificado de titulación con 2,6 diclorofenolindofenol que utiliza ácido oxálico en lugar de ácido metafosfórico durante la extracción, y fue expresado como mg ácido ascórbico/100 g muestra.12
Extracción de los analitos
Se pesaron 0,5g de muestra previamentehomogenizada, se agregó 5mLde soluciónde H2O/MeOH/ac. formico (24:25:1) mL, posteriormente se procedió a sonicar la muestra por 1 h, dejándose reposar por 24 h tapado en refrigeración. Después se volvió a sonicar la muestra por una hora, se procedió a centrifugarla a 3500 rpm durante 15 min con un posterior filtrado. 13
Determinación de compuestos fenólicos
Se siguió el método de Folin-Ciocalteau, partiendo de una curva patrón de ácido gálico expresando así los resultados como equivalentes de ácido gálico en mg/100 g de muestra. Para obtener los puntos de la curva, se realizaron mediciones de absorbancia a 765 nm con la ayuda de un espectrofotómetro.14
Determinación de carotenoides totales
Se utilizó el método espectrofotométrico a 470 nm, medido en un espectrofotómetro marca Hitachi U-2800 A(Tokyo, Jpon). Los resultados fueron expresados como mg de β-caroteno / 100 g de muestra.15
Determinación de la capacidad antioxidante
DPPH(2,2-Difenil-1-Picrilhidrazilo)
Se utilizó el trolox como estándar a partir de una curva patrón utilizándose el reactivo DPPH (2,2-difenil-1-picrilhidracilo). Las concentraciones de trolox fueron de 100 a 800 uM utilizando el metanol al 80% como disolvente. 16Se realizó la medición de la absorbancia a 515 nm en un espectrofotómetro marca Hitachi U-2800 A. Los resultados se expresaron como µmoles trolox /100 gr muestra.
ABTS(ácido 2,2- azinobis-3-etil benzotiazolina-6-sulfónico)
Se preparó un curva patrón de 5 a 0,5 mM de trolox en Buffer PBS (fosfato salino). La generación del radical ABTS+ se da por reacción de ABTS 7 mM con persulfato potásico 2,45 mM, incubados a temperatura de ambiente y en oscuridad por 16 h. El radical ABTS+ formado fue diluido con tampón PBS hasta obtener una lectura de absorbancia a 730 nm de 0,70 ( 0,02 (aproximadamente 1/75). Los resultados fueron expresados en µmoles trolox /100 gr muestra.17
FRAP (Poder antioxidante de la reducción férrica)
El oxidante en el ensayo FRAP se preparó mezclando 2.5 ml de TPTZ (2, 4,6-tripiridil-s-triazina)10 mmol preparado en 40 mmol de HCl, 25 ml de tampón acetato y 2,5 mL de 20 mmol FeCl3.H2O. La mezcla se denominó “reactivo FRAP”. 18Se pipetearon 200 µL de muestra, en un tubo de ensayo y se mezclaron con 3 mL del reactivo FRAP en un vortex. La mezcla se dejó reaccionar durante 30 min a 37∘C. La absorbancia de la mezcla fue leída a 594 mmol. Se prepararon tubos por triplicado para cada uno. Los resultados fueron expresados en µmoles trolox /100 gr muestra.
Análisis estadístico
Todos los análisis se realizaron por triplicado. Los resultados fueron procesados usando la Prueba de Kruskal-Wallis. La prueba LSD (Mínima diferencia significativa) fue realizada para determinar diferencias significativas de medias entre los tratamientos. Diferencias menores a p< 0,05 fueron consideradas significativas. El software SPSS para Windows 14.0 (SPSS, Chicago, IL) fue utilizado para realizar los análisis estadísticos.
Resultadosy discusión
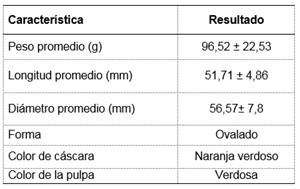
En la tabla 1 se presenta los resultados de las características morfológicas del Solanumquitoense Lam, donde se aprecia que los frutos son de forma ovalada, cascara de color naranja verdosa con una pulpa verdosa, con un diámetro promedio de 5 cm. Varios autores,2,4,6señalan que los frutos de lulo son de forma ovalada, globosa y que presenta un sabor ácido y un aroma fuerte, muy agradable. El diámetro es muy variable y va a depender de la fuente; según la National Research Council, 1) los frutos de lulo varían de 3 a 8 cm, la cual guarda relación con lo encontrado.
La tabla 2 presenta los resultados del análisis proximal y bromatológico del quito quito, donde se aprecia como macro componentes de mayor importancia el contenido de fibra y de carbohidratos. Estos valores son mayores a los reportados para el Solanum quitoense reportado por otros autores para frutos procedentes de Costa Rica.6 Cabe precisar que esta diferencia se debe posiblemente a la procedencia de la fruta y al estado de madurez del mismo.
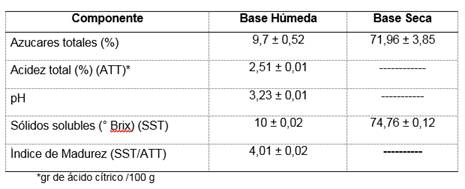
La tabla 3 muestra los resultados de los análisis físico-químicos del quito quito; donde se observa su elevado nivel de acidez y su bajo pH, los que guardan relación con su estado de madurez. Los ácidos orgánicos generan una gran contribución al color, aroma y sabor de las frutas y vegetales, con parámetros que varían durante la maduración y de la relación de los sólidos solubles entre la acidez. 19
Los valores de pH, acidez total y °Brix encontrados, son similares a los reportados por varios autores para frutos procedentes de Costa Rica6 y para la variedad Castilla procedente de Colombia.20
La concentración de azúcares solubles, aumenta durante la maduración y alcanza su máximo nivel en el momento de óptima madurez organoléptica. El dulzor final característico del fruto dependerá del tipo y concentración de los azucares presentes que, aunque influenciados en parte por las condiciones externas, obedecen principalmente al genotipo.21
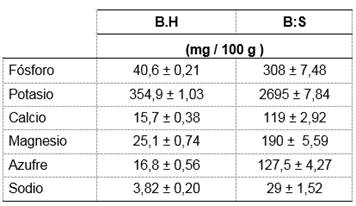
En cuanto al contenido de macroelementos (tabla 4, figura 1) minerales, los frutos estudiados presentaron altos contenidos de fosforo, potasio calcio y magnesio. El mineral en mayor proporción fue el potasio, y guarda relación con los encontrados por otros autores. 22
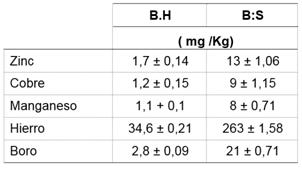
En cuanto a los microelementos minerales (tabla 5, figura 2), se encontraron valores importantes de hierro, cobre, boro y zinc. Dentro de los microelementos encontrados el hierro se encuentra en mayor proporción, incluso mayor al reportado por otros autores para frutos nativos de los andes de Colombia.22Cabe precisar que dichos valores se encuentran dentro de los rangos reportados para frutos nativos peruanos por el Centro de Alimentación y Nutrición del Instituto Nacional de Salud. 23
La tabla 6 muestra los resultados de los compuestos bioactivos. Al respecto, se observa que el quito quito presenta un alto contenido de vitamina C, mayor al reportado por otros autores; 6,8,24 para frutos de Solanumquitoense procedentes de Colombia, Ecuador y México.
Los valores encontrados para polifenoles totales del quito quito son comparables e incluso mayores a varios frutos exóticos, reportados por otros autores de Costa Rica y de Colombia. 6,25
Con relación al contenido de carotenoides estos guardan relación con los reportados para el quito quito o naranjilla de Costa Rica; asimismo, se ha identificado que el β-caroteno y la luteína son los principales carotenoides presentes en este fruto pudiendoser convertido al consumirse en retinol como precursor de la provitamina A.6
Tabla 7 Capacidad antioxidante de Quito Quito (SolanumquitoenseLam) según diferentes métodos de análisis

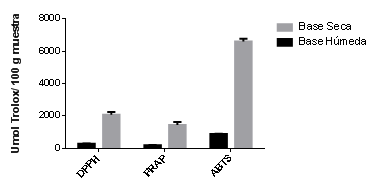
Fig. 3 Capacidad antioxidante en Quito Quito (SolanumquitoenseLam) con diferentes métodos de análisis
La tabla7 y figura 3 muestran los valores de capacidad antioxidante obtenidos por diferentes métodos de análisis. Al respecto, se puede observar una variación en cada uno de ellos, donde los valores obtenidos por el método ABTS fueron mayores a los de FRAP y DPPH, esta variación en los resultados en los tres métodos, se deben principalmente al tipo de compuesto antioxidante presente en el fruto; asimismo debido a posibles efectos sinergistas, aditivos o antagonistas que se puede presentan dentro de la matriz que los contiene. 26
Los valores reportados de antioxidantes para el fruto quito quito porlos métodosDPPH, ABTS y FRAP, resultan en algunos casos similares y en otros difieren a los reportados por varios autores; (8,6,25,27 esto debido, además de lo indicado anteriormente, a las diferencias en los métodos de extracción utilizados, debido a la variabilidad que existen en los solventes para la extracción. 28
Es necesario combinar al menos dos métodos de capacidad antioxidante, uno basado en la capacidad de reducción de metales y otro en la de captación de radicales libres; asimismo que las comparaciones de capacidad antioxidante entre dos muestras sólo son válidas para valores obtenidos en el mismo disolvente y con el mismo método de determinación; por lo que es difícil realizar comparaciones de la capacidad antioxidante obtenida con la de otros autores puesto que los métodos de extracción no fueron los mismos ya que se utilizaron diferentes disolventes. 28
Conclusiones
El quito quito (Solanumquitoense Lam) representa una fuente potencial de nutrientes, destacando su contenido de fibra, carbohidratos y de minerales; asimismo posee una serie de compuestos bioactivos (vitamina C, polifenoles y carotenoides)y capacidad antioxidante en elevada proporción en comparación de otros frutos; por lo tanto se puede concluir que los frutos de quito quito se pueden utilizar como un ingrediente bioactivo en el desarrollo de alimentos funcionales para la industria alimentaria futura.