Introducción
Los metales constituyen materiales indispensables para el desarrollo de la sociedad.El agotamiento de minerales de alta ley, alto costo de combustible, regulaciones ambientales más estrictas y la naturaleza intensiva en energía de los procesos pirometalúrgicos ha llevado a mayores esfuerzos hacia la búsqueda de nuevas alternativas de tratamiento de las lateritas niquelíferas a nivel mundial.1,2
En general, durante las operaciones de minado se producen materiales de desbroce de baja ley que no pueden ser tratados económicamente mediante los métodos convencionales. Sin embargo, la aplicación adecuada de la biolixiviación permite el beneficio de dichos materiales. Los procesos de obtención de metales basados en la actividad de microorganismos, ofrecen la posibilidad de recuperar metales de recursos minerales a los que no se puede acceder mediante técnicas convencionales. La biolixiviaciónse basa en la participaciónde ácidos orgánicos que constituyen productos intermedios del metabolismo de los microorganismos heterótrofos, como el ácido oxálico, cítrico, etc.en el proceso de solubilización de los metales.3) Las bacterias y hongos convierten los compuestos metálicos en sus formas solubles en agua y son biocatalizadores de este proceso llamado lixiviación microbiana o biolixiviación. Sin embargo, el costo operativo de la lixiviación fúngica es relativamente más alto que para la lixiviación bacteriana debido a la necesidad de una fuente de carbono orgánico para su crecimiento.1
En consecuencia, la bioextracción, también denominada biolixiviación o biorremediación, se presenta como una alternativa interesante al ser una tecnología relativamente simple, económica y que permite un control más estricto de la contaminación ambiental. Se puede considerar atractiva no sólo para la extracción del níquel, sino también para cobalto, manganeso, hierro y otros elementos metálicos.
Para la recuperación de especies metálicas de minerales lateríticos con microorganismos se emplean los ácidos orgánicos como agentes lixiviantes que pueden ser producidos por hongos filamentosos, entre los que se encuentra la especie Trichoderma, el cual es un hongo cosmopolita, que habita de forma natural en el suelo, en especial en aquellos que contienen materia orgánica o desechos vegetales en descomposición.4) La recuperación de especies metálicas a partir de la biolixiviación de los minerales lateríticos de Ni fue demostrada por Bosecker en 1986, utilizando hongos heterotróficos 5) quien demostró que de quince tipos diferentes de ácidos orgánicos ensayados en el intervalo de concentración de 0,05 a 0,5 mol/L; sólo el ácido cítrico en concentraciones de 0,5 mol/L extraía un 90 % de níquel y más de 60 % de hierro, del valor total presente en el mineral.
Se define como objetivo general de la investigación: Recuperar especies metálicas de interés, contenidas en residuos sólidos de la industria metalúrgica a partir del metabolismo de Trichoderma Harzianum Rifai (A-34) para su comercialización.
Fundamentación teórica
Cuba posee uno de los mayores yacimientos lateríticos del mundo, los cuales son procesados por vías hidrometalúrgicas. Los residuos sólidos representan el 90% de la masa mineral que entra al proceso metalúrgico. Las colas de desecho (figura 1) constituyen el principal residuo sólido. Estas se depositan en las presas de residuos anexas a las fábricas, lo que representa un problema ambiental de gran impacto.6,7
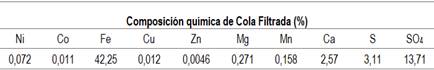
Según los informes geológicos, (6) las colas son un mineral de hierro complejo, que contiene valores metálicos que oscilan en los siguientes rangos: 45 - 53 % de FeO; 0,8 - 1,0 % de CaO; 0,2 - 0,5% de MgO; 2,0 - 6,0% de S; SiO2; 4,0 - 7,0 % de Al2O3; 2,3 % de Cr2O3; 0,1 -0,2 % de NiO; 0,01 - 0,02 % de CoO; 1,0 - 2,0 % de MnO. Es significativo en estas muestras, que el contenido de azufre se encuentra en un rango muy amplio entre 2,0 - 6,0 %, lo cual limita su uso directo para la industria siderúrgica. Por su parte el hierro se encuentra fundamentalmente, en forma de hematita (Fe2O3) y es característico además el alto grado de fineza de estos pasivos, donde más del 90% se concentra en la fracción - 40µm.
Los procesos de bioextracción pueden realizarse por especies bacterianas que oxidan el hierro ferroso y el azufre, tales el caso del Acidithiobacillus ferroxidans.8) Se ha demostrado que algunas especies de hongos como Aspergillus niger y Penicillium simplicissimum pueden disolver metales pesados. Los hongos utilizan los ácidos que producen en sus reacciones metabólicas para disolver el metal.8
La adherencia de los microorganismos al mineral es necesaria para el proceso de lixiviación microbiana, en este mecanismo directo, esta teoría se fundamenta por distintas investigaciones realizadas experimentalmente, las cuales corroboran la adhesión de estos microorganismos a la parte superficial de los minerales de sulfuro metálico.9) El primer reporte del mecanismo de biolixiviación se realizó por Silverman y Ehrlich en 1964.9
Entre las principales desventajas de la biolixiviación está la generación de cantidades significativas de soluciones ácidas. Además, este proceso transcurre en sistemas de naturaleza compleja y por tanto existen varios factores y parámetros que intervienen y afectan el transcurso de estos sistemas y, que están relacionados con los factores ambientales, las propiedades del mineral, parámetros microbiológicos o factores fisicoquímicos.10) Según (11) la ventaja de este proceso está dada por una precipitación más rápida de metales valiosos y la posibilidad de la precipitación del metal en forma de sulfuros.
La aplicación de los compuestos orgánicos, como los ácidos orgánicos, tiene ventajas con relación a los agentes reductores inorgánicos, ya que estos pueden ser regenerados, lo cual es una característica de mucha importancia desde el punto de vista económico. Las suspensiones sólido-líquido resultantes de la lixiviación suelen ser fácilmente filtradas, lo cual difiere de las suspensiones provenientes de procesos de lixiviación donde se utilizan agentes inorgánicos.
En general, se puede decir que los ácidos orgánicos producidos durante el desarrollo del microorganismo es el encargado de lixiviar losespecies metálicas presentes en el mineral, lo cual se facilita por el rompimiento de la estructura de éste. Se describe en la literatura que Aspergillus níger es uno de los microorganismos más empleados en los estudios sobre silicatos (aluminosilicatos) y Penicillum sp en silicatos de cinc y níquel.12 Se reportan estudios de biolixiviación en minerales lateríticos de baja ley13, en minerales lateríticos, saprolíticos y limoníticos.10
Autores como 14 utilizan una cepa aislada de Aspergillus níger en lateritas niquelíferas del yacimiento Moa. El microorganismo presenta una producción estable de ácidos orgánicos de hasta 85 g/L y frente al mineral alcanzó una tolerancia probada de hasta 1,26 g/L de Ni. Las extracciones obtenidas de Ni y Co fueron de 68% y 51 % respectivamente. Mediante técnicas de lixiviación microbiana,14) utilizaron microorganismos capaces de producir ácidos orgánicos. Las extracciones que se obtuvieron para el níquel en las colas y en las lateritas fueron de 59 y 64 % respectivamente y para el cobalto de 57 y 61 %. Se reporta el empleo de una mena de serpentina niquelífera del yacimiento Punta Gorda para llevar a cabo la lixiviación con ácidos orgánicos a temperatura ambiente.15 El ácido cítrico resultó ser el lixiviante más efectivo, logrando extracciones de Ni de 90 % a una concentración inicial de 0,5 M durante 20 días. Se obtienen valores de extracciones superiores al 90 % de cobalto a través de lixiviación en medio orgánico de menas lateríticas cubanas fuera de balance.16
La dificultad de esta vía radica en lo costoso que resulta la obtención por vía orgánica del ácido empleado en la lixiviación.17 Emplea ácido oxálico por un período de 20 días en la lixiviación de las colas de la lixiviación ácida de los nódulos marinos, con el cual se recupera el 98 % del molibdeno.
Las especies de hongos filamentosos pertenecientes al género Trichoderma se caracterizan por sobrevivir en suelos con diferentes cantidades de materia orgánicay en determinadas condiciones pueden ser anaerobios facultativos. Su distribución tan amplia está estrechamente relacionada con la alta capacidad enzimática que poseen para degradar sustratos, un metabolismo versátil y resistencia a inhibidores microbianos.18) El rango de temperatura para el crecimiento de Trichoderma oscila entre 15 y 30°C, con un óptimo de 25°C. Las condiciones adecuadas de humedad están en el 70 %, sin embargo, tiene la capacidad de crecer en un rango entre 20 % y 80 %. La condición de pH fluctúa entre 5,5 y 7,5, con un óptimo de 6,6. Si se encuentra en medios con pH alcalinos (por encima de 7,0) tiene la capacidad de acidificar el medio mediante la liberación de ácidos orgánicos.18,19,20,21,22
Trichoderma spp tiene la capacidad de degradar compuestos organoclorados, cloro, fenoles, insecticidas como el DDT, endosulfán, pentacloronitrobenceno y herbicidas como trifluralin y glifosato. Ayuda a la solubilización de fósforo, y propicia la síntesis de sustancias promotoras del crecimiento vegetal, mediante la producción de auxinas y giberelinas; también pueden producir ácidos orgánicos (glucónico, fumárico, y cítrico) que pueden disminuir el pH del suelo. Por otra parte, es altamente resistente a un rango de tóxicos; uno de los materiales tóxicos que resiste y cataboliza el hongo es el cianuro.19
Se desarrolla en diversos sustratos, lo cual facilita su producción masiva y la mayoría de los biopreparados se obtienen a base de las especies T. viride, T. virens, y en mayor proporción T. harzianum. La etapa bifásica es la más rápida, porque se produce el inóculo por fermentación líquida; que luego se usa para fermentar el sustrato sólido.4
En Cuba se aplica Trichoderma en los sistemas de cultivo abierto protegidos y semiprotegidos y son las más empleadas en el Manejo Integral de Plagas (MIP) en cultivos de importancia económica.23) La especie de mayor producción y utilización es Trichodermaharzianum, en cuyas formulaciones solo se utilizan las esporas.La producción de Trichodermaen Cuba se realiza utilizando principalmente por fermentación líquida o sumergida del hongo antagonista Trichodermaharzianum (Cepa A-34).4) Los compuestos generados por estos hongos como: metabolitos secundarios y enzimas producidas con gran potencial como biocontrolador, son desperdiciados en los medios usados después de la fermentación. Estos podrían ser aprovechados para mejorar la efectividad y el tiempo de acción de las formulaciones de bioplaguicidas.19
El control de parámetros como el tamaño de partícula, pH, temperatura, relación solido - líquido y grado de agitación es fundamental para garantizar que se logre obtener mayor rendimiento de extracción.
Materiales y métodos
El proceso experimental se desarrolló en la sala de fermentaciones perteneciente al Centro Nacional de Electromagnetismo Aplicado (CNEA), en la Universidad de Oriente, ubicada en Santiago de Cuba.
Los estudios de caracterización de las muestras fueron realizados en el Centro de Investigaciones del Níquel (CEDINIQ), Capitán Alberto Fernández Montes de Oca, ubicado en la carretera Yagrumaje Km 7, del municipio Moa, provincia de Holguín, Cuba.
En la figura 2 se muestra el esquema general de los experimentos de bioextracción de especies metálicas de interés contenidas en los residuales del proceso ácido de extracción de níquel.
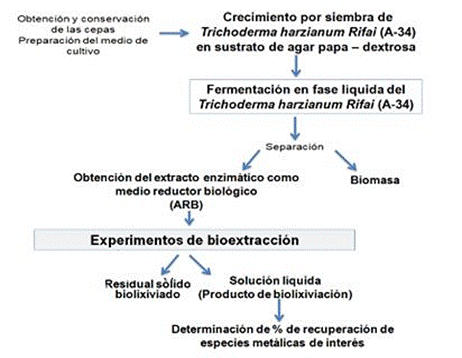
Fig. 2 Experimentos de bioextracción de especies metálicas de colas filtradas de la industria metalúrgica utilizando un agente reductor biológico
Se empleó Trichoderma harzianum Rifai cepa A-34, proveniente del banco de cepas del Instituto Cubano de Investigaciones de la Caña de Azúcar (ICIDCA), La Habana. Esta cepa es la que se emplea nacionalmente en el Programa de Protección de Plagas.
Se utilizó como medio de conservación Agar Papa Dextrosa (PDA, por sus siglas en inglés): Extracto de patata 4,0 g·L-1, Dextrosa 20,0 g·L-1, Agar - agar 15,0 g·L-1. Este es el medio reportado en la literatura como el de mejor crecimiento para Trichoderma. (4) Las cepas se conservaron en tubos de ensayo a una temperatura aproximada de 15 °C (figura 3).
Las características macroscópicas obtenidas del hongo se corresponden con investigaciones anteriores en las cuales se corrobora que las colonias de Trichodermaharzianum presentan un crecimiento micelial de color blanco y de textura algodonosa y luego se van tornando blanco-verdosas hasta llegar a un verde total con una textura aterciopelada levemente correosa.21
A partir de la recolección del hongo luego de la esporulación, se procedió a la fermentación en medio líquido hasta obtener la suficiente masa micelial del hongo para producir el medio reductor biológico.
Obtención del medio reductor biológico (ARB)
A partir de la masa micelial obtenida y con agua destilada estéril se realizó la incubación del hongo por 24h. Con el empleo de una zaranda eléctrica en la sala de fermentaciones perteneciente al Centro Nacional de Electromagnetismo Aplicado (CNEA) se mantuvo la agitación a 60 rpm con el fin de extraer las enzimas y metabolitos secundarios encargados de realizar la reducción (figura 4).
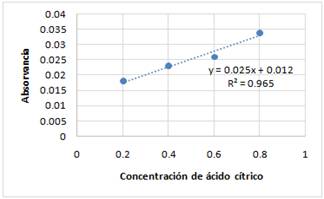
La determinación de la concentración de ácido cítrico presente en el agente reductor biológico se realizó por método óptico, empleando el espectrofotómetro UV-VIS con longitud de onda de 214 nm. El ácido cítrico es el ácido orgánico con mayor presencia y resulta más efectivo como agente lixiviante para la extracción de especies metálicas como Ni, Co, Cu, MgO, etc.14
Los valores de absorbancia para cada una de las diluciones se presentan en la (figura 5) y, el valor de absorbancia de ácido cítricopresente en el agente reductor biológico obtenido fue de 0,446 UA. La ecuación de la línea recta obtenida y = 0,025x + 0,012, permitió determinar la concentración de ácido cítrico presente en el agente reductor biológico la cual fue de 17 g/mL, con un valor de pHinicial = 4.
Bioextracción de especies metálicas contenidas en las colas filtradas resultantes del proceso ácido de extracción de níquel
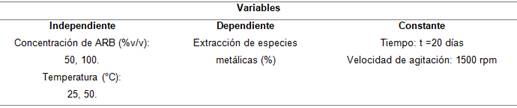
Se empleó un diseño experimental factorial 22 con dos variables independientes, X1 y X2, y dos niveles de experimentación (tabla 1).
donde:
X1 = Concentración de agente reductor biológico (50 y 100 %v/v)
X2 = Temperatura (25 y 50°C)
Y1= extracción de especies metálicas (%)
Tabla 1 Condiciones del experimento en batch de bioextracción de especies metálicas contenidas en las colas del proceso ácido de extracción de níquel
Los experimentos de bioextracción de especies metálicas contenidas en las colas del proceso ácido de extracción de níquel, se realizaron a 25 y 50°C, en matraces 250 mL que contenían 40g de cola filtrada y 100mL de Agente Reductor Biológico (ARB), con concentraciones de ARB de 50 y 100 %v/v, considerando estudios presentados en la literatura 24,25 donde se establecen condiciones de operación. El mineral analizado sale como suspensión de la última etapa de lavado del proceso acido de extracción de níquel y se bombean en forma de pulpa hasta la presa de colas, donde ocurre el proceso de decantación (piscina sur) donde se recolecta el licor con contenido de níquel + cobalto disuelto, el cual es recirculado a la planta de lavadero. Una vez culminado el proceso de decantación queda el mineral con una clase de tamaño de partícula de -0,87mm, por lo que no fue necesario emplear etapas de reducción de tamaño.
Se sometió a un proceso de agitación durante un tiempo de 20 días y una velocidad de agitación de 1500rpm. Se procedió a obtener el líquido claro a partir de filtración con papel de filtro de celulosa Whatman # 4 de 125 mm de diámetro. El lodo producto o sólido lixiviado se secó en estufa a 100°C durante 20 h y los licores fueron centrifugados a 3000 rpm, durante 20 min.
La caracterización de las muestras sólidasse realizó por el método de polvo en un Difractómetro X'PERT3 de PANalytical con las siguientes condiciones: Barrido tipo Gonio en [2θ] registro angular desde 4,004 2 hasta 79,996 2 con distancia de paso en 2θ de 0,008 0 con radiación de Cu y filtro de níquel. La diferencia de potencial es de 45 kV y corriente de 40 mA. La calibración del equipo se chequeó con patrón externo de silicio. El análisis cualitativo de fases se realizó con la utilización del programa HighScore de Panalytical.
La determinación de cobre, cinc, magnesio, níquel, cobalto, hierro y manganeso se realizó por el método de Espectrofotometría de Absorción Atómica (EAA), siguiendo la técnica UPL-PT-A-07.26 La determinación de pérdida por ignición en los sólidos, determinación de la fracción magnética, así como la determinación de azufre total se realizó por el método gravimétrico empleando las técnicas UPL-PT-G-0127, UPL-PT-G-05 28 y UPL-PT-G-06 29 respectivamente. La determinación de hierro total se realizó por el método volumétrico empleando la técnica UPL-PT-V-02.30
Determinación de los porcentajes de extracción de especies metálicas contenidas en los residuales sólidos
Se realizó el balance de masa considerando la masa en gramos de los sólidos antes de poner en contacto con el ARB y masa del licor lixiviado una vez culminado el experimento de bioextracción, como se presenta en la ecuación 1.
Resultados y discusión
Las figuras 6 y 7 muestran el contenido de elementos metálicos en licor lixiviado que resultaron de los experimentos de bioextracción a temperatura ambiente y a la temperatura de 50°C, cuando se emplean diferentes concentraciones de ARB. Se consideró para ello, la composición química inicial de la cola filtrada (%), que se presenta en la tabla 2.
En el licor lixiviado, a las temperaturas de trabajo fijadas 25 y 50°C, empleándose concentraciones de 50 y 100 % de ARB, se obtuvieron concentraciones de níquel, cobalto, magnesio y cobre, este último, con concentraciones muy bajas en comparación con el resto de los metales presentes en el licor resultante de la biolixiviación. Con soluciones al 25 % del ARB, la concentración de los elementos en el líquido fue lo suficiente baja, de modo que no se hizo sensible a la medición con la técnica.
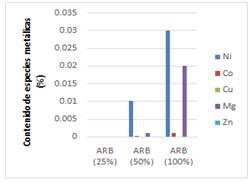
Fig. 6 Especies metálicas contenidas en el licor lixiviado, a concentraciones de 50 y 100% de ARB a la temperatura ambiente.
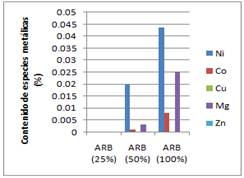
Fig. 7 Especies metálicas contenidas en el licor lixiviado, a concentraciones de 50 y 100 % de ARB a la temperatura de 50°C
La comparación de los gráficos de las figuras 6 y 7 sugiere que el contenido de especies metálicas contenidas en las colas del proceso HPAL es superior cuando se emplea una concentración de ARB de 100 % a la temperatura de 50°C. Esto se debe a que el incremento de la temperatura, provoca la disminución del pH al modificar la actividad de los iones de la solución, volviendo el medio más ácido, favoreciendo así la lixiviabilidad en las colas filtradas del proceso ácido de extracción del níquel objeto de estudio, como se muestra en las figuras 8 y 9.
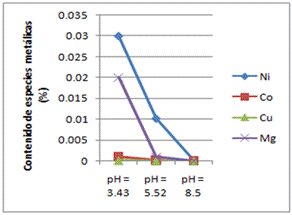
Fig. 8 Influencia del pH en la lixiviabilidad de las colas de desecho del proceso ácido de extracción de níquel. Especies metálicas contenidas en el licor lixiviado a la temperatura ambiente
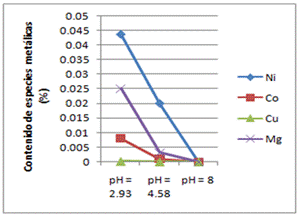
Fig. 9 Influencia del pH en la lixiviabilidad de las colas de desecho del proceso ácido de extracción de níquel. Especies metálicas contenidas en el licor lixiviado a la temperatura ambiente de 50°C
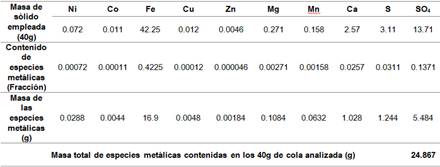
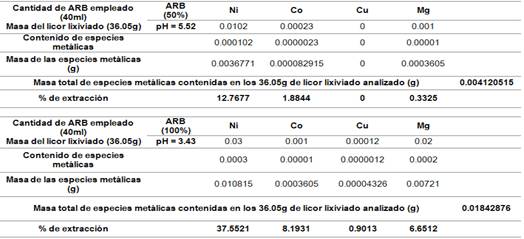
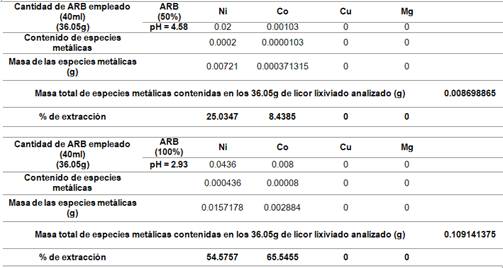
La tabla 3 muestra el valor en masa (g) de las especies metálicas obtenidas en la caracterización química del sólido (colas del proceso de HPAL) reportado en la tabla 2. La misma se tiene en cuenta para los cálculos de los balances de masa y conocer el contenido en masa especies metálicas que pasan al licor lixiviado.
Los resultados obtenidos y reflejados en las tablas 4 y 5, sugieren que se logran mejores extracciones de las especies metálicas al emplearse una concentración de ARB de 100% a la temperatura de 50°C. Los valores de pH se obtuvieron del licor lixiviado una vez culminados los experimentos de bioextracción (biolixiviación) de especies metálicas contenidas en las colas del proceso HPAL, cuando se emplean concentraciones de ARB de 50 y 100 porciento, los mismos son los que muestran en las figuras 8 y 9.
La extracción de níquel durante la biolixiviación a pH 3.43 fue 37.5521 % al cabo de 3 semanas, la extracción de cobalto 8.1931% y la extracción de cobre y magnesio siguieron a la de níquel bajo las mismas condiciones de pH y temperatura. El incremento de la temperatura, provoca la disminución del pH al modificar la actividad de los iones de la solución, volviendo el medio más ácido, favoreciendo así la lixiviabilidad en las colas del proceso HPAL.
Los porcentajes de extracción obtenidos son inferiores a los obtenidos por (2) quien analizó la influencia de la concentración inicial de diferentes ácidos orgánicos en disolución (0,05- 0,5 m), la densidad de la pulpa (2 - 20 %) sobre la recuperación de níquel y cobalto en pulpas diluidas, alcanzándose más de un 80 % de recuperación de níquel cuando la concentración inicial del ácido cítrico es de 0,5 m. En cambio los porcentajes de extracción obtenidos son relativamente superiores a los obtenidos por 24) en tanques agitados a 30 °C y pH entre 2 - 5. La extracción de níquel de la pentlandita y la pirrotita durante la biolixiviación a pH 2 y 3 fue 49 - 86 % al cabo de 3 semanas y la extracción de cobalto siguió a la de níquel en la mayoría de las condiciones.
La comparación de los resultados obtenidos con el ARB obtenido de Trichoderma harzianum Rifai (A-34) y de la biolixiviación fúngica de metales procedentes de catalizadores usados en refinerías, sugiere que los porcentajes de extracción son relativamente superiores. Los autores 31) afirmaron que un máximo del 54,5%Al, 58,2% Ni y 82,3% Mo fue biolixiviado por A. niger a 1% p/v de pulpa densidad en 60 días, y además, se encontró que el ácido oxálico es el principal lixiviante entre los metabolitos producidos por el hongo, lo que se atribuyó a un pH=6 y según 32) se sabe que un pH alto promueve la producción de ácido oxálico debido a la inducción de la enzima oxaloacetato hidrolasa.
Conclusiones
1. El contenido de especies metálicas contenidas en el licor lixiviado obtenido de los experimentos de bioextracción en las colas del proceso HPAL es superior cuando se emplea una concentración de ARB de 100 % a la temperatura de 50 °C, lo que favorece la lixiviabilidad en las colas filtradas objeto de estudio.
2. La extracción de níquel durante la biolixiviación a pH 3,43 fue 37,552 1 % al cabo de tres semanas, la extracción de cobalto 8,193 1 % y la extracción de cobre y magnesio siguieron a la de níquel bajo las mismas condiciones de pH y temperatura. El incremento de la temperatura, provoca la disminución del pH al modificar la actividad de los iones de la solución, volviendo el medio más ácido, favoreciendo así la lixiviabilidad en las colas del proceso HPAL.