Introducción
Los tremátodos son parasitos que causan en el hombre y los animales: Esquistosomiasis (Bilharziosis), Angiostrogilosis, Fasciolosis y Parangominosis, entre otras enfermedades; pero antes de desarrollarse y ser infectantes para los mamíferos, estos organismos están obligados a pasar por diferentes moluscos como hospederos intermediarios (Perera et al., 1983; Amunarriz, 1991). La esquistosomiasis es la de mayor significación actualmente, al afectar a millones de personas, fundamentalmente en países subdesarrollados (Knopp et al. 2012; Rollinson et al. 2013).
La Fasciolosis también constituye una zoonosis importante de gran interés en el mundo, principalmente en áreas ganaderas. En Cuba, se refiere la presencia de dos especies de moluscos de agua dulce: Galba cubensis (Pfeiffer, 1839) (Lymnaea cubensis, Fossaria cubensis) y Pseudosuccinea columella (Say, 1817) (L. francisca, L. columella), como hospederos intermediarios de Fasciola hepatica (duela de hígado) (Vázquez et al., 2014). La primera fue causa de un brote importante en humanos de Fasciolosis en el Municipio Esmeralda, Provincia Camagüey, en 1999, en el cual afortunadamente no hubo fallecidos; no obstante, tanto en Cuba como en otros países, la morbosidad que más se reporta es en ganado bovino y ovino, con importantes costos económicos debido a la disminución de producción de leche y carne (Vázquez et al., 2009; Khan et al., 2013), así como la confiscación de los hígados (Palacio et al., 2017).
Los molusquicidas químicos se han empleado en los programas destinados a reducir la morbi-mortalidad de la esquistosomiasis; sin embargo, frecuentemente estos productos tienen efectos adversos irreversibles en los ecosistemas y poseen precios inaccesibles para las economías de los países del Tercer Mundo (McCullough, 1992). Desde hace algunas décadas la Organización Mundial de la Salud (OMS) ha registrado un elevado número de plantas con potencial molusquicida, que pueden tener un importante papel en el control de la Esquistosomosis y otras enfermedades tropicales, y en contraste con los productos sintéticos son menos agresivas al ambiente. A pesar de ello, no abundan los reportes de programas nacionales de control malacológico empleando esta alternativa, que pudiera ser una opción efectiva y menos peligrosa al ambiente (WHO, 1983; Marston y Hostettmann, 1985; Singh et al., 2010).
Sapindus (Sapindaceae) es un género constituido por una docena de especies de árboles o arbustos distribuidos por los trópicos y subtrópicos. Abreu (2005) y Goyal et al., (2014) revisaron la etnobotánica, actividades biológicas y fitoquímica de las tres especies más prominentes: S. saponaria, S. mukorossi y S. trifoliatus, las que contienen saponinas triterpénicas y se refieren con actividad molusquicida. En la cuenca del Caribe crece S. saponaria L. (S. inaequalis D.C., S. emarginatus Willd.), conocido como “jaboncillo” (León y Alaín, 1953; Roig, 1974).
El objetivo principal de este trabajo es determinar a nivel de laboratorio la actividad molusquicida de S. saponaria sobre G. cubensis, para proponer esta planta como candidato en el control ecológico de este caracol.
Materiales y métodos
Molluscos
Los ejemplares de G. cubensis se colectaron en la Zanja de Vázquez, pequeño biotopo de aproximadamente 50 m de largo por 90 cm de ancho, ubicada dentro de la Unidad Provincial de Vigilancia y Lucha Antivectorial de Camagüey (UPVLA-C). Los moluscos, una vez identificados en el Laboratorio de Malacología Médica de la UPVLA-C, fueron mantenidos en el laboratorio por varias generaciones. Su tamaño (alto de la concha) osciló entre 10 y 12 mm . Los experimentos se realizaron en condiciones controladas de humendad y temperatura (78 % ± 1; 230 C ± 1).
Material vegetal
El pericarpio de S. saponaria fue almacenado por seis meses en un lugar a fresco y seco. La colecta del fruto se realizó en la finca “Taburete”, en la ciudad de Camagüey, y la auntentificación botánica se realizó por Eddy Martínez, curador del herbario del Centro de Investigaciones Ambientales de Camagüey (voucher: HACC-970). Luego de secarse a 40 ° C en un horno con recirculación de aire y pulverizado, se obtuvo un extracto fluido con una solución etanólica (800) mediante el método de percolación fraccionada (Soler et al., 1992).
Bioensayo
La acción molusquicida del extracto en condiciones de laboratorio se realizó según la metodología establecida por la OMS (1983). Se realizaron tres series experimentales con 24 moluscos en cada una (72 en total) por cada una de las seis concentraciones del extracto evaluadas, se colocaron ocho caracoles en cada placa de Petri (110 mm de diámetro y18 mm de alto) con un papel de filtro de grado fino en su fondo y el testigo con agua declorinada. El volumen final de los extractos y del testigo fue de 5 ml. La mortalidad se leyó a las 24; 48 y 72 h, esta se determinó por la inmovilidad de los moluscos y se confirmó mediante la observación de los latidos del corazón de los caracoles, los cuales se desecharon (Malek and Cheng, 1974). Para determinar las concentraciones letales (CL), se tomaron diferentes valores con mortalidades que oscilaron entre 5 y 100 %, los que fueron procesados en el programa Probit-Log, mediante la transformación del log10 de las concentraciones (Raymond, 1985).
También se evalúo el efecto del extracto sobre la frecuencia cardiaca de los moluscos en tres grupos de diez caracoles cada uno: a la CL50, CL90 y con agua declorinada como testigo. La frecuencia cardiaca se determinó durante 1 min cada 20 min, por un período de 2 h . La observación de los latidos del corazón se realizó a través de la concha del molusco colocado con la abertura semilunar hacia arriba mediante un microscopio estereoscópico (Malek y Cheng, 1974). Se consideró como tiempo cero el instante de la aplicación del extracto vegetal.
Resultados y discusión
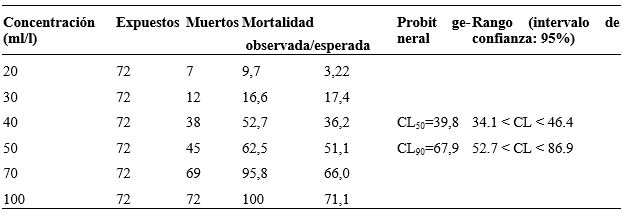
La actividad molusquicida del gradiente de concentraciones de las soluciones etanólicas de S. saponaria se muestra en la Tabla 1, en la que se aprecia un patrón del efecto dependiente de la concentración. Las concentraciones letales obtenidas de estos resultados fueron CL50= 39,8 mg/l y CL90= 67,9 mg/l, con un CHI2= 12,11; g.l. = 4; Prob. = 0,9834 y la ecuación de regresión fue: Y = 5,0875 + 5,6644 (X - 10,616), donde X es la concentración del extracto y Y la mortalidad del molusco.
Tabla 1 Actividad molusquicida in vitro del extracto etanólico del fruto de Sapindus saponaria L. sobreGalba cubensis (Pfeiffer, 1839) y concentraciones letales (CL 50 y CL 90 )
Mozle (1939), citado por Ojewole (2004) y Torrealba et al. (1953), en estudios desarrollados en África y en Venezuela describieron S. saponaria como una planta promisoria para el control de Bulinus africanus y Australorbis glabratus, respectivamente. Desde entonces el efecto de varias partes de esta planta y de otras especies de Sapindus han sido objeto de estudio como molusquicida. El extracto metanólico y saponinas del fruto de S. saponaria se halló que fueron activos frente a B. glabrata, con una CL100 en 24 h de 5 - 10 ppm (Ribeiro et al., 1995); esto es similar a la actividad reportada de este fruto en Melania scabra (Muley, 1978) y Melanoides tuberculata, un caracol interés de distribución pantropical (Iannacone et al., 2013).
En Ecuador también mostraron buena actividad in vitro en Pomacea canaliculata, una importante plaga agrícola, mezclas de extractos acuosos de S. saponaria con Solanum mammosum (Solanacaeae) y con Jatropha curcas (Euphorbiaceae), principalmente la primera mezcla con una CL50= 17,78 ppm (Quijano et al., 2014). Los mismos autores reportan en condiciones de campo que S. saponaria (100 %) fue más activo que la formulación con S. mammosum (50:50 m/m), con una CL50= 66,6 ppm y CL50= 192,3 ppm, respectivamente. No obstante, las CL90 obtenidas indican que ambas formulaciones pudieran no ser consideradas como buenos candidatos para programas de control de moluscos (Quijano et al., 2016).
Sapindus spp. han sido descritas con actividad molusquicida, S. laurifolius en Bellamya bengalensis, S. trifoliatus en Lymnaea luteola y, S. mukorossi en P. canaliculata (Sukumaran et al., 2008; Huang et al., 2003; Deshmane y Nanaware, 2011). Upadhyay y Singh (2012) refieren que frente a L. acuminata, el fruto de S. mukorossi fue más activo que otros extractos menos polares; mientras que fracciones purificadas fueron más activas que algunos productos comerciales en este molusco, considerado el principal hospedero de Fasciola gigantica en el norte de la India.
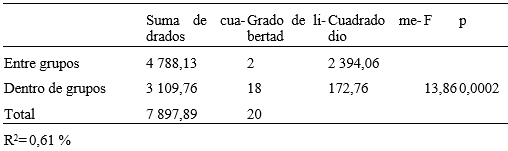
El efecto de los extractos sobre la frecuencia cardiaca a la CL50 y CL90, se representa en la Fig. 1. Como se muestra en la Tabla 2, se hallaron diferencias significativas entre la frecuencia de los latidos de ambas concentraciones letales, también entre la CL90 y el grupo control, pero no con la CL50.
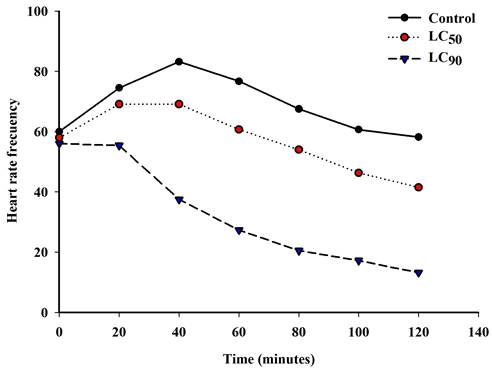
Fig. 1. Frecuenciacardiaca a las CL50 y CL90 del extracto etanólico del fruto de Sapindus saponaria L. sobre Galba cubensis (Pfeiffer, 1839).
Tabla 2 ANOVA del efecto sobre la frecuencia cardiaca en Galba cubensis (Pfeiffer, 1839) a las CL 50 y CL 90 del extracto etanólico del fruto de Sapindus saponaria L.
A diferencia del grupo con la CL90, en el caso del grupo testigo hay un ligero aumento de los latidos hasta los 40 min, al igual que en los moluscos tratados con la CL50 en los primeros 20 min, lo cual pudiera deberse a la influencia de factores estresantes del propio medio, así como la manipulación de los moluscos durante el experimento. Se pudo verificar que a partir de los 40 min existe una declinación en la cantidad de latidos del corazón en los dos grupos de estudio.
Otros extractos de plantas obtenidos de la flora cubana han mostrado efecto en la frecuencia cardiaca de Biomphalaria havanensis, un caracol de relevancia médica, que mostró mortalidades importantes por extractos de Agave legrelliana (Agavaceae), A. franzosinii and A. fourcroydes, un género que también contiene saponinas como metabolito activo, pero del tipo esteroidal (Díaz and Ferrer, 1996; Hevia et al., 2009). La frecuencia cardiaca es una forma importante de determinar el efecto molusquicida de un producto (Malek y Cheng, 1974), en este sentido se evidencia que el extracto S. saponaria la disminuye; por tanto, las funciones vitales del molusco.
En el pericarpio de S. saponaria y de Sapindus spp., como uno de los compuestos activos se han descrito saponinas monodesmosidicas tipo hederagenina (ácido 23-hidroxioleanólico), las que son responsables de sus efectos detersivos y de la actividad biológica (Lemos et al., 1992; Ribeiro et al., 1995; Abreu, 2005; Goyal et al., 2014). Estos glucósidos son particularmente tóxicos para animales de sangre fría, como mecanismo de acción biocida adjudicado a Sapindus spp. se propone la pérdida de agua, una modificación en la permeabilidad de la membrana del molusco que puede causar la muerte cuando se afectan las mucosas de las branquias (Lacaille_Dubois and Wagner, 1996; Chaieb, 2013). Las saponinas bidesmosídicas son más solubles en agua y generalmente inactivas biológicamente (Lacaille_Dubois y Wagner, 1996).
Además de las saponinas tipo hederagenina, Murgu y Rodríguez (2006) aislaron oligoglucósidos sesquiterpénicos acíclicos como compuestos mayoritarios de S. saponaria en Brasil y evaluaron también la dinámica de acumulación de estos metabolitos en diferentes estadios del desarrollo del fruto.
Un requerimiento importante para el éxito en el empleo de molusquicidas de origen vegetal, además de su actividad biológica en los moluscos, huevos y juveniles, es la aplicación combinada de otras técnicas para el manejo integrado de enfermedades causadas por tremátodos, primeramente, a partir de recursos locales (Knopp et al., 2005; Singh et al., 2010; Kiros et al., 2014). En este sentido se han propuesto especies que también tienen otros usos como Moringa oleifera (da Silva et al., 2013). En el caso de S. saponaria, constituye una planta de creciente interés en Sur América, donde se han desarrollado investigaciones para su explotación tecnológica y manejo silvicultural (Sánchez y Silva, 2008; Flechas et al., 2009).
El hecho de que el material vegetal de S. saponaria empleado posea efecto a escala de laboratorio sobre G. cubensis, aunque no fuera colectado recientemente, indica que la degradación de los compuestos activos que existió no fue significativa o, que en este proceso se los compuestos que se generaron también fueron activos. Esta posibilidad debe ser considerada en futuros estudios, debido a que un tiempo de vida medio prolongado de actividad constituye una cualidad deseada para un producto molusquicida de origen vegetal. Nuevas perspectivas de interés emergen con esta planta como un candidato que puede ser empleado en el control de huéspedes intermediarios de parasitosis tremátodos en animales y humanos. Es necesario proseguir con estudios adicionales en condiciones de campo.














