INTRODUCCIÓN
La diabetes mellitus (DM) tipo II se ha expandido progresivamente hasta alcanzar la magnitud de pandemia, y es responsable de 90 % a 95 % de toda la población diabética. 1 Es un grupo heterogéneo y complejo de enfermedades que involucra múltiples factores patogénicos y complicaciones multiorgánicas. La hiperglucemia es su marcador más constante y directo. 2 La úlcera de pie diabético (UPD) es una de las complicaciones más temidas ya que conduce a la amputación de extremidades inferiores, con la consecuente discapacidad, exclusión social y mortalidad temprana. La población diabética contribuye con el 80 % de todas las amputaciones no traumáticas de miembros inferiores a nivel mundial. 3
En la patogénesis de la diabetes ocurre una interacción multifacética entre la UPD y su hospedero. 4 Las heridas diabéticas exhiben una compleja red de citoquinas inflamatorias, especies reactivas del oxígeno (ROS) y el nitrógeno (RNS), productos avanzados de glicación (AGE), proteasas de la matriz extracelular (MEC), y una biopelícula polimicrobiana que, en conjunto, contribuyen a la senescencia de las células de la herida, la cronificación de la lesión y el desbalance en la homeostasia del paciente. 5 Este daño funcional parece relacionarse con una desregulación en la disponibilidad y actividad de los factores de crecimiento. 6 El sistema formado por el factor de crecimiento epidérmico (EGF) y su receptor (EGFR) se deteriora como consecuencia de la diabetes, 7 lo que comprende la reducción del EGF circulante, salival y tisular; y el descenso de la actividad tirosina quinasa del EGFR. 8
El EGF es el factor de crecimiento más ampliamente estudiado en relación con la cicatrización. La biodisponibilidad local prolongada y la estimulación oportuna de los receptores son requisitos para un impacto significativo del EGF en el cierre de la herida. 9 Como alternativa para evadir el ambiente hostil de la UPD y para asegurar una adecuada disponibilidad del EGF a su receptor en células respondedoras, nuestro grupo ha realizado infiltraciones intralesionales de EGF durante más de una década. 10 En estos estudios, se ha mostrado la capacidad intrínseca del EGF para desencadenar las acciones biológicas requeridas para la cicatrización de UPD. 11 Amplios estudios de farmacovigilancia confirman la eficacia clínica del procedimiento de infiltración en términos de seguridad y de respuesta de los pacientes, con reducciones del riesgo de amputación absoluto y relativo de 16 % y 71 %, respectivamente; y solo un 5 % de re-ulceración durante un período de seguimiento de 12 meses. 12,13
En esta investigación, nos propusimos como objetivos determinar el perfil molecular de los pacientes con UPD y caracterizar los efectos sistémicos del tratamiento intralesional con EGF en tales pacientes atendiendo a marcadores de balance redox, componentes de la vía de los AGE, factores relacionados con la estabilidad de la MEC y marcadores pro-inflamatorios. El presente trabajo recoge 2 estudios independientes y extemporáneos. 14,15 Los resultados demuestran que la terapia intralesional con EGF se asocia a la recuperación del equilibrio redox sistémico, la atenuación de marcadores pro-inflamatorios, el control de la vía de los AGE, y la restauración del equilibrio entre las fuerzas pro-degradativas y pro-sintéticas de la MEC.
MÉTODOS
Consideraciones éticas
Los protocolos de los estudios están en concordancia con las guías éticas recogidas en la Declaración de Helsinki (1975). Además, estos protocolos fueron revisados y aprobados por los comités de ética del Instituto Nacional de Angiología y Cirugía Vascular (INACV) y del Centro de Atención al Diabético (CAD), ambos en La Habana, Cuba. Todos los pacientes y los voluntarios no diabéticos firmaron un documento de consentimiento informado antes de ser reclutados para el estudio.
Poblaciones en estudio
Se incluyeron pacientes con UPD neuropáticas moderadas a severas según la escala de Wagner (16) (n=13 en el primer estudio y n=11 en el segundo). Todos los pacientes forman parte del Programa nacional para la atención integral al paciente diabético, que incluye la infiltración intralesional de EGF humano recombinante (Heberprot-P).
Poblaciones control
En el primer estudio, como referencia respecto al grupo con UPD, se incluyeron grupos de pacientes diabéticos metabólicamente compensados (n=12) y no compensados (n=12). Estos pacientes se reclutaron en el CAD. El criterio de compensación se basó en la hemoglobina glicada (HbA1c) ( 7 %. 17 Adicionalmente, se reclutaron 13 voluntarios no diabéticos, aparentemente sanos, de edades similares a las de los pacientes, que constituyeron el grupo control para todos los pacientes diabéticos.
EGF humano recombinante
El EGF humano recombinante (Heberprot-P [HeberBiotec S.A., Cuba]), se obtuvo en el Centro de Ingeniería Genética y Biotecnología (La Habana, Cuba). 18 Los pacientes recibieron 75 µg de EGF mediante infiltración intralesional, 3 veces por semana, en días alternos. El medicamento y el procedimiento para su administración se han descrito en detalle previamente. 19,20
Colecta de muestras
Se colectaron 10 mL de sangre de cada individuo, en ayunas. Para los pacientes con UPD, la colecta en “tiempo cero” (T0) se corresponde con la muestra obtenida antes de la primera infiltración con EGF. La muestra “tiempo uno” (T1) se obtuvo de 3 a 4 semanas después, cuando se habían completado de 9 a 12 sesiones de infiltración.
Determinaciones bioquímicas
Todos los parámetros bioquímicos se determinaron por métodos espectrofotométricos utilizando juegos de reactivos comerciales de las firmas Immundiagnostik (Alemania), Oxis International Inc. (EE.UU.), Abcam (Gran Bretaña), Innovative Research (EE.UU.), Cusabio (China), Donglin (China), BlueGene (China), Alpco (EE.UU.). Los marcadores de estrés oxidativo incluyeron capacidad oxidante total, productos avanzados de oxidación de proteínas (PAOP), organoperóxidos totales (OPT), malonildialdehído (MDA), y relación nitrito/nitrato. Los marcadores de reserva antioxidante incluyeron: capacidad antioxidante total; estado de los grupos sulfhidrilo (SH), y superóxido dismutasa (SOD). Se evaluaron los niveles circulantes de AGE, su receptor (RAGE), pentosidina (PTD) y HbA1c. También se cuantificaron la metaloproteasa de la matriz (MMP) -9 y el inhibidor tisular de MMP (TIMP) -1. Los reactantes de fase aguda fueron eritrosedimentación y proteína C reactiva (CRP); mientras que los marcadores pro-inflamatorios incluyeron interleuquina (IL) -1β, IL-6, y molécula de adhesión intercelular 1 (ICAM-1). En cada caso, se siguieron las instrucciones del fabricante.
Perfil de citoquinas
En el segundo estudio, se determinaron 17 citoquinas mediante ensayos en perlas magnéticas (HCD8MAG15 K17PMX human [Millipore Sigma Corp., EE.UU.]). Se analizaron muestras de los pacientes en T0 y T1, según las instrucciones del fabricante. La cuantificación se realizó en un equipo Luminex MAGPIX utilizando el programa xPONENT 4,2 y se analizó con el programa Milliplex Analyst (v5.1, Millipore) con una regresión lineal de 5 parámetros (r2 > 0,99 en todos los casos).
Análisis estadístico
Los análisis estadísticos se realizaron utilizando el programa GraphPad Prism 6,01. La distribución normal y la homogeneidad de varianza se analizaron mediante las pruebas de D’Agostino-Pearson y Brown-Forsythe, respectivamente. En caso de que los datos cumplieran con la distribución normal y la homogeneidad de varianza, las comparaciones entre grupos se realizaron mediante el ANOVA de una vía seguido por la prueba de comparaciones múltiples de Holm-Sidak. En caso contrario, se utilizó la prueba de Kruskal-Wallis seguida por la prueba de comparaciones múltiples de Dunn. Las comparaciones entre T0 y T1 se realizaron mediante análisis de medidas repetidas. Los datos con distribución normal se analizaron mediante la prueba t de Student para datos pareados. De lo contrario, se realizó la prueba de Wilcoxon. Los valores de p < 0,05 se interpretaron como indicativos de diferencias estadísticamente significativas.
RESULTADOS Y DISCUSIÓN
Esta investigación abarca 2 estudios independientes y extemporáneos. En el primer estudio se caracterizó un grupo de pacientes con UPD en comparación con diabéticos sin úlceras, compensados y no compensados, e individuos no diabéticos; atendiendo a marcadores de balance redox, componentes de la vía de los AGE y elementos relacionados con la estabilidad de la MEC. A continuación, se evaluó la respuesta sistémica de los pacientes con UPD al tratamiento intralesional con EGF atendiendo a los mismos parámetros. El segundo estudio se enfocó hacia los reactantes de fase aguda y marcadores pro-inflamatorios. Asimismo, se validaron algunos de los resultados obtenidos en el estudio anterior.
Características demográficas
En el primer estudio se evaluaron 4 grupos experimentales: pacientes con UPD (n = 13), diabéticos sin úlceras compensados (n = 12) y no compensados (n = 12), e individuos no diabéticos (n=13). No se encontraron diferencias significativas entre estos grupos en relación con la edad y el tiempo de evolución de la diabetes. En el segundo estudio, se caracterizaron 11 pacientes con UPD. El sexo masculino predominó en los grupos con UPD y en los no diabéticos, mientras que entre los diabéticos sin úlceras predominó el sexo femenino. Los pacientes tenían edades entre 30 años y 85 años. El tiempo de evolución de la diabetes estuvo en el rango de 2 años a 40 años. En los grupos con UPD, el tiempo de evolución de las heridas estuvo entre 7 d y 270 d.
Caracterización de los pacientes con UPD
En la tabla 1 se muestran los resultados de la caracterización molecular de los grupos estudiados. Los pacientes con UPD mostraron niveles de capacidad oxidante, PAOP, y MDA significativamente superiores con respecto al resto de los grupos experimentales. Con relación a la concentración de OPT, aunque no se detectaron diferencias estadísticas, los pacientes con UPD exhibieron valores que triplicaron los de los restantes grupos.
Los parámetros de reserva antioxidante mostraron un comportamiento opuesto: los pacientes ulcerados exhibieron niveles significativamente inferiores de capacidad antioxidante y grupos SH con respecto a los otros grupos (tabla 1). La actividad SOD en los pacientes con UPD fue significativamente menor que en los no diabéticos, pero no se diferenció de los diabéticos sin úlceras.
En correspondencia con hallazgos previos, 21,22 este estudio muestra que los pacientes ulcerados exhiben una exacerbación del estrés oxidativo con un deterioro concomitante de la reserva antioxidante, en comparación con el resto de los grupos estudiados. La interrogante acerca de si el estrés oxidativo es una causa de la ulceración o una consecuencia del proceso glucotóxico, permanece incógnita. 23 Independientemente de esta controversia, varios estudios indican que el estrés oxidativo está asociado a anomalías en la migración, secreción, proliferación y polarización de los fibroblastos y queratinocitos, 24,25 y que la manipulación farmacológica de este sector bioquímico mejora la cicatrización de las heridas. 26
Tabla 1 Caracterización molecular de los pacientes.
| Marcador | UPD | DM Comp | DM No comp | No DM |
|---|---|---|---|---|
| Capacidad oxidante (μM) | 1471 ± 277 a | 692 ± 349 b | 824 ± 374 b | 421 ± 263 b |
| PAOP (μM) | 40,5 ± 7,7 a | 16,7 ± 4,1 b | 16,9 ± 3,6 b | 18,6 ± 3,5 b |
| MDA (μM) | 6,44 ± 3,55 a | 5,05 ± 1,69 a,b | 3,87 ± 1,32 b,c | 2,69 ± 0,70 c |
| OPT (μM) | 26,61 ± 26,50 | 8,27 ± 6,40 | 8,46 ± 7,61 | 9,05 ± 7,67 |
| Capacidad antioxidante (μM) | 233 ± 40 b | 318 ± 41 a | 313 ± 40 a | 324 ± 36 a |
| Grupos SH (μg/mL) | 91,4 ± 25,4 b | 175,3 ± 37,8 a | 166,2 ± 58,9 a | 179,6 ± 32,2 a |
| SOD (% inhibición) | 43,2 ± 13,2 b | 54,5 ± 8,6 a,b | 56,5 ± 8,0 a,b | 61,5 ± 9,4 a |
| AGE (μg/mL) | 8,67 ± 4,02 | 18,08 ± 12,54 | 24,93 ± 19,12 | 10,95 ± 7,63 |
| RAGE (pg/mL) | 388 ± 168 | 575 ± 456 | 438 ± 185 | 553 ± 106 |
| PTD (ng/mL) | 2,873 ± 3,424 a | 0,372 ± 0,074 b | 0,559 ± 0,482 b | 0,465 ± 0,118 a,b |
| HbA1c (%) | 10,37 ± 0,98 a | 5,96 ± 1,04 b | 8,15 ± 0,92 a | 5,67 ± 0,59 b |
| MMP-9 (ng/mL) | 1531 ± 933 a | 563 ± 415 b | 589 ± 390 b | 554 ± 484 b |
| TIMP-1 (ng/mL) | 1163 ± 328 a | 642 ± 102 b | 609 ± 99 b | 531 ± 88 b |
UPD: úlcera de pie diabético; DM Comp: diabéticos no ulcerados compensados; DM No comp: diabéticos no ulcerados no compensados; No DM: no diabéticos; PAOP: productos avanzados de oxidación de proteínas; MDA: malonildialdehído; OPT: organoperóxidos totales; SH: sulfhidrilo; SOD: superóxido dismutasa; AGE: productos avanzados de glicación; PTD: pentosidina; HbA1c: hemoglobina glicada; RAGE: receptor de AGE; MMP-9: metaloproteasa de la matriz 9; TIMP-1: inhibidor tisular de MMP 1. Letras diferentes representan diferencias estadísticamente significativas.
Los AGE constituyen un grupo heterogéneo de moléculas que, al interactuar con el RAGE, conducen a la generación de ROS, la sobreexpresión de citoquinas pro-inflamatorias y moléculas de adhesión, todos ellos involucrados en la fisiopatología de las complicaciones de la diabetes. 27
No se detectaron diferencias estadísticas entre los grupos experimentales para AGE y RAGE. Sin embargo, los niveles de pentosidina fueron significativamente superiores para los pacientes con UPD en comparación con los diabéticos sin úlceras (tabla 1). La pentosidina es un producto de glicoxidación, o sea, glicación y oxidación, 28 lo que se corresponde con el predominio del estrés oxidativo y las bajas reservas antioxidantes observadas en el grupo con UPD. En estudios previos se describe que los pacientes diabéticos con complicaciones crónicas presentan mayores concentraciones de pentosidina que los diabéticos sin complicaciones. 29 Por tanto, el nivel de pentosidina se considera como un predictor confiable para las complicaciones de la DM. 30
La HbA1c es otro tipo de AGE. En este caso, los pacientes con UPD y diabéticos no compensados presentaron niveles significativamente superiores a los pacientes compensados e individuos sanos (tabla 1). Al respecto se plantea que un alto nivel de HbA1c refleja una mayor generación de AGE. 31
Las MMPs y los TIMPs son 2 grupos de moléculas agonistas involucradas en la fisiología de la cicatrización, y que requieren un fino equilibrio temporal y espacial. 32,33 Los niveles de MMP-9 fueron significativamente superiores en los pacientes ulcerados con respecto al resto de los grupos experimentales (tabla 1), lo que indica que la UPD influye sobre el aumento de los niveles sistémicos de MMP-9. Resulta interesante que los valores de TIMP-1 exhibieron un comportamiento similar. En pacientes con UPD, las concentraciones de TIMP-1 pudieron haberse incrementado como respuesta fisiológica compensatoria a los elevados niveles circulantes de MMP-9.
La no detección de diferencias significativas entre los grupos de diabéticos compensados y no compensados para la mayoría de los parámetros estudiados confirma la existencia de un nivel de daño que es independiente del control glucémico. Esto probablemente representa el llamado “círculo vicioso de la memoria metabólica”. 34)
Respuesta de los pacientes con UPD al tratamiento intralesional con EGF
El efecto de la administración intralesional de EGF en los pacientes con UPD se analizó después de 9-12 infiltraciones. Aunque el objetivo principal de este estudio no fue evaluar la eficacia clínica del EGF, es apropiado mencionar que el tratamiento desencadenó la acumulación de tejido de granulación, la contracción de los bordes de la herida y la re-epitelización en todos los pacientes.
En el primer estudio, el tratamiento con EGF estuvo asociado a reducciones significativas de los 4 parámetros de estrés oxidativo (figura 1A-D). En correspondencia, la capacidad antioxidante y los grupos SH exhibieron incrementos significativos después de la terapia (figura 1E, F). Para cada uno de estos marcadores, al menos el 50 % de los pacientes mostró una respuesta favorable al balance redox. Por tanto, en adición a los beneficios referidos a la estimulación de la granulación y el cierre de la herida, 35-37 el EGF contribuye a restaurar los niveles circulantes de varios marcadores del estado redox hasta valores cercanos a los de los diabéticos sin úlceras y los individuos no diabéticos.
A pesar del reducido número de pacientes estudiados, este trabajo tiene el mérito de mostrar por primera vez, que los efectos cicatrizantes de la terapia intralesional con EGF son, al menos parcialmente, mediados por un mecanismo compensatorio antioxidante. En consecuencia, consideramos que el EGF infiltrado es capaz de contrarrestar el desbalance redox, para atenuar la senescencia prematura, la apoptosis y el arresto proliferativo de los fibroblastos locales representativos de las UPD 38) y de otras heridas crónicas. 10,39
En el segundo estudio, se confirmó el resultado de capacidad oxidante, con una disminución significativa en T1. Además, el tratamiento redujo significativamente la relación nitrito/nitrato (figura 1G), principales productos de oxidación derivados del NO. 40) Varias evidencias indican que el estrés nitrosilativo está estrechamente relacionado con numerosas complicaciones de la diabetes, disfunción de órganos e incluso, con el desenlace de los pacientes. 41,42 La cicatrización de heridas cutáneas también está dramáticamente influenciada por el metabolismo del NO, 43 donde se requiere de un exquisito ajuste tanto a nivel de organismo como en el ambiente de la herida para una adecuada cicatrización. 44
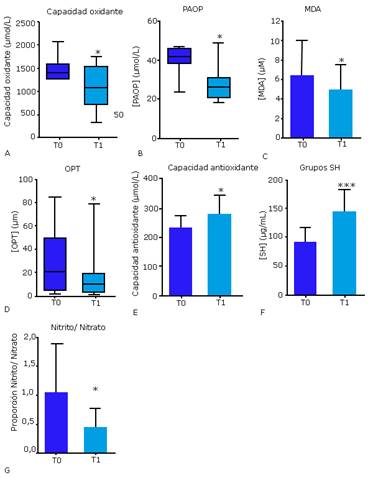
Fig. 1 Niveles circulantes de marcadores de estrés oxidativo y reserva antioxidante en pacientes con UPD antes (T0) y después (T1) del tratamiento intralesional con EGF. A, capacidad oxidante. B, productos avanzados de oxidación de proteínas (PAOP). C, malonildialdehído (MDA). D, organoperóxidos totales (OPT). E, capacidad antioxidante. F, grupos sulfhidrilo (SH). G, relación nitrito/nitrato. *p < 0,05; ***p < 0,001.
El EGF posee propiedades citoprotectoras mediadas por la estimulación agonística del eje fosfatidil-inositol 3-quinasa (PI3K)-Akt por la fosforilación del EGFR. 45 Variados modelos experimentales han documentado la habilidad del EGF para estimular la supervivencia de células, tejidos y animales después de recibir insultos letales, incluyendo oxidantes citotóxicos 46,47 y episodios de isquemia/ reperfusión. 48 Estos estudios sugieren que el reaprovisionamiento de los tejidos por el EGF está mediado por un efecto antioxidante. Además, esta es la primera demostración en un escenario clínico.
Con respecto a la vía de los AGE, en el primer estudio, los niveles circulantes de AGE no presentaron diferencias estadísticas entre T0 y T1 (figura 2A). No obstante, la media disminuyó en un 22 % después de la terapia, lo que pudiera ser biológicamente relevante. Los niveles de pentosidina disminuyeron significativamente después del tratamiento, con una reducción de la mediana del 42 % (figura. 2B). Este efecto pudo haber contribuido a atenuar los daños asociados a la vía de los AGE, que incluyen la inflamación de la herida, el arresto y la apoptosis de los fibroblastos. 49 Este resultado se confirmó en el segundo estudio.
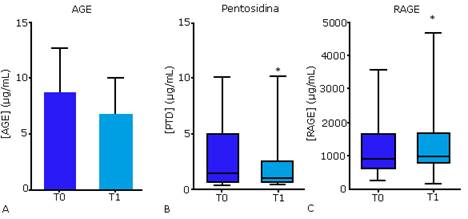
Fig. 2 Niveles circulantes de moléculas de la vía de los AGE en pacientes con UPD antes (T0) y después (T1) del tratamiento intralesional con EGF. A, productos avanzados de glicación (AGE). B, pentosidina. C, receptor de AGE (RAGE). *p < 0,05.
Las concentraciones de RAGE no se modificaron significativamente (dato no mostrado). Sin embargo, en el segundo estudio, RAGE exhibió un aumento significativo, con un incremento de la mediana del 16 % (figura 2C). RAGE soluble actúa como un receptor “señuelo” que inhibe la señalización a través del eje AGE/RAGE, de modo que se previene la amplificación de episodios citotóxicos.
Los niveles de MMP-9 no variaron significativamente entre T0 y T1 (figura 3A). Sin embargo, la concentración media en T1 fue un 37 % más baja que en T0. Los valores de TIMP-1 por su parte, disminuyeron significativamente después de la terapia (figura 3B), con una reducción de la media del 31 %. Los resultados sugieren la recuperación del equilibrio entre las moléculas degradativas y sus inhibidores, que podría conllevar a la restauración del balance entre las fuerzas pro-degradativas y pro-sintéticas de la MEC.
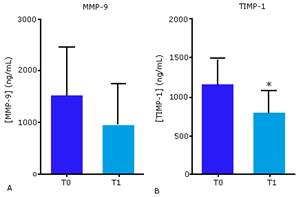
Fig. 3 Niveles circulantes de proteínas relacionadas con la estabilidad de la MEC en pacientes con UPD antes (T0) y después (T1) del tratamiento intralesional con EGF. A, metaloproteasa de la matriz 9 (MMP-9). B, inhibidor tisular de MMP tipo 1 (TIMP-1). *p < 0,05.
En el segundo estudio, se evaluaron los niveles circulantes de un grupo de marcadores que incluyen reactantes de fase aguda y citoquinas pro-inflamatorias. El tratamiento con EGF se asoció a una reducción altamente significativa de la eritrosedimentación (figura 4A), verificada en todos los pacientes. La CRP no evidenció diferencias estadísticas entre T0 y T1 (figura 4B). Sin embargo, la mediana en T1 fue un 45 % más baja que en T0. La interpretación de estos hallazgos clínicos incita a especular que la exposición sistémica al EGF contribuye a atenuar el fenotipo hepato-reactivo. 50 El efecto modulador del EGF sobre las proteínas de fase aguda derivadas del hígado está documentado en estudios previos. 51 Otros estudios in vitro ilustran el efecto del EGF sobre la modulación de las proteínas de fase aguda en células hepáticas. 52,53
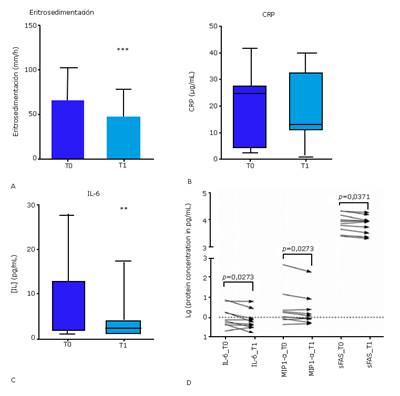
Fig. 4 Niveles circulantes de reactantes de fase aguda y marcadores pro-inflamatorios en pacientes con UPD antes (T0) y después (T1) del tratamiento intralesional con EGF. A, eritrosedimentación. B, proteína C reactiva (CRP). C, interleuquina-6 (IL-6). D, citoquinas pro-inflamatorias que mostraron variaciones significativas según la evaluación basada en Milliplex: IL-6, proteína inflamatoria de macrófagos 1-alfa (MIP1-a) y FAS soluble (sFAS). **p < 0,01; ***p < 0,001.
Los niveles de IL-1β e ICAM-1 no se modificaron significativamente después del tratamiento (datos no mostrados). En contraste, los niveles de IL-6 disminuyeron significativamente en T1, con una reducción de la mediana del 66 % (figura 4C). Adicionalmente, se realizó una evaluación más amplia de marcadores pro-inflamatorios mediante un ensayo con perlas magnéticas, donde se validó la reducción de los niveles circulantes de IL-6, acompañada por la disminución significativa de la proteína inflamatoria de macrófagos 1-alfa (MIP1-a) y FAS soluble (sFAS) (figura 4D).
La IL-6 juega un papel patogénico en la aparición, progresión y complicaciones de la DM tipo II 54 sFAS se ha relacionado con la resistencia a la insulina, la aparición de la DM tipo II, así como la subsiguiente inflamación endovascular, la apoptosis asociada a la diabetes, y las complicaciones multiorgánicas. 55 MIP1-a es una de las citoquinas inflamatorias inducidas por altos niveles de glucosa, 56 y está patogénicamente involucrada en la prediabetes y en la inflamación diabética crónica. 57 En conjunto, nuestros hallazgos sugieren que el descenso en los niveles circulantes de estos 3 marcadores pudiera contribuir a restaurar la homeostasia metabólica y los programas pro-anabólicos de los tejidos en el curso del proceso de cicatrización en pacientes diabéticos. 58
La interpretación de estos hallazgos sugiere que detrás de la cicatrización exitosa que se logra mediante la infiltración intralesional de EGF, existe un amplio perfil de efectos farmacodinámicos, determinados por la restauración sistémica de múltiples eventos moleculares que convergen para restablecer una trayectoria fisiológica de cicatrización. El EGF localmente infiltrado, además de contribuir a la recuperación de mediadores solubles descompensados, está dotado con la capacidad de contrarrestar la senescencia prematura asociada a la diabetes. 59
Conclusiones
Esta investigación aporta las primeras evidencias que confirman el concepto de que la UPD funciona como una entidad superimpuesta a un hospedero metabólicamente descompensado, sobre el que libera reactantes pro-inflamatorios, pro-oxidantes, glicoxidativos y pro-apoptóticos, que amplifican la descompensación metabólica y crean un circuito de influencia mutua que entorpece la cicatrización. Asimismo, se documentan por primera vez en un escenario clínico, los efectos sistémicos del tratamiento intralesional con EGF: antioxidante, anti-AGE, anti-degradativo, anti-inflamatorio y anti-apoptótico, con traducción en la corrección del medio interno del organismo diabético.
En conjunto, los resultados indican que esta terapia contribuye a restaurar la homeostasia sistémica del paciente diabético, de modo que el EGF humano recombinante (Heberprot-P) podría ampliar su espectro farmacológico hacia la prevención y control de otras complicaciones de las diabetes consecuentes de los fenómenos pro-inflamatorios y glicoxidativos.














