INTRODUCCIÓN
El cáncer constituye un problema de salud en la actualidad. Según la plataforma para estadísticas mundiales sobre cáncer Global Cancer Observatory, 1 en el año 2020 el cáncer de pulmón (CP) fue la primera causa de muerte por tumores malignos a nivel global (18 %) y la segunda en incidencia (11,4 %), solo superada por el de mama. En Cuba los carcinomas de tráquea, bronquios y pulmón están dentro de los tumores malignos más frecuentes, presentando la mayor tasa de mortalidad en ambos sexos al cierre del año 2019. 2 El diagnóstico temprano del CP, crítico en su manejo, es uno de los aspectos más importantes no resueltos, 3 que junto a la personalización de las terapias determina una mejor respuesta y supervivencia. Los biomarcadores aprobados actualmente carecen de la sensibilidad, especificidad y reproducibilidad requeridas para el diagnóstico, incluso en estadios avanzados. 4 Consecuentemente, y debido a la ausencia de síntomas obvios, la mayoría de los pacientes con cáncer de pulmón de células no pequeñas (CPCNP), subtipo histológico mayoritario, 5 se presentan en estadio localmente avanzado o metastásico. Este diagnóstico tardío hace inviable la cirugía estrechamente ligada al concepto de cura 6 y determina una tasa de supervivencia global (SG) a los 5 años de 4 % a 12 %, que podría elevarse a 50 % hasta 80 % si el diagnóstico ocurriera en estadio I. 4,7 En los últimos años la realización de tomografía computarizada de bajas dosis (TCBD), en poblaciones de alto riesgo, ha reducido sustancialmente la probabilidad de morir por CP y constituye el estándar actual para la pesquisa de la enfermedad; 4,6,8,9 aunque la prueba es costosa, los casos falsos positivos deben confirmarse por exámenes ocasionalmente más invasivos y la exposición repetida a radiaciones ionizantes puede causar cáncer en los sujetos pesquisados. 10
Las terapias dirigidas e inmunoterapias, cuya eficacia depende de la aplicación de biomarcadores predictores, también han incrementado la SG en pacientes con CPCNP. La vacuna cubana CIMAvax-EGF®, dirigida al factor de crecimiento epidérmico (EGF), se indica de manera personalizada desde el año 2018, 6 teniendo en cuenta la concentración de EGF sérico pretratamiento. 11,12 Sin embargo, el biomarcador presenta algunas limitaciones para predecir o explicar la respuesta en los pacientes. 11,13 Es conocido que la capacidad de un biomarcador para discriminar pacientes de controles sanos (valor diagnóstico) incide directamente en su desempeño. 14 En CPCNP, en particular, la capacidad discriminatoria del EGF sérico, que sustentaría su eficacia en el pronóstico, la predicción o evaluación de respuesta a la vacuna, o el diagnóstico en sí mismo, se ha estudiado escasamente y los resultados no son concluyentes. 15,16 Igualmente existen informes contradictorios en otros tipos de cáncer, 17-20 y patologías que presuntamente involucran al EGF. 21-24 Estas incongruencias se deben principalmente a la variabilidad en las estimaciones del biomarcador, producto de la liberación de EGF por las plaquetas durante la separación de los sueros; y a la falta de armonización e incluso estandarización del procedimiento. En ese sentido, es relevante que las plaquetas constituyen el reservorio y fuente principal de EGF sérico. 25 Consecuentemente, existe una correlación entre los niveles de EGF sérico y el conteo plaquetario, 26,27 que es dependiente del tiempo de colección del suero, 25,28 y de otros parámetros como el tipo de tubo para la colección de la sangre y la temperatura de incubación, 29 los cuales tienen influencia directa en su coagulación y por tanto en la cinética de liberación del EGF por las plaquetas. Adicionalmente, el polimorfismo de un solo nucleótido (SNP, del inglés single nucleotide polymorphism) + 61 G > A, 30 constituye otra fuente de variabilidad natural entre sujetos, 31 que socava la clasificación de los niveles de EGF sérico individuales en “bajos o altos”. 27 Este polimorfismo se ha asociado con el riesgo de cáncer, 30,32 su gravedad, 33 pronóstico 34 y respuesta al tratamiento. 35 Sin embargo, hasta donde conocemos, no existen estudios de su impacto en la capacidad diagnóstica del EGF sérico en CPCNP. Por otra parte, las limitaciones del actual biomarcador de CIMAvax-EGF® podrían estar asociadas al establecimiento retrospectivo de su valor de corte, 11,12 en muestras de suero cuya obtención no fue estandarizada y validada como óptima; 13 aspecto crítico en la medicina de precisión. 36 Asimismo, se ha reconocido que la selección del biomarcador mediante análisis de supervivencia post-hoc y dicotomización, adiciona un sesgo en su evaluación 37 con impacto en la eficacia. 38
Considerando los antecedentes presentados, la certera valoración del valor diagnóstico del EGF sérico depende del control de los factores que provocan variabilidad y sesgo en su estimación. Esto solo es posible en el contexto de una cuantificación estandarizada. Con ese objetivo se realizó la investigación que se presenta, como resultado de la cual se desarrolló una metodología de cuantificación de EGF sérico humano. Considerando el alto precio de los estuches comerciales, la misma concibió el desarrollo, validación y registro del ensayo UMELISA EGF®. 39 La propuesta incluyó además la estandarización del proceso de separación de los sueros y la normalización e interpretación de las concentraciones de EGF con referencia al conteo plaquetario. Su aplicación permitió identificar varias variables relacionadas con el EGF con valor diagnóstico y potencialidad como biomarcador en CPCNP. 27,40
MÉTODOS
La figura 1 resume el diseño y metodología de la investigación, que fue realizada en 3 etapas: desarrollo y validación del estuche UMELISA EGF®, estudio de los niveles de EGF en sueros de individuos sanos y evaluación del EGF sérico en pacientes con CPCNP. 39,27,40
Muestra. Aspectos éticos
Entre octubre de 2014 y mayo de 2016, 25 pacientes con CPCNP, confirmados por técnicas cito-histológicas, fueron incluidos prospectivamente en el estudio. El rango de edad comprendido fue de 52 años a 76 años, con una mediana de 62,5 años y prevalencia del sexo masculino con relación 5 a 1 respecto a las mujeres. Se estudiaron además 105 individuos sanos cubanos, de 18 años a 78 años, con balance por sexo (52 mujeres y 53 hombres) y edad (mediana de 51 años para ambos sexos). Los grupos control para las comparaciones con los pacientes se conformaron a partir de la población sana estudiada. Los reclutamientos se realizaron según criterios definidos en el protocolo clínico y aprobados por los comités de ética de los centros involucrados. La voluntariedad de participación fue expresada por los sujetos mediante la firma del acta de consentimiento informado.
Flebotomía
En los sujetos sanos se realizó una única extracción de sangre tras la inclusión. En los pacientes se realizaron 2: en el momento del diagnóstico (tiempo cero-To) a los 25 pacientes incluidos en el estudio (NSCLC1), y de 4 semanas a 6 semanas después de haber concluido la quimio-radioterapia en primera línea (tiempo 1- T1) a 18 de éstos que manifestaron su conformidad (NSCLC2).
Colecta de los sueros, cuantificación y variables de estudio
La estandarización de los procedimientos para la obtención de las muestras y su cuantificación, identificó 1 h y 4 h como tiempos relevantes para la colección de los sueros. En todos los individuos estudiados cada extracción generó 2 concentraciones ([EGF]1h y [EGF]4h), cuantificadas con el estuche UMELISA EGF® desarrollado. Las muestras constituyen buenos estimadores del EGF circulante y de su provisión total en las plaquetas, respectivamente; y junto a los conteos plaquetarios se consideraron variables primarias, cuya combinación generó otras variables de estudio ([EGF]1h/[EGF]4h, d = [EGF]4h-[EGF]1h, [EGF]1h/plaquetas/L, [EGF]1h/plaquetas/L, d/plaquetas/L).
RESULTADOS Y DISCUSIÓN
Estuche UMELISA EGF®
La figura 2 muestra en síntesis el estuche de cuantificación UMELISA EGF® desarrollado, 39 basado en un ELISA tipo sándwich que emplea anticuerpos monoclonales en la fase sólida y en la detección (de captura y reportero biotinilado, respectivamente). El revelado ocurre por transformación del sustrato 4-metilumbeliferil fosfato en el producto fluorescente 4-metilumbeliferona, bajo la acción del conjugado estreptavidina-fosfatasa alcalina. La 4-metilumbeliferona tiene un máximo de excitación a una longitud de onda (λ) de 365 nm. La señal fluorescente emitida se lee a una λ en el rango de 420 nm -500 nm, con un máximo a 450 nm.
Este juego de reactivos está soportado sobre la plataforma cubana Sistema ultra micro analítico (SUMA) que incluye un lavador de placas MW-2001 y el fotómetro-fluorímetro PR-621 para la lectura de las placas o tiras de reacción. El lector se acopla a un ordenador dotado del paquete strips reader software (SRS), que realiza la cuantificación, validación de la prueba UMELISA e interpretación de sus resultados.
El estuche se validó por el productor Centro de Inmunoensayo, (CIE). La evaluación externa del desempeño para el registro en la agencia reguladora cubana, Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), la realizó el Centro de Inmunología Molecular (CIM).
En ambos casos se verificó la concordancia de las cuantificaciones UMELISA con las del estuche comercial Quantikine® Human EGF Immunoassay kit (R&D, EE.UU.), que acompañó todo el proceso de desarrollo de la vacuna CIMAvax-EGF® y su inserción en la práctica clínica. Aunque no fue objetivo emular el kit comercial, la tabla 1 muestra un resumen de las características de ambos ensayos, que resalta en negritas las fortalezas respectivas.
Tabla 1 Comparación entre los estuches UMELISA EGF® y Quantikine® Human EGF
|
(TecnoSUMA, Cuba) |
Quantikine (R&D, EE. UU.) |
|
| IVD | FRUO. No para diagnóstico | |
| Sí | No | |
| 2 meses, 2°C-8 °C | 1 mes, 2 °C -8 °C | |
| ~ 15 CUP | ~ 750 CUP | |
| Suero | Suero/Plasma/Orina | |
| Semiautomático | Semiautomático | |
| [EGF] en pg/mL/ |
Señales de absorbancia/Manual | |
|
17 h-19 h Incubaciones (16 h-18h muestras, 30 min conjugado, 30 min sustrato) |
5 h Incubaciones (2h muestras, 2 h conjugado, 20 min sustrato) |
|
| Sí | No | |
| Fluorescencia/450 nm | Densidad óptica/450 nm, con corrección a 540 nm /570 nm | |
|
12,5 pg/mL-250 pg/mL/movibles EI EGF (NIBSC) |
3,9 pg/mL-250 pg/mL/ fijos EGF humano recombinante calibrado |
|
| Ac de captura monoclonal/Ac reportero monoclonal-biotinilado | Ac captura monoclonal/Ac reportero policlonal POX | |
| Sí | Sí | |
| Sí | No | |
| Cómodo | Trabajoso | |
| 10 | 1 | |
| 39 | 3,9 | |
| 80-120 | 80-120 | |
| < 10 | < 10 |
IVD: del inglés in vitro diagnostic; FRUO, del inglés for research use only; NIBSC, del inglés National Institute for Biological Standards and Control; EI: estándar internacional; EGF, del inglés Epidermal Growth Factor; Ac, anticuerpo. Fuente: Elaboración propia
Propuesta de nuevos biomarcadores
El mejor manejo y tratamiento de los pacientes con CPCNP depende de la evaluación de biomarcadores, cuya identificación exitosa no requiere de tamaños de muestra excesivos. 41 Este estudio clasifica como exploratorio, 14,42 en los cuales el tamaño de la muestra oscila entre 25 y 200 41,43 y con no poca frecuencia alrededor de 25. 44-49 En la investigación que se presenta, la pequeña talla de la muestra no comprometió su representatividad en cuanto a variabilidad biológica. 50 La misma reproduce, en sus aspectos demográficos y clínico-patológicos más importantes, la evaluada previamente por Rodríguez y colaboradores, 11 con alrededor de 400 pacientes provenientes de 19 sitios clínicos y diferentes provincias del país.
El análisis de la capacidad discriminatoria de las variables de estudio reveló que controles y pacientes no tratados (To) tienen como promedio igual reserva total de EGF, medido en muestras colectadas a las 4 h ([EGF]4h). Esto lo que sugiere la irrelevancia de la variable en la fisiopatología tumoral. Asimismo, evidenció una mayor accesibilidad del EGF a la circulación en los pacientes como promedio, quienes muestran una media superior de EGF circulante ([EGF]1h), una mayor fracción de EGF en circulación con respecto al total (r = [EGF]1h/[EGF]4h) y menos EGF retenido en las plaquetas (d = [EGF]4h-[EGF]1h). Este incremento del EGF libre en el torrente sanguíneo implica una mayor accesibilidad a este factor de crecimiento por parte del tumor, que podría ser relevante para la biología del CPCNP. En correspondencia, la normalización por conteo plaquetario evidenció más EGF contribuido a la circulación como promedio por plaqueta ([EGF]1h/plaquetas/L) y consecuentemente menos EGF retenido como promedio también por plaqueta (d/plaquetas/L). Estos valores normalizados discriminan los pacientes incluso después de quimio-radioterapia, aunque ésta provoca una disminución en los niveles de EGF. Esto indica el mayor vínculo de las variables normalizadas con la biología del tumor, en comparación con el EGF circulante ([EGF]1h) o su stock total ([EGF]4h), y sugiere su mayor eficacia en la estratificación de los pacientes para la predicción de respuesta a terapias anti EGF/EGFR, así como su empleo potencial en la pesquisa de la enfermedad. En contraste, la reserva total promedio de EGF (figura 3A), aún normalizada por conteo plaquetario (figura 3B), no discrimina entre pacientes y controles, lo que indica nuevamente su irrelevancia en la fisiología tumoral.
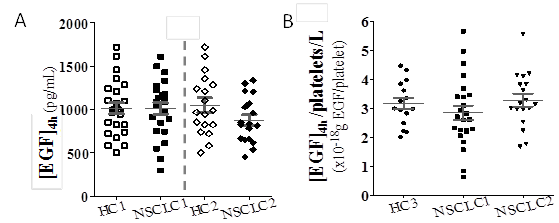 Fuente: Elaboración propia
Fuente: Elaboración propiaFig. 3 Concentraciones séricas de EGF medidas a las 4 h: pacientes vs. controles sanos. A) Valores absolutos en pacientes al diagnóstico (NSCLC1) y después de quimio-radioterapia (NSCLC2), comparados con controles sanos emparejados por sexo y edad (HC1 y HC2, respectivamente). B) Análisis similar, basado en iguales concentraciones normalizadas por recuento de plaquetas en los pacientes (NSCLC1 y NSCLC2), en comparación con controles sanos (HC3).
El mejor desempeño de las variables normalizadas en la discriminación, está muy probablemente relacionado con el control que logran sobre las diferencias naturales interindividuales de los niveles de EGF sérico. 30,31 La normalización del EGF circulante considera la variabilidad debida a variaciones en el recuento plaquetario, mientras que la normalización del EGF retenido en plaquetas considera también las diferencias de expresión de EGF causadas por el SNP + 61G > A.
Impacto científico
El desarrollo del estuche UMELISA EGF® permitió generar nuevo conocimiento científico. El estudio de los niveles de EGF desde una perspectiva integral, que considera la contribución de la variabilidad interindividual por niveles de expresión de EGF y conteos plaquetarios, es novedoso. La aplicación de la metodología estandarizada en el estudio de pacientes con CPCNP e individuos sanos, permitió esclarecer el valor diagnóstico del EGF, controversial hasta ese momento y explicar algunas limitaciones del biomarcador actual de eficacia de CIMAvax-EGF®. Adicionalmente, el estudio reveló que las variables normalizadas por conteo plaquetario constituyen potenciales biomarcadores para la estratificación de los pacientes y la predicción de su respuesta a la vacuna CIMAvax-EGF® u otras terapias anti-EGF/EGFR.
El alcance del resultado podría extenderse a otras patologías en las cuales el protagonismo del EGF ha sido reportado (aterosclerosis, diabetes mellitus, Alzheimer, depresión, autismo, esquizofrenia, entre otros), 51-59 contribuyendo a una mejor lectura de sus niveles en suero y al aclaramiento de la relación de la molécula con la enfermedad. Adicionalmente, podría ser útil en el estudio de otras citosinas y factores de crecimiento también almacenados en las plaquetas: factor de crecimiento derivado de plaquetas (PDGF), factor de crecimiento transformante-β (TGFβ) y factor de crecimiento del endotelio vascular (VEGF), por citar algunos ejemplos; para los cuales la cinética de liberación podría ser muy similar a la descrita para el EGF, con un impacto análogo en las mediciones y la clínica.
Impacto social
El acompañamiento de CIMAvax-EGF® con el estuche UMELISA EGF® posibilita un manejo de precisión del paciente y el uso racional de la vacuna, facilitando su aplicación masiva en el país, con el impacto correspondiente en la clínica y evolución de los pacientes.
El empleo de la metodología desarrollada en el estudio de otros tumores epiteliales malignos, y en particular la interpretación de sus perfiles de EGF sérico a partir de las variables alternativas propuestas, permitirá la determinación de dependencia del EGF en los mismos para la proliferación y la inferencia de un supuesto beneficio de la utilización de la vacuna CIMAvax-EGF® u otras terapias dirigidas al sistema EGF/EGFR. Esto propiciará la ejecución de ensayos clínicos controlados con estas terapias y la extensión de su aplicación en las nuevas localizaciones seleccionadas, así como la disponibilidad de nuevas alternativas de tratamiento para los pacientes no respondedores a terapias previas.
Adicionalmente, los nuevos biomarcadores podrían complementar el conocimiento de la patofisiología de otras enfermedades que involucran al EGF (aterosclerosis, diabetes, Alzheimer, autismo, entre otras), con beneficio en el manejo de los pacientes.
Impacto económico
El estuche UMELISA EGF®, basado en la tecnología SUMA de bajo costo y amplia cobertura, permite el ahorro de divisas por concepto de importaciones y garantiza soberanía tecnológica. El empleado anteriormente, de procedencia norteamericana, tiene un elevado precio en el mercado, con un costo por determinación 50 veces superior (15 USD). Según cifras del registro de medicamentos de alto costo del INOR, considerando el número de pacientes tratados con CIMAvax-EGF® en el año 2019, el empleo del UMELISA EGF® solo en la determinación inicial para la indicación del tratamiento prevé un ahorro anual de 2148 USD. Llevado a nivel de país la cifra se aproximaría al medio millón de dólares anuales.
Por otra parte, la aplicación racional de la vacuna en los pacientes cubanos significa un importante ahorro económico para el país, e incluso podría representar ingresos adicionales a partir de la exportación de dosis excedentes de vacuna. El estuche posibilita además la salida al mercado de CIMAvax-EGF® con su diagnosticador acompañante, como paquete y producto más completo y competitivo, con la consecuente repercusión en las exportaciones e ingresos. Adicionalmente, podría representar un importante renglón exportable a países como Colombia, donde se comercializa la tecnología SUMA y está siendo utilizado para la estratificación de los pacientes con cáncer de pulmón.
Conclusiones
La novedad científica del trabajo radica en la demostración de que las plaquetas liberan el EGF más rápidamente en los pacientes con CPCNP que en los individuos sanos. Tanto pacientes como controles sanos tienen en promedio el mismo stock total de EGF en plaquetas, pero los pacientes tienen más EGF en circulación como promedio. Además, mientras que la literatura suele reportar concentraciones absolutas de EGF sérico, el estudio propone su corrección por el EGF total expresado y por el recuento de plaquetas. El ajuste se logra mediante variables como r ([EGF]1h/[EGF]4h, la fracción que representa el EGF circulante de su stock total) y d ([EGF]4h-[EGF]1h, la cantidad estimada de EGF retenido en las plaquetas), así como a través del EGF circulante y el retenido en plaquetas, normalizados ambos por conteo plaquetario ([EGF]1h/plaquetas/L y ([EGF]4h-[EGF]1h)/plaquetas/L, respectivamente).
La mayor capacidad discriminatoria de las nuevas medidas sugiere que son variables más relacionadas con la biología tumoral y, por tanto, podrían ser más útiles como biomarcadores. La identificación de posibles predictores séricos de respuesta a CIMAvax-EGF® es clínicamente relevante. La mayoría de los biomarcadores de eficacia introducidos en la práctica clínica constituyen alteraciones genéticas que requieren material de biopsia y técnicas costosas para su evaluación. La prueba de biomarcadores UMELISA EGF®, en cambio, es simple, mínimamente invasiva y económica. Estos biomarcadores alternativos podrían ayudar a identificar otros tumores dependientes de EGF, en los que las terapias dirigidas a EGF/EGFR podrían ser apropiadas.
En nuestra opinión, los biomarcadores propuestos, validados clínicamente, podrían apoyar la indicación personalizada de CIMAvax-EGF® en primera línea de tratamiento, en función de su positividad como ocurre con otras terapias dirigidas. La inmunización con esta inmunoterapia contrasta con la quimioterapia y radioterapia, que son inespecíficas y agresivas y pueden comprometer el estado inmunológico de los pacientes. Este escenario de aplicación de CIMAvax-EGF® podría potenciar su efecto, que depende de una respuesta inmunitaria anti-EGF eficaz.
No obstante, el mayor impacto de los nuevos biomarcadores y de la prueba UMELISA EGF® podría estar asociado a una detección más temprana del proceso maligno, mediante el cribado a gran escala en poblaciones de riesgo; como complemento a la TCBD, la radiología tradicional y otros métodos en uso para el diagnóstico de la enfermedad y de su progresión.