INTRODUCCIÓN
El cáncer constituye la segunda causa principal de muerte en el mundo con 18,1 millones de casos y 9,6 millones de muertes en el 2018 (WHO Cancer Report 2020).1 En Cuba, los tumores malignos constituyen la segunda causa de muerte (Anuario Estadístico 2020)2 encontrándose los tumores de pulmón, próstata y melanoma dentro de los de mayor incidencia y mortalidad. Dentro de los blancos para el diseño de nuevos agentes anticancerígenos se encuentran las aminopeptidasas cuyo patrón de expresión puede cambiar en tumores malignos, indicando su participación en el desarrollo y crecimiento tumoral. Su papel en la progresión e invasión del cáncer se evidencia por la capacidad de influir en la proliferación, angiogénesis, migración de células tumorales y comportamiento metastásico.3,4,5,6 Las aminopeptidasas pertenecen a diferentes familias, siendo la familia M1 de las metalopeptidasas y la familia S9 de las peptidasas serino, de las que más atraen la atención de la comunidad científica internacional por sus implicaciones en diferentes patologías humanas.7 En particular, dentro de la familia M1, la aminopeptidasa neutra (APN, EC 3.4.11.2) desempeña funciones muy importantes en diferentes procesos fisiológicos del metabolismo de péptidos relacionados con la analgesia, la digestión, y el control de la presión arterial; así mismo actúa como receptor para la entrada de varios coronavirus y se encuentra implicada en la patogénesis de varios desórdenes en humanos como el cáncer, entre otros.5 La aminopeptidasa ácida (APA, EC 3.4.11.7) también de la familia M1, desempeña funciones muy importantes en diferentes procesos fisiológicos que incluyen el control de la presión arterial y el cáncer.8 Dentro de la familia S9 de las peptidasas serino, la enzima dipeptidil peptidasa IV (DPP-IV, EC 3.4.14.5), es una aminopeptidasa que desempeña funciones importantes en múltiples procesos fisiológicos relacionados con el metabolismo de la glucosa, siendo uno de los blancos para el tratamiento de la diabetes mellitus tipo 2. Esta enzima se encuentra también sobreexpresada en procesos que incluyen diferentes tipos de cáncer.6 El desarrollo de nuevos inhibidores de APN, APA y DPP-IV y su uso en diferentes modelos de enfermedad podría alterar vías intracelulares y provocar efectos antitumorales importantes. Teniendo en cuenta la relevancia biomédica de la inhibición de APN, APA y DPP-IV, el presente trabajo tiene como objetivo identificar nuevos inhibidores de estas enzimas con potenciales aplicaciones biomédicas principalmente en cáncer. Para ello se abordaron 2 enfoques de trabajo fundamentales: a) Identificación y caracterización bioquímica de nuevos inhibidores de APN, APA y DPP-IV de baja masa molecular para lo cual se realizaron cribados virtuales en la base de compuestos de baja masa molecular HitFinder, Maybrigde (ThermoFisher) b) Caracterización bioquímica de la inhibición de APN, APA y DPP-IV por bestatina y bacitracina como nuevos inhibidores naturales de estas enzimas.
MÉTODOS
Los inhibidores BTB11079, JFD00064, BTB07018 y HTS08762 fueron comprados en la firma Thermofisher, Maybridge, UK. Bestatina, bacitracina y los sustratos específicos L-Leu-pNA, L-Glu-pNA y L-Gly-Pro-pNA fueron adquiridos en Sigma. Las líneas tumorales empleadas provienen de la Colección Americana de Tipos Celulares (ATCC). Los cribados virtuales, así como los estudios in silico de relación estructura-función se desarrollaron como se describen en Pascual et al.,9) Rivera et al.10) y en Valdés Tresanco et al.11 La validación cinética de las enzimas empleadas en el presente trabajo se realizó según se describe en Pascual et al.9) Rivera et al.10 y Arrebola et al.12 La validación cinética de los nuevos inhibidores se realizó según se describe en los mencionados trabajos.9,10,11,12 Los estudios de biodistribución en modelo de rata, así como los efectos de los nuevos inhibidores sobre líneas tumorales APN+/DPP-IV+ se desarrollaron según se describe en Pascual et al.,9 Rivera et al.10) y Pascual et al.13
RESULTADOS Y DISCUSIÓN
Identificación de nuevos inhibidores de APN, APA y DPP-IV mediante cribado virtual en la base de compuestos Hitfinder, Maybridge, Thermofisher. Validación cinética de los nuevos inhibidores identificados
Como resultado del cribado virtual, se identificaron más de 20 ligandos como potenciales inhibidores de APN, APA y DPP-IV en la base de datos Hitfinder, Maybridge, Thermofisher. En base a las energías libres de unión de los complejos enzima: inhibidor, seleccionamos los 4 compuestos mejor clasificados para estudios cinéticos con las aminopeptidasas porcinas. Estos ligandos etiquetados como: BTB11079, JFD00064, BTB07018 y HTS08762 son compuestos hidrófobos de bajo peso molecular (menos de 625 g/mol). Para la caracterización bioquímica de la inhibición de APN, APA y DPP-IV se emplearon preparaciones de la enzima obtenidas según se describe en Pascual et al,9) Arrebola et al.12) y en Pascual et al.14 Estas moléculas inhibieron APN y APA en el orden micromolar (inhibidores clásicos) con mecanismos de inhibición no competitiva ( ( 1 en el caso de APN y competitiva en el caso de APA (tabla 1). Frente a DPP-IV se comportaron como inhibidores de unión fuerte de tipo competitivo. Los resultados de la caracterización cinética de la inhibición de las 3 aminopeptidasas porcinas se resumen en la tabla 1 y se muestran en la figura 1A, C y D los resultados frente a APNp y DPP-IVp del inhibidor BTB07018. La identificación de una inhibición de tipo no competitiva para estas moléculas frente a APN es de gran relevancia para futuros estudios en modelos biomédicos, ya que la inhibición no competitiva no puede ser revertida en condiciones fisiológicas, al aumentar localmente las concentraciones de los sustratos naturales de esta enzima, y permite obtener efectos de inhibición más sostenidos en el tiempo.15 Estas moléculas constituyen los primeros inhibidores de tipo no competitivos descritos para APN hasta el presente y los primeros inhibidores efectivos frente a APN/APA/DPP-IV descritos, por lo que son muy atractivos para abordar estudios biomédicos en modelos de enfermedades que involucran a estas enzimas como diferentes tipos de cáncer, así como diferentes patologías de la piel donde se ha demostrado una sobreexpresión de las enzimas APN y DPP-IV.9
Estudios de relación estructura: función in silico
La quelación de iones de zinc a través de un ZBG (grupo de unión a zinc de sus siglas en inglés zinc binding group) es el modo de acción más común para los inhibidores dirigidos a las metalo aminopeptidasas.5,8,16 En este estudio, identificamos inhibidores de APN cuyas estructuras químicas no contenían el ZBG clásico, lo cual constituye una de las principales novedades científicas del presente trabajo. Para dilucidar cómo estas moléculas inhiben APN, analizamos el modo de unión de los inhibidores a la enzima humana APNh obtenido mediante simulaciones de acoplamiento molecular. Observamos una notable prevalencia de interacciones hidrofóbicas con residuos alifáticos de la enzima (Ala-351 y Ala-353), aromáticos (Phe-472, Tyr-891 y Phe-896) y polares (Gln-211 y Gln-213) (figura 1). Los compuestos no coordinaron el ion zinc en el sitio activo, y establecieron pocas interacciones hidrofóbicas con los residuos de coordinación del metal His-388, His-392 y Glu-411 (figura 1B, ejemplo APNh:BTB07018). Se predijo que todos los inhibidores se unen a Tyr-477, un residuo involucrado en la estabilización de la forma de oxianión del estado de transición, a través de interacciones hidrofóbicas, y que los compuestos BTB11079 y BTB07018 establecen interacciones hidrofóbicas con Glu-389, un residuo clave para polarizar la molécula de agua que ataca el enlace peptídico a escindir (figura 1B ejemplo APNh:BTB07018). Todos estos hallazgos soportan el efecto de disminución de la Vmax que ejercen los inhibidores no competitivos. Sorprendentemente, se predijo que ninguno de los compuestos interactuó con todos los residuos que pertenecen al sitio de unión al sustrato, dejando espacios desocupados que permiten la unión simultánea del inhibidor y el sustrato a la enzima (figura 1B). El análisis de la estructura 3D de los complejos enzima-inhibidor-sustrato reveló que las interacciones inhibidor-enzima abarcan residuos comprendidos entre los subsitios S1 y S5', mientras que el sustrato interactúa solo con el subsitio S1 (figura 1B). Las diferencias entre el modo de unión a la enzima de los nuevos inhibidores y del sustrato explicaron el perfil de inhibición no competitivo. La ausencia de ZBG puede disminuir las interacciones inhibitorias con otras metaloenzimas y mejorar la farmacocinética y la biodisponibilidad oral de los inhibidores de APN.
En el caso de DPP-IV, el análisis de los modos de unión de los 4 inhibidores con el centro activo de la enzima, evidencia el solapamiento en los sitios de fijación de los inhibidores y el sustrato, en perfecto acuerdo con la inhibición competitiva identificada por herramientas cinéticas. Todos los inhibidores interactúan con los residuos de Glu-205 y Glu-206 involucrados en la fijación y orientación del sustrato la cual se concreta a partir de la formación de puentes salinos con el extremo amino del mismo (figura 1E).17,18 También con función de fijación y orientación del sustrato, en los modos de unión de todos los complejos en estudio están presentes los residuos Arg-125, Ser-209, Tyr-631, Tyr-662 y Tyr-666 que, junto a Val-711, Val-656 y Trp-659 forman el bolsillo hidrofóbico S1 y determinan la especificidad de sustrato pues, debido a la presencia de grupos voluminosos en las estructuras de algunos de ellos, solo aminoácidos con pequeñas cadenas laterales como la prolina, alanina o glicina en la segunda posición, pueden encajar dentro de este estrecho bolsillo.19 El acceso al sitio S1 también ha sido catalogado como necesario para la inhibición de la actividad enzimática de DPP-IV.20) Por lo tanto, los modos de inhibición identificados para cada nuevo inhibidor mediante herramientas cinéticas y los estudios mediante herramientas bioinformáticas, están en perfecta consonancia con comportamientos de tipo competitivo (figura 1E). Aun cuando estas moléculas también inhiben a la APN y APA, los mecanismos involucrados en cada caso son diferentes, y permiten emplear estas moléculas como compuestos líderes para el diseño de nuevos inhibidores de APN o DPP-IV teniendo en cuenta los nuevos aportes a la relación estructura-función realizados para cada enzima blanco.
Biodistribución en modelo de rata
El efecto de los inhibidores sobre la actividad de APN y DPP-IV en diversos tejidos de ratas se evaluó in vivo. La inyección intraperitoneal de 3 µg de cualquiera de los compuestos BTB11079, JFD00064, BTB07018 o HTS08762/g no indujo ninguna mortalidad o cambio en el comportamiento espontáneo de las ratas, en comparación con el grupo de solución salina (no mostrado). Todos los inhibidores disminuyeron la actividad APN y DPP-IV en cerebro, hígado y páncreas 60 min después, en comparación con el grupo control (animales inyectados con solución salina) (figura 2) lo que sugiere su rápida absorción y amplia biodistribución que incluye el cruce de la barrera hematoencefálica. Este hallazgo es relevante debido a la implicación de APN y DPP-IV en los procesos fisiológicos y fisiopatológicos en estos tejidos, en particular en el Sistema Nervioso Central. Muchos medicamentos hidrofóbicos se unen de forma reversible al sitio 1 de la albúmina de suero humana (ASH), una asociación que mejora las propiedades farmacocinéticas y la biodistribución de compuestos terapéuticos.21
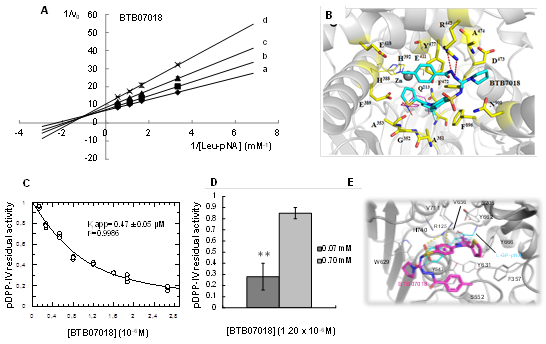
Fig. 1 Resumen de la caracterización cinética de la inhibición de APN y DPP-IV, y los estudios de relación estructura-función de los nuevos inhibidores identificados, tomando BTB07018 como ejemplo. A) Inhibición de APN porcina por BTB07018: identificación de un mecanismo no competitivo ( ( 1, concentraciones a: 0, B:0,56; C:1,12; D:2,25 µm; B) Modo de unión de hAPN: BTB07018: sustrato; C) Determinación del valor de Kiapp de BTB07018 vs DPP-IV porcina. Los datos fueron ajustados a la ecuación de Morrison para la inhibición de unión fuerte; D) Efecto de la concentración de (0,07 mM y 0,70 mM) sobre la inhibición de DPP-IV por BTB07018; E) Modo de unión de hDPP-IV:BTB07018.

Fig. 2 Efecto in vivo de los inhibidores sobre la actividad de APN y DPP-IV en cerebro, hígado y páncreas de ratas macho adultas. A, B y C: efecto sobre la actividad de APN: Los datos son la media ± DE (n = 6). Datos ANOVA: cerebro (F = 6,673; P < 0,001), riñón (F = 10,061; P < 0,001), hígado (F = 5,235; P < 0,05), páncreas (F = 5,549; P < 0,001). Prueba posthoc de Tukey-Kramer: *: p < 0,05; **: p < 0,01; ***: p < 0,001. D, E y F: Efecto sobre la actividad de DPP-IV: Los datos son la media ± DE (n = 6). Datos ANOVA: cerebro (F = 43,38; P < 0,001), hígado (F = 22,06; P < 0,001), páncreas (F = 4,19; P < 0,001) Prueba posthoc de Tukey-Kramer: *: p < 0,05; **: p < 0,01; ***: p < 0,001.
Efecto de los nuevos inhibidores sobre la viabilidad celular de líneas tumorales APN+ y DPP-IV+
Con el objetivo de evaluar el efecto de los compuestos de Maybridge (BTB11079, BTB07018, JD00064, y HTS08762) en sistemas celulares, se procedió a la realización de estudios del efecto de estas moléculas en cultivos celulares de líneas tumorales (tabla 2). Primeramente, confirmamos la presencia de DPP-IV y APN en las referidas líneas mediante herramientas cinéticas con el empleo de los sustratos específicos (L-Gly-Pro-pNA y L-Leu-pNA, respectivamente) y demostramos la susceptibilidad de ambas enzimas a ser inhibidas con el empleo de inhibidores modelos, en el contexto de la superficie celular bajo las condiciones dadas in vitro. La medida de la actividad de DPP-IV reveló un comportamiento lineal de la absorbancia a 405 nm en función del tiempo en las líneas HL-60, A431, 3LL-D122, CT26 y MDA-MDB-231. Las líneas humanas PC3 y H125 no mostraron actividad tipo DPP-IV. La actividad tipo DPP-IV de la línea murina MDA-MDB-231 disminuyó alrededor de un 30 % cuando fue incubada previamente con P32/98 (concentración de 11,0 μM en el ensayo), conocido inhibidor de DPP-IV.14 La medida de la actividad de APN reveló un comportamiento lineal de la absorbancia a 405 nm en función del tiempo en las líneas 3LL-D122, A431, CT26, HL-60, PC3 y H125. La línea murina MDA-MDB-231 no mostró actividad tipo APN. Al ser previamente incubadas con bestatina (concentración de 10,0 μM en el ensayo), inhibidor control de APN, la actividad tipo APN de las líneas CT26 y 3LL-D122 disminuyó alrededor de un 80 % y un 84 % respectivamente.
Posteriormente, se procedió a comprobar el efecto de los compuestos en estudio sobre la viabilidad celular de estas líneas. Se incluyó un control positivo de inhibición para cada una de ambas ectopeptidasas: líneas tratadas con P32/98 para DPP-IV y líneas tratadas con bestatina para APN. En todos los casos se utilizaron varias concentraciones de inhibidor separadas por un orden de magnitud con el objetivo de establecer un efecto dosis-respuesta. En paralelo a la comprobación del efecto de los inhibidores sobre las líneas tumorales, se realizó un ensayo similar, pero sobre fibroblastos humanos normales (línea HEK-293). Para este control de fibroblastos humanos normales se empleó un tiempo de incubación de 96 h, el doble del empleado para cada línea tumoral (excepto para HL-60, cuyo tiempo de incubación fue de 72 h), lo cual garantizó el establecimiento de una cota superior suficientemente alta. Se calculó el porcentaje de células viables de cada ensayo. Se obtuvo un comportamiento dependiente de la dosis de inhibidor y para lograr mejor entendimiento de los resultados se construyó la tabla 2, que resume los porcentajes de viabilidad celular obtenidos a la máxima concentración de inhibidor ensayada en cada línea. En todos los casos la pérdida de viabilidad fue superior en las líneas tumorales, y todos los inhibidores mostraron efectos más potentes que la bestatina y P32/98 empleados como controles. El efecto preliminar observado en los inhibidores seleccionados de Maybridge frente a las líneas celulares tumorales y su baja toxicidad en HEK293, avalan su empleo en estudios posteriores en diferentes modelos tumorales APN+ y DPP-IV+. En general, estos resultados iniciales aportan nuevas moléculas con buena potencia inhibitoria, y efectos sobre la viabilidad de un conjunto de células tumorales, que pudieran significar una ventaja terapéutica, o convertirse en candidatos para el diseño de moléculas más potentes y específicas en el tratamiento de esta patología tan compleja.
Tabla 2 Porcentajes de viabilidad celular obtenidos con la máxima concentración de inhibidor en cada línea celular ensayada
| Línea Celular | BTB11079 (10-5 mol/L) | BTB07018 (10-5 mol/L) | JDF00064 (10-5 mol/L) | HTS08762 (10-5 mol/L) | P32/98 (10-5 mol/L) | Bestatina (10-5 mol/L) |
| HEK-293 | 90,2 % | 85,4 % | 86,8 % | 70,9 % | 87,1 % | 87,0 % |
| HL-60 | 40,4 % | 42,8 % | 56,7 % | 45,2 % | 62,3* % | 59,0 % |
| A-431 | 82,2 % | 77,4 % | 74,4 % | 75,5 % | 90,5 % | 85,5 % |
| 3LL-D122 | 66,3 % | 74,8 % | 66,5 % | 55,6 % | 60,4 % | 94,3 % |
| CT26 | 63,8 % | 65,3 % | 67,0 % | 63,2 % | 83,1 % | 82,1 % |
| MDA-MDB-231(APN-) | 54,9 %* | 50,3 %* | 64,1 % | 75,3 % | ND | ND |
| PC3(DPP-IV-) | 63,8 % | 57,0 % | 56,3% | ND | ND | 72,9 % |
| H125(DPP-IV-) | 37,6 % | 55,5 % | 71,4 % | ND | ND | 72,1 % |
Bestatina y bacitracina como inhibidores de APN, APA y DPP-IV con potencialidades biomédicas
Como parte del enfoque de búsqueda de nuevos inhibidores de APN, APA y DPP-IV de baja masa molecular, se procedió a la evaluación del efecto inhibitorio de la bestatina y la bacitracina sobre estas enzimas, teniendo en cuenta antecedentes informados de que moléculas pequeñas caracterizadas por un elevado grado de hidrofobicidad y presencia de grupos voluminosos, son bien acomodados en el centro activo de APN y APA, ejerciendo efectos inhibitorios,22 así como que DPP-IV es inhibida por un análogo de la bestatina, la epibestatina.
En el caso de la bestatina, los ensayos mecanísticos indicaron una inhibición de tipo no competitiva α > 1 para las 3 enzimas. Este resultado en primer lugar, refuta los resultados previos obtenidos para APN y APA donde la bestatina había sido tradicionalmente clasificada como un inhibidor competitivo de ambas enzimas,16 debido fundamentalmente a que los estudios cinéticos habían sido realizados a altas concentraciones de sustrato, que no permiten visualizar los componentes no competitivos que se manifiestan a bajas concentraciones de sustrato para una inhibición de este tipo.9 En el caso de DPP-IV, constituye el primer informe de la inhibición de esta enzima por la bestatina, y su carácter no competitivo, al igual que para APN y APA reviste gran relevancia fisiológica.10 Los valores Ki estuvieron en el orden micromolar en todos los casos y se resumen en la tabla 1.9,10,12
Para comprender el perfil de inhibición no competitivo identificado para bestatina frente a pAPN y pAPA, abordamos las interacciones del inhibidor con residuos involucrados en la catálisis, unión de sustrato y otros subsitios putativos. APN y APA comparten un mecanismo catalítico común a pesar de su modesta similitud de secuencia. El modelo del complejo pAPA: bestatina muestra que el inhibidor se acomodó en una pose similar a la previamente predicha para el complejo pAPN: bestatina,9 incluidas para ambas enzimas, las interacciones con los residuos His-383, Glu-384, His-387 asociados con la quelación del zinc y Glu-406 y Tyr-469 implicados en catálisis. Estos residuos están altamente conservados dentro de la familia M1 y apoyan el tipo de inhibición no competitiva identificada por el enfoque cinético. Sin embargo, el bolsillo S1 que aloja la cadena lateral de ligandos P1 difiere notablemente entre APN y APA, de acuerdo con sus diferentes especificidades de sustrato. El bolsillo S1 de APA es adecuado para acomodar las cadenas laterales de los residuos ácidos y el de APN para acomodar residuos neutros preferentemente; es decir, la cadena lateral del carboxilato P1 forma un puente salino fuerte con la Arg-887 y un enlace de hidrógeno con Thr-356 en APA humano, y de manera similar para Arg-878 en APA de ratón. Estas interacciones energéticamente favorables son consistentes con la alta actividad que la APA de mamíferos ejerce sobre sustratos con glutamato en el sitio P1. En línea con estos antecedentes, nuestro análisis mostró una interacción de puente salino entre el carboxilato C-terminal de bestatina y el resto de guanidinio de la Arg-877 de pAPA (Arg-887 en APA humano, Arg-878 en APA de ratón), que respalda el componente competitivo del tipo de inhibición no competitiva (α > 1) identificado. Además, está presente una interacción de enlace de hidrógeno con Thr-346 que juega un papel clave en la especificidad del sustrato de APA para los aminoácidos ácidos N-terminales asegurando el posicionamiento óptimo del sustrato durante la catálisis. El análisis de secuencia de aminopeptidasas pertenecientes a la familia M1 sugiere que dirigir inhibidores a interactuar con los residuos Arg-877 y Thr-346 debe mejorar la selectividad y la potencia de los inhibidores de APA con respecto a otros miembros de la familia M1. Además, la bestatina forma una interacción de enlace de hidrógeno con el Glu-213 que no se conserva en la APN humana y porcina, que sugiere otras pistas para el diseño de inhibidores selectivos de APA con respecto a APN.
Teniendo en cuenta la novedad de la inhibición de DPP-IV por bestatina, ya que es la primera vez que se identifica inhibición de una proteasa de tipo serino por la bestatina, se establecieron mediante herramientas bioinformáticas, las bases estructurales de la inhibición y selectividad de bestatina por DPP-IV en el contexto de la familia S9 de las serino peptidasas. Se utilizó una estructura unida al sustrato como receptor en el acoplamiento de bestatina al sitio activo de hDPP-IV, permitiendo así obtener la estructura predicha del complejo ternario. En este complejo, la bestatina establece interacciones polares con los residuos de Glu-205 y Glu-206, ambos residuos implicados en la unión y orientación correcta del sustrato mediante enlaces salinos con su N-terminal. El inhibidor también interactúa con la Tyr-547, que es esencial para acomodar y estabilizar el oxianión tetraédrico intermedio generado durante la catálisis. La bestatina se une al subsitio S2 “extenso” junto al sustrato, un sitio al que solo pueden acceder los inhibidores, al interactuar con los residuos de Ser-209, Phe-357 y Arg-358. Estas interacciones también tienen implicaciones relevantes en la selectividad, porque otras enzimas de la familia S9, como la dipeptidil peptidasa 8/9 (DPP8/9) y la proteína de activación de fibroblastos (FAP), no presentan esta región de anclaje a inhibidores del subsitio S2 “extenso”. La selectividad es extremadamente importante cuando se considera cualquier compuesto con fines terapéuticos.
En todos los casos, la efectividad de la bacitracina estuvo en el intervalo micromolar (tabla 1). La representación de Lineweaver-Burk (LB) indica para pAPN un tipo de inhibición no competitivo α= 1 en el que el inhibidor se une a la enzima y produce un complejo inactivo, independientemente de la unión del sustrato (α = 1; β = 0) (tabla 1). La representación de LB indicó para pAPA un tipo de inhibición no competitiva α < 1. Los valores de Ki frente a pAPN y pAPA fueron más bajos (indicando mayor potencia de inhibición para APN y APA) que el efecto de la bacitracina sobre la proteína disulfuro isomerasa, para lo cual la inhibición es de tipo competitivo. En el caso de pDPP-IV, la inhibición de bacitracina fue de tipo competitivo.
Efecto de la bestatina y la bacitracina sobre la viabilidad celular de la línea APN+/DPP-IV+ de melanoma humano MeWo (HTB-25TM)
Se procedió a estudiar los efectos de bestatina y bacitracina en cultivos celulares de la línea de melanoma humano MeWo (HTB-25 TM) teniendo en cuenta que este tipo de cáncer es de alta incidencia en nuestro país. Primeramente, confirmamos la presencia de DPP-IV y APN en la línea tumoral, con resultados similares a los informados previamente para las otras líneas evaluadas.10 La actividad de tipo APN disminuyó en un 70 % en presencia de bestatina (0,1 mM) y se inhibió casi por completo en presencia de bacitracina (1 mM). La actividad de tipo DPP-IV disminuyó en presencia de bestatina (0,1 mM) y bacitracina (1 mM) en aproximadamente un 50 %. Por tanto, se valida a la línea celular MeWo como un modelo de células tumorales humana DPP-IV +/APN + para su empleo en estudios de los efectos de ambos inhibidores sobre la viabilidad celular. Ambos inhibidores tuvieron un efecto dependiente de la dosis, siendo bestatina más eficiente que la bacitracina; a 100 µM, bestatina inhibió la viabilidad celular en más de un 55 % mientras que la bacitracina solo redujo la viabilidad celular en un 15 % (figura 3A, B). A concentraciones que afectaron la viabilidad en un 50 %, ambos inhibidores incrementaron el porciento de células que mostraron degradación de ADN (figura 3C), indicando que las vías apoptóticas podrían estar implicadas en sus efectos sobre la viabilidad celular. Ambos inhibidores a concentraciones que afectaron la viabilidad celular en un 10 % a 20 % no alteraron la proporción de células en cada fase del ciclo celular (figura 3D). El efecto de bacitracina sobre a línea MeWo fue similar al informado para la línea de melanoma murino MB16F1012 y superior al informado para otras líneas de melanoma donde la disulfuro isomerasa fue considerada el blanco de su acción.

Fig. 3 Efecto de bestatina y bacitracina sobre línea de melanoma humano MeWo. A: efecto sobre la viabilidad celular de la bestatina, B: efecto sobre la viabilidad celular de la bacitracina. Para ambos inhibidores, un experimento representativo es mostrado y los datos son media ± DE (n = 3). ANOVA: bestatina (F = 170,52; P < 0,001), bacitracina (F = 102,79; P < 0,001). Tukey-Kramer post hoc test; diferentes letras indican diferencias significativas entre los grupos de tratamiento para P < 0.001. Línea roja resalta el 50 % de viabilidad celular. Efecto de bacitracina y bestatina sobre la fragmentación del AND A) y el ciclo celular B) de células de la línea tumoral MeWo.
Conclusiones
Los resultados de la presente contribución apoyan firmemente el uso de bestatina y bacitracina como un enfoque terapéutico potencial para el tratamiento del melanoma. Además, DPP-IV y APN colocalizan y se sobreexpresan en otras patologías de la piel como acné y psoriasis, así como en otras enfermedades. En consecuencia, tanto los nuevos inhibidores Maybridges de APN y DPP-IV, bacitracina, bestatina, así como algunos de los análogos de bestatina desarrollados actualmente para la inhibición de metaloaminopeptidasas, también podrían ensayarse como posibles inhibidores duales de DPP-IV y APN, con posibles aplicaciones biomédicas en las patologías mencionadas anteriormente.