INTRODUCCIÓN
La COVID-19 es una patología de evolución gradual caracterizada por diferentes mecanismos moleculares.1 Los primeros análisis de pacientes con coronavirus en China sugirieron que el virus podría no ser el único responsable del daño pulmonar, pero que una respuesta inmune hiperreactiva también pudiera contribuir a la patogénesis de la enfermedad.2
Varios genes del SARS-CoV-2 inducen el déficit del transductor de señal y el activador de la transcripción 1 (STAT1) y la hiperactivación de STAT3. El déficit de STAT1 junto con la lesión pulmonar induce la sobreexpresión de EGFR en las células epiteliales alveolares infectadas. La activación de EGFR conduce a una activación adicional de STAT-3. Además, en las células infectadas con SARS-CoV-2, se establece un círculo de respuesta positiva entre STAT3 y el inhibidor del activador del plasminógeno-1 (PAI-1). La regulación positiva de PAI-1 conduce a una coagulopatía caracterizada por trombos intravasculares.3
El receptor del factor de crecimiento epidérmico (EGFR) es una glicoproteína de membrana con actividad tirosina quinasa, cuya función fisiológica es regular el desarrollo del tejido epitelial y la homeostasis.4 Además, existen numerosas evidencias sobre el papel del EGFR en la fibrosis. Según Venkataran y cols. la señalización del EGFR permanece activa después de la eliminación del virus SARS-CoV, lo que conduce a la fibrosis.5 El EGFR también está presente durante la remodelación patológica del pulmón en pacientes con fibrosis quística avanzada.6 Ishii y cols. informó que el inhibidor de EGFR-tirosina quinasa (TKI) gefitinib previno la fibrosis pulmonar inducida por bleomicina en un modelo de ratón C57BL/6.7 El tratamiento con gefitinib inhibió la fosforilación del EGFR de fibroblastos y disminuyó la proliferación de fibroblastos.7
El EGFR también se sobreexpresa en carcinomas escamosos o adenocarcinomas de diferente localización.4 El conocimiento del papel del EGFR en los tumores malignos ha avanzado enormemente en los últimos 20 años y se han registrado varios fármacos terapéuticos como TKI y anticuerpos monoclonales (AcM) anti-EGFR para los tumores epiteliales.8-10 El nimotuzumab es un anticuerpo humanizado que reconoce al EGFR.11 El anticuerpo previene la dimerización del receptor, inhibiendo así la actividad de la tirosina quinasa e interfiriendo con las vías de señalización celular involucradas en la proliferación celular, inflamación, angiogénesis y supervivencia.12,13 El nimotuzumab disminuye la interleucina 6 en ratones xenoinjertados con células tumorales pancreáticas.13 El bloqueo de la señalización del EGFR no es el único mecanismo de acción subyacente a la eficacia de nimotuzumab. Los estudios in vitro demostraron que el nimotuzumab puede ejercer sus efectos parcialmente a través de la citotoxicidad mediada por células y activando células dendríticas y células T CD8 específicas.14,15
Los resultados de eficacia de nimotuzumab se han reportado en más de 40 ensayos clínicos de fase I a fase III, realizados principalmente en pacientes con tumores en estadio avanzado, incluyendo carcinomas de células escamosas de cabeza y cuello, esófago, nasofaringe, de células no pequeñas de pulmón, páncreas, astrocitoma anaplásico y glioblastoma multiforme.14,16-21
Dado que la lesión pulmonar aguda y la pérdida funcional de STAT1 pueden conducir a la sobreexpresión de EGFR y, en consecuencia, a una mayor activación de STAT3, planteamos la hipótesis de que el bloqueo de EGFR con nimotuzumab pudiera ser una estrategia eficaz para controlar la inflamación y prevenir una respuesta fibrosa excesiva al SARS-CoV-2.
MÉTODOS
La expresión de EGFR se evaluó mediante inmunohistoquímica en muestras de pulmón de pacientes fallecidos con COVID-19. Se obtuvieron 20 fragmentos de pulmón del departamento de patología de los hospitales Luis Díaz Soto y Salvador Allende (La Habana, Cuba). Los fragmentos de tejido se fijaron en formaldehído y se incluyeron en bloques de parafina. Los portaobjetos con secciones de tejido pulmonar se desparafinaron y lavaron en solución tamponada con fosfato y agua destilada. Se bloqueó la actividad peroxidasa endógena y se realizó la reanimación antigénica del EGFR utilizando proteinasa K (Dako, EUA). Las muestras se incubaron con el AcM murino IOR egf/r3 durante una hora. Posteriormente, los cortes se incubaron con peroxidasa de rábano (Dako, EUA) y se reveló la reacción enzimática con tetrahidrocloruro de diaminobencidina (DAB) (Dako, EUA). Las secciones de tejido también se contrastaron con la hematoxilina de Mayer (Dako, EUA). La expresión positiva se definió por la presencia de un color marrón ubicado en la membrana plasmática de las diferentes células. El porcentaje de células positivas por campo histológico se cuantificó en 5 imágenes digitalizadas con una cámara digital DP20 acoplada a un microscopio óptico (Olympus CX31, Japón) a un aumento de 40X.
Se llevó a cabo un ensayo clínico prospectivo, no controlado, abierto, multicéntrico de fase I/II para evaluar la seguridad y el efecto preliminar de nimotuzumab, en pacientes con infección confirmada por SARS-CoV-2, mediante reacción en cadena de la polimerasa con transcripción inversa (RT-PCR).
Los pacientes pudieron recibir otros tratamientos incluidos en el protocolo nacional para el manejo del COVID-19, incluyendo esteroides, anticoagulantes y antibióticos. Los criterios de inclusión fueron los siguientes: voluntad expresa del paciente, cualquier sexo o color de piel y edad mayor o igual a 18 años. Además, los pacientes debían tener una enfermedad grave de acuerdo con una de las siguientes condiciones: saturación de oxígeno (SpO2) menor que 94 % en el aire ambiente al nivel del mar o necesidad de oxigenoterapia para mantener la SpO2 mayor que 93 %, pacientes con una razón entre la presión parcial de oxígeno y la fracción de oxígeno inspirado (PaO2/FiO2) menor que 300 mmHg, pacientes con frecuencia respiratoria (FR) mayor que 30 respiraciones/min o pacientes con infiltrados en más del 50 % de ambos campos pulmonares. También se incluyeron los pacientes con síntomas moderados con alto riesgo de empeoramiento. Los síntomas moderados incluyeron fiebre persistente durante 48 h, polipnea (FR > 25 respiraciones/min), cambios en la radiografía o ecografía pulmonar, disminución de la saturación de oxígeno, astenia marcada y cambio en el estado mental. Los pacientes con alto riesgo de agravamiento se definieron como aquellos con edad mayor o igual que 65 años y comorbilidades como diabetes mellitus, hipertensión, enfermedad renal crónica, enfermedad cardiovascular, inmunodeficiencia, obesidad y cáncer. El protocolo se aprobó por los comités de ética de los hospitales participantes y por la Agencia Nacional Reguladora, CECMED. Todos los pacientes firmaron el consentimiento informado. El protocolo se incluyó en el registro público cubano de ensayos clínicos (https://rpcec.sld.cu/ensayos/RPCEC00000369-En).
El tratamiento consistió en infusiones intravenosas (IV) de nimotuzumab hasta un máximo de 5 dosis, administradas cada 72 h. El número de dosis recomendado fue de 2 para los pacientes moderados y 3 para los sujetos graves. El criterio principal para la interrupción fue la aparición de eventos adversos graves relacionados con el producto en investigación. La dosis de carga fue de 200 mg, mientras que las dosis posteriores del anticuerpo fueron de 100 mg. El nimotuzumab se diluyó en 250 mL de solución salina (0,9 %) y se administró durante 2 h.
Los objetivos del estudio fueron evaluar la seguridad preliminar y el efecto de nimotuzumab en el tratamiento de pacientes graves o moderados con COVID-19. Todos los eventos adversos se recogieron y clasificaron de acuerdo con la frecuencia, intensidad, gravedad, relación causal y consecuencias para el sujeto. Los eventos adversos se clasificaron de acuerdo con los criterios terminológicos comunes para eventos adversos, versión 5.
Las principales variables de eficacia fueron: tasa de pacientes recuperados (egresados del hospital) 14 d después de la primera infusión, tiempo de estadía en la unidad de cuidados intensivos, tasa de pacientes graves que mejoraron la relación PO2/FiO2 y tasa de pacientes que requirieron ventilación mecánica después del nimotuzumab. Los valores hematológicos, incluyendo el recuento de neutrófilos, linfocitos y plaquetas, se evaluó antes del nimotuzumab y cada 48 h. Se midieron otros parámetros bioquímicos que incluían creatinina, aspartato aminotransferasa (AST), alanina-aminotransferasa (ALT), proteína C reactiva (PCR), ferritina, lactato deshidrogenasa (LDH) y dímero D a lo largo del tiempo. Además, se midió la interleucina 6 (IL-6) y el inhibidor del activador p asminógeno-1 (PAI-1), utilizando un kit de ELISA de IL-6 Quantikine humano (Cat # S6050) (Minneapolis, EUA) y un sistema ELISA cuantitativo del PAI-1 (BE59351) (IBL International GmbH D-22335 Hamburgo. Se midió el PAI-1 en plasma. La evolución de las lesiones pulmonares se midió mediante radiografías seriadas o tomografía axial computarizada (TAC).
Los datos demográficos, comorbilidades, así como las terapias previas y concurrentes se reportan en los 2 grupos de gravedad de la enfermedad. Se utilizó la estadística descriptiva para mostrar las variables cualitativas, mientras que para las variables cuantitativas con distribución normal o no normal se utilizó la media y desviación estándar o la mediana y el rango intercuartílico, respectivamente. Se construyeron curvas de características operativas del receptor (ROC) para correlacionar las variables del laboratorio con la mortalidad por COVID-19. Se calculó la razón de posibilidades (OR) para varias variables independientes, incluyendo los datos demográficos, las comorbilidades y los parámetros de laboratorio por encima del umbral predeterminado para mayor riesgo de mortalidad. Los análisis se realizaron con el software SPSS versión 25 y R.
RESULTADOS
Se detectó expresión de EGFR en las 20 muestras de patología de pacientes fallecidos por COVID-19. Tuvieron más del 60 % de positividad 19 sujetos (95 %), mientras que un caso mostró 25 % de células positivas para EGFR. Las células positivas parecen corresponder morfológicamente a neumocitos de tipo I y II, macrófagos alveolares y fibroblastos. En la figura 1 podemos ver 2 muestras representativas de la expresión de EGFR en el tejido pulmonar de 2 pacientes fallecidos por COVID-19.
Después de la demostración de la expresión de EGFR en los pulmones de fallecidos con COVID-19, se realizó un ensayo clínico utilizando el AcM anti-EGFR nimotuzumab. Entre el 19 de mayo y el 19 de junio de 2021, se incluyeron 41 pacientes (31 graves y 10 moderados) en 3 hospitales de La Habana. En total, se incluyeron 23 pacientes del sexo masculino y 18 del sexo femenino (tabla 1). La mediana de edad fue de 62 años (32-83) años y las principales comorbilidades fueron hipertensión, diabetes mellitus, enfermedad cardiovascular y obesidad (tabla 1). La mayoría de los pacientes recibieron el AcM nimotuzumab de forma concomitante con heparina de bajo peso molecular, esteroides y antibióticos (tabla 2). Un pequeño grupo de pacientes también recibió CIGB-258, un péptido con propiedades inmuno-reguladoras (tabla 2).22

Fig. 1 Imágenes microscópicas representativas de la expresión de EGFR en el tejido pulmonar de 2 pacientes fallecidos por COVID-19. Las flechas rojas muestran las células positivas, incluyendo neumocitos, macrófagos alveolares y fibroblastos.
Tabla 1 Datos demográficos y comorbilidades de los pacientes al inicio del estudio
| Sexo | Femenino | 13 | 41,9 | 5 | 58,1 | 18 | 43,9 |
| Masculino | 18 | 58,1 | 5 | 50,0 | 23 | 56,1 | |
| Color de piel | Blanca | 3 | 30,0 | 17 | 54,8 | 20 | 48,8 |
| Mestiza | 4 | 40,0 | 8 | 25,8 | 12 | 29,3 | |
| Negra | 2 | 20,0 | 3 | 9,7 | 5 | 12,2 | |
| ND | 1 | 10,0 | 3 | 9,7 | 4 | 9,8 | |
| Edad | Media ± DE | 59,8 ± 15 | 59,5 ± 12 | 59,7 ± 14 | |||
| Mediana ± RI | 62 ± 26 | 61 ± 18 | 62 ± 22 | ||||
| min; máx | 32-83 | 35-74 | 32-83 | ||||
| Pacientes con al menos 1 comorbilidad | 27 | 87,1 | 7 | 70,0 | 34 | 82,9 | |
| Pacientes con 2 o más comorbilidades | 15 | 48,4 | 5 | 50,0 | 20 | 48,8 | |
| Hipertensión | 19 | 61,3 | 6 | 60,0 | 25 | 61,0 | |
| Enfermedades cardiovasculares | 5 | 16,1 | 1 | 10,0 | 6 | 14,6 | |
| Diabetes mellitus | 11 | 35,5 | 5 | 50,0 | 16 | 39,0 | |
| Asma bronquial | 4 | 12,9 | 0 | 0 | 4 | 9,7 | |
| Enfermedad pulmonar obstructiva crónica (EPOC) | 1 | 3,2 | 0 | 0 | 1 | 2,4 | |
| Obesidad | 5 | 16,1 | 1 | 10,0 | 6 | 14,6 | |
| Accidente vascular encefálico | 1 | 3,2 | 0 | 0 | 1 | 2,4 | |
| Hipertiroidismo | 0 | 0 | 2 | 20,0 | 2 | 4,8 | |
| Hipotiroidismo | 0 | 0 | 1 | 10,0 | 1 | 2,4 | |
| Cáncer | 1 | 3,2 | 0 | 0 | 1 | 2,4 | |
| Pericarditis | 2 | 6,4 | 0 | 0 | 2 | 4,8 | |
| Artritis reumatoide | 0 | 0 | 1 | 10,0 | 1 | 2,4 | |
Tabla 2 Terapia previa y concurrente
| Pacientes graves | Pacientes moderados | Total | ||||
|---|---|---|---|---|---|---|
| Frec. | % | Frec. | % | Frec. | % | |
| Interferón alfa recombinante | 12 | 38,7 | 6 | 60,0 | 18 | 43,9 |
| Heparina de bajo peso molecular (BPM) | 15 | 48,4 | 4 | 40,0 | 19 | 46,3 |
| Esteroides | 23 | 74,2 | 3 | 30,0 | 26 | 63,4 |
| Antibióticos | 26 | 83,9 | 10 | 100 | 36 | 97,8 |
| CIGB-258 | 12 | 38,7 | 4 | 40,0 | 16 | 39,02 |
| Interferón alfa recombinante | 0 | 0 | 3 | 30,0 | 3 | 7,3 |
| Heparina BPM | 30 | 96,8 | 4 | 40,0 | 34 | 82,9 |
| Esteroides | 28 | 90,3 % | 3 | 30 % | 31 | 75,6 % |
| Antibióticos | 30 | 96,8 % | 10 | 100 % | 40 | 97,6 % |
| CIGB-258 | 12 | 38,7 % | 1 | 10% | 13 | 31,7 % |
Todos los pacientes que ingresaron al ensayo con una afección grave fueron tratados en la unidad de cuidados intensivos (UCI), mientras que los pacientes moderados recibieron nimotuzumab en la sala convencional del hospital. El intervalo de tiempo entre el inicio de los síntomas y el tratamiento con nimotuzumab fue de 8,5 d (de 3 a 49) días, mientras que, para los pacientes graves, el intervalo de tiempo entre el ingreso en la UCI y el nimotuzumab fue de 3 d (de 0 a 9) días.
Recibieron una sola dosis de nimotuzumab 7 pacientes (17,07 %), recibieron 2 infusiones 29 (70,7 %) mientras que 5 sujetos (12,19 %) requirieron 3 dosis del anticuerpo. El nimotuzumab fue muy seguro. Solo hubo 4 eventos adversos relacionados en 2 de los 41 pacientes (4,87 %). Un paciente grave tuvo un temblor de grado 1, mientras que otro paciente grave tuvo escalofríos, dolor de cabeza y temblores de grado 2. Los eventos se clasificaron como posiblemente relacionados con nimotuzumab y se presentaron después de la primera infusión del anticuerpo. No se detectaron eventos adversos relacionados de grado 3 o 4.
De los 41 pacientes tratados con nimotuzumab 8 (1 moderado y 7 graves) (19,5 %) requirieron ventilación mecánica invasiva (VMI). El tiempo promedio entre el nimotuzumab y el uso de VMI fue de 3,6 d. Se recuperaron 34 pacientes de 41 (82,92 %) 14 días después de comenzar con el anticuerpo. Según la gravedad de la enfermedad, 9 de 10 pacientes moderados (90 %) se recuperaron, mientras que 25 de 31 pacientes graves (80,64 %) egresaron en los primeros 14 días. El tiempo de estancia media en la UCI de los sujetos gravemente enfermos fue de 9 días.
En el séptimo día de tratamiento, el 76,2 % de los sujetos con enfermedad grave mejoró la relación PO2/FiO2. Hubo una reducción significativa en el área afectada de ambos campos pulmonares en el momento del alta, según la prueba de rangos pareadas de Wilcoxon. Además, se adquirieron imágenes seriadas de TAC. La figura 2 muestra imágenes seriadas de 3 pacientes antes del tratamiento con nimotuzumab, en el momento del alta y de 30 días a 60 días después de la hospitalización. Ninguno de los pacientes evaluados mostró signos de fibrosis en el seguimiento.
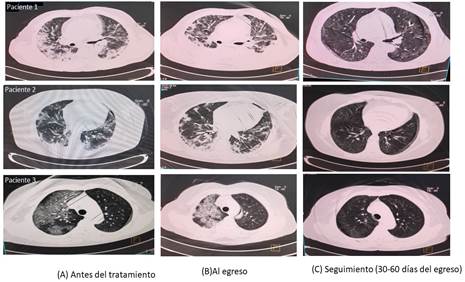
Fig. 2 Tomografía axial computarizada (TAC) de tórax de 3 pacientes tratados con nimotuzumab. Imágenes secuenciales al ingreso (columna A), al alta (columna B) y seguimiento (30-60) días después del alta. A y B: áreas extensas de opacidades en vidrio deslustrado, consolidación del espacio aéreo en la fase exudativa y disminución de los volúmenes pulmonares en las fases organizativa y fibrótica. C (seguimiento): Los 3 pacientes mostraron resolución de las lesiones inflamatorias pulmonares y ningún signo de fibrosis.
Los marcadores inflamatorios que incluyen PCR, ferritina, LDH, relación entre neutrófilos y linfocitos (NLR) y dímero D disminuyeron con el tiempo. Se realizaron curvas ROC para establecer la correlación entre los parámetros de laboratorio al inicio del estudio y la probabilidad de muerte en los pacientes graves. Los pacientes con valores de PCR por encima de 118,54 mg/L, LDH por encima de 333 U/L, recuento absoluto de leucocitos por encima de 8,95 ( 109/L y ferritina por encima de 490,5 µg/L tenían más probabilidades de morir. Sorprendentemente, los biomarcadores asociados con el mayor riesgo de letalidad fueron la LDH ≥ 333 U/L (OR 11,25 [IC 95 % 1,15; 110,5]) y el recuento absoluto de leucocitos ≥ 8,95 ( 109/L (OR 9,33 [IC 95 % 0,96; 90,9]).
Se evaluó la concentración sérica de interleucina 6 (IL-6) en 28 pacientes, 21 clasificados como graves y 7 como moderados. La concentración media en el momento de la inclusión en el ensayo clínico fue de 47,11 pg/ml para pacientes graves y 37,25 pg/ml para pacientes moderados. No se encontraron diferencias significativas al comparar estos niveles según el estado del paciente (prueba de Mann Whitney; p > 0,05). En el día 7, la IL-6 aumentó en 6 pacientes de los 25 (24 %), mientras que disminuyó o se estabilizó en el resto. Globalmente, la concentración media de IL-6 disminuyó de 46,5 pg/ml a 14,51 pg/ml en el día 7. Los niveles de PAI-1 en plasma se evaluaron sólo en 14 pacientes debido a la limitación del sistema de cuantificación. En particular, el PAI-1 estaba elevado en los 14 pacientes (valores de referencia 4-43 ng/ml). El nivel medio de PAI-1 al inicio del tratamiento fue de 80,11 ng/ml y se redujo a 69,28 ng/ml en el día 7 de tratamiento. Tras este resultado, se incluyó el AcM nimotuzumab en el protocolo cubano de manejo de la COVID-19. Más de 6000 pacientes cubanos se trataron con el AcM y se logró recoger información de seguridad y de tasa de recuperación de 1536 paciente de 21 hospitales. El nimotuzumab mantuvo el perfil de seguridad reportado en el ensayo clínico fase I/II. No se reportaron eventos adversos serios relacionados con el producto. Solamente se reportaron eventos adversos en 28 de los 1536 pacientes (1,8 %), fundamentalmente en la primera dosis. En estas condiciones del mundo real, se logró una alta tasa de recuperación en los pacientes moderados y graves (89,4 % y 79,4 %, respectivamente), lo cual se compara muy favorablemente con los datos del ensayo fase I/II.
DISCUSIÓN
Los síntomas de COVID-19 son extremadamente variables, desde hipoxia mínima a significativa, con síndrome de dificultad respiratoria aguda (SDRA) e insuficiencia multiorgánica, que podría ser fatal.1
Este ensayo clínico evaluó por primera vez el efecto de usar una droga anti-EGFR en el escenario COVID-19. Así mismo, se demostró la sobreexpresión de EGFR en el tejido pulmonar de pacientes fallecidos con SARS-CoV2. Este hallazgo valida aún más el enfoque de bloquear EGFR como una herramienta para reducir la inflamación, la hipofibrinólisis y para prevenir o revertir la fibrosis.
El nimotuzumab fue muy seguro. Las reacciones adversas coinciden con otras que se observan comúnmente en los estudios clínicos de cáncer e incluyen principalmente fatiga, náuseas, vómitos, escalofríos, anorexia y fiebre.16,20,23 Otros fármacos antinflamatorios recientemente recomendados como tratamiento a la COVID-19 como tocilizumab o baricitinib, si provocan reacciones adversas graves como otitis externa, bacteriemia y absceso pulmonar24 o reacciones adversas de grado 3 o 4 como hiperglicemia, anemia, disminución del recuento de linfocitos e insuficiencia renal aguda, respectivamente.25
El estudio mostró las evidencias iniciales de que el nimotuzumab en combinación con otros fármacos, incluidos los esteroides, reduce los marcadores inflamatorios, incluyendo la IL-6. La IL-6 es una citocina pleiotrópica que tiene un papel central en la respuesta inmune y en la inflamación.26 Cabe destacar que en nuestra serie no se encontraron diferencias entre pacientes moderados y graves en cuanto a la concentración de IL-6. Los niveles de IL-6 no aumentaron en el 86 % de los pacientes después de bloquear EGFR junto con esteroides. Otras moléculas que tienen como diana la vía de señalización de IL-6/IL-6R, como el tocilizumomab o el baricitinib, tienen efecto clínico significativo cuando se combinaron con esteroides.24,27
También se obtuvieron datos preliminares del impacto de la terapia combinada sobre los niveles de PAI-1. El PAI-1 estaba elevado en todos los pacientes evaluados. Anteriormente, se había demostrado que el PAI-1 aumentaba en el síndrome de insuficiencia respiratoria aguda y, en particular, en la COVID-19.28 En particular, Cugno y cols, no encontraron diferencias en la concentración de PAI-1 entre pacientes con enfermedad leve, moderada o grave.29 Además de las células endoteliales, las células senescentes alveolares tipo II secretan PAI-1 y promueven un fenotipo profibrótico.30 Según Alberti y cols, la activación del EGFR desencadena la coexpresión de IL-6 y PAI-1 a través de la activación transcripcional de NF-kB,31 mientras que Kang y otros autores, señalan que la vía de IL-6 incrementa la secreción de PAI-1, durante la tormenta de citocinas.32 Nuestro hallazgo inicial sobre la reducción de PAI-1 podría atribuirse a la inhibición directa del EGFR o al descenso de IL-6.
En nuestro conjunto de datos, el 19,5 % de los 41 pacientes necesitaron ventilación mecánica después de nimotuzumab, mientras que el 82,9 % egresaron antes del día 14. La tasa de recuperación fue del 80,6 % y del 90 % para los pacientes graves y moderados de alto riesgo, respectivamente. Estas cifras se comparan favorablemente con otros medicamentos anti-inflamatorios, que obtuvieron autorización de uso de emergencia para COVID-19.
El estudio RECOVERY que evaluó el AcM anti-IL-6R tocilizumab frente a la terapia convencional, reclutó a 4116 pacientes, que en su mayoría requerían ventilación no invasiva u oxígeno. Casi todos los pacientes recibieron corticosteroides. La tasa de recuperación fue del 62 % frente al 58 % en pacientes que requerían ventilación no invasiva y del 81 % frente al 77 % en pacientes que solo necesitaban oxígeno.24 No se observó ningún efecto significativo sobre la ventilación posterior y, globalmente, el 31 % de los pacientes con tocilizumab progresaron a soporte respiratorio.24 En otro estudio doble ciego en 438 sujetos con infiltrados pulmonares bilaterales e hipoxemia (COVACTA), la tasa de mortalidad fue del 19,7 % frente al 19,4 % para tocilizumab o placebo.33 La incidencia de ventilación mecánica entre los pacientes no ventilados al inicio del estudio fue del 27,9 % (tocilizumab) frente al 36,7 % (placebo).33 Recientemente, un inhibidor de Janus Kinase (JAK), baricitinib, mostró beneficio clínico en pacientes hospitalizados. Un estudio aleatorizado de 1033 pacientes (67 % de casos moderados y 33 %, graves) comparó remdesivir más baricitinib frente a remdesivir más placebo.25 La incidencia de muerte o ventilación fue menor en el grupo experimental que en el grupo control (22,5 % frente a 28 %).25 El segundo ensayo de Marconi y cols., comparó baricitinib más la terapia convencional vs. la terapia convencional en 1525 pacientes. La proporción de pacientes que progresaron a oxígeno de alto flujo, ventilación no invasiva o invasiva o muerte fue del 27,8 % en el grupo de baricitinib y del 30,5 % en el grupo de placebo.27
Finalmente, nuestro estudio encontró una reducción significativa de las áreas pulmonares afectadas y no se detectaron signo de fibrosis en aquellos sujetos evaluados de 30 d a 60 d después del alta. Un meta-análisis reciente en 250 351 supervivientes demostró que el 65 % de los pacientes tenían un aumento en el requerimiento de oxígeno, mientras que las anomalías en las imágenes del tórax persistieron en el 62,2 % de todos los supervivientes hasta 6 meses después de la recuperación.34
En resumen, nuestros resultados sugieren que el nimotuzumab es un anticuerpo seguro que puede reducir IL-6, PAI-1 y evitar la fibrosis en pacientes graves y moderados con COVID-19. A pesar del mal pronóstico de los pacientes, la tasa de ventilación fue inferior al 20 % y la tasa de recuperación fue alta.














