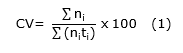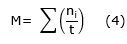Introducción
Cinchona officinalis L., conocida como árbol de Quina o Cascarilla, es una planta perteneciente a la familia botánica Rubiaceae, originaria de la zona Andina suramericana, específicamente de Bolivia, Perú, Ecuador, Colombia y Venezuela (Gómez et al., 2016). De la corteza de este árbol se extrae una sustancia rica en un alcaloide denominado quinina, el cual es utilizado para el tratamiento de la malaria o paludismo. Aunque se conoce genéricamente como officinalis (medicinal), se conocen alrededor de 23 especies del género Cinchona y es Perú el país que más especies posee (19), incluso aparece en el Escudo Nacional (Álvarez, 2013). Desde tiempos ancestrales, el uso medicinal de la quina era conocido por los pueblos originarios de los Andes, lo que hizo que con la colonización española sus propiedades y beneficios se extendieran, llegando a convertirse en uno de los árboles que más vidas ha salvado en el mundo. Su uso medicinal también ha sido su desgracia, ya que es una especie en peligro de extinción por su excesiva explotación y el uso inadecuado de los bosques, lo que ha producido la muerte de miles de plantas (Dulce, 2013). Al ser un árbol originario de la zona andina, el clima donde se encuentra distribuido es predominantemente cálido y húmedo, con abundantes precipitaciones y nubosidad casi todo el año; son zonas altas con influencia en el microclima y variaciones de temperatura y precipitación acordes con la altitud y latitud (Zeballos, 1989).
En el caso del Perú, el árbol de quina es considerado un símbolo nacional, debido a que aparece en el escudo nacional; sin embargo, existe dentro de la población un gran desconocimiento acerca del nivel de riesgo del mismo, ya que ha sido extraído indiscriminadamente de su ambiente y llevado a Asia para su explotación comercial. Aunque se han realizado proyectos de reforestación con especies endémicas del género Cinchona como en la zona andina de Lambayeque (Muñoz, 2017), algunas fuentes como la del portal de noticias Radio Podcast Perú de Lima (RPP, 2017) mencionan que, hasta el momento, de las 19 especies que existen en Perú, no existe un inventario con los árboles que se encuentran en estado salvaje.
La reproducción de la quina requiere de condiciones climáticas específicas, por ser una especie cuyo hábitat es de zona de montaña nublada, por lo que se han realizado estudios a nivel de laboratorio en los que se busca reproducirla en condiciones controladas (Campos-Ruíz et al., 2016; Caraguay-Yaguana, 2016; Jeréz, 2017; Lima et al., 2018), por lo que la presente investigación muestra los resultados de la germinación de las semillas de C. officinalis L., recreando las condiciones de temperatura y humedad necesarias a nivel de invernadero. La finalidad de la presente investigación es determinar el potencial germinativo de la planta fuera de su hábitat natural, manteniendo condiciones similares, para su posible reintroducción en aquellas zonas donde ha desaparecido producto de la deforestación y la sobreexplotación.
Materiales y métodos
Las semillas de C. officinalis L. fueron recolectadas de poblaciones silvestres ubicadas en el Centro Poblado Menor La Cascarilla-Jaén (1 850 msnm), sectores Tayabamba (1 200 msnm) y Santa Elena (2 100 msnm). Asimismo, se tomaron tres muestras compuestas de suelo de los mismos sitios donde se recolectaron las semillas, siguiendo el protocolo establecido en la Guía de Muestreo de Suelos del Ministerio del Ambiente del Perú, (2014).
Se muestran las semillas y las muestras de suelo se trasladaron a la ciudad de Trujillo-Perú, ubicada a nivel del mar, donde se realizaron los ensayos, estableciéndose un diseño experimental por bloques, completamente al azar. La nomenclatura utilizada para el diseño (Tabla 1).
Tabla 1 - Nomenclatura utilizada para las unidades experimentales
| Nomenclatura | Muestra de suelo |
| STY | Suelo del Sector Tayabamba |
| SSE | Suelo del Sector Santa Elena |
| SLC | Suelo de la Cascarilla |
Los suelos fueron caracterizados para obtener su textura mediante el método de sedimentación descrito por Andrades et al., (2015). Las muestras de suelo utilizadas fueron de 2 kg de suelo colocadas en envases o bandejas de plástico con tapa. En cada unidad experimental se sembraron 100 semillas a voleo de acuerdo a su procedencia y se regaron por atomización, con frecuencia diaria, cerrando cada unidad experimental para mantener un microclima con alta humedad que simulara las condiciones del ambiente natural de donde se obtuvieron las semillas.
El monitoreo de la cantidad de plántulas en cada unidad experimental se realizó desde los 13 días hasta 60 días, realizándose un conteo total, acumulado y promedio, para luego, mediante análisis estadísticos no paramétricos, establecer si existió diferencia significativa entre la germinación respecto al tipo de suelo. Se aplicaron modelos estadísticos no paramétricos debido a que, al tratarse de un estudio preliminar no se contaron con datos suficientes para realizar pruebas de supuestos de normalidad, en cuyo caso este tipo de pruebas es más conveniente. Se utilizó el software estadístico InfoStat, versión 2018. Adicionalmente se midió la altura de las plántulas al final del tiempo máximo de la investigación.
También se determinaron los siguientes parámetros, relacionados con la germinación de las semillas (González y Ürozco, 1996):
Coeficiente de velocidad de germinación (Ecuación 1).
Tiempo promedio de germinación (Ecuación 2).
Índice de germinación (Ecuación 3).
Velocidad de germinación (Ecuación 4).
Donde:
n i |
=número de semillas germinadas al día i |
t i |
=número de días después de la siembra |
t |
=tiempo de germinación desde la siembra hasta la germinación de la última semilla |
N |
=Número total de semillas sembradas |
CV |
=Coeficiente de Velocidad de germinación |
T |
=Tiempo promedio de germinación |
IG |
=Índice de germinación |
M |
=Velocidad de germinación |
Resultados y discusión
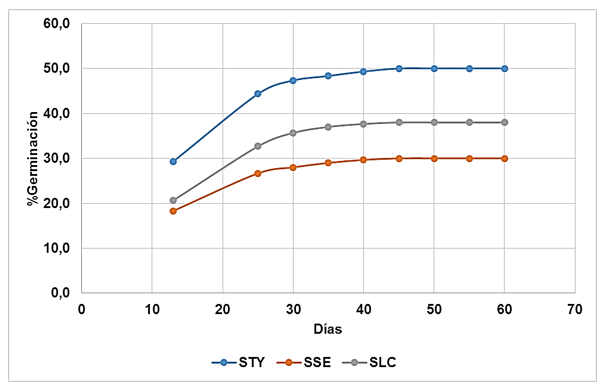
Se muestran los resultados del monitoreo de la germinación de las semillas en cada una de las unidades experimentales, durante un lapso de tiempo de 60 días (Tabla 2).
Se observa que la mayor parte de las semillas germina a los 13 días en todos los suelos. En promedio, el 58,1 % de las semillas germina en ese tiempo. También se evidencia que en el STY el número de semillas germinadas fue mayor, seguido por el SLC y en tercer lugar el SSE.
Tabla 2 - Resultados obtenidos de la germinación de las semillas de C. officinalis L.
| Días | Número de semillas germinadas | ||
| STY | SSE | SLC | |
| 13 | 88 | 55 | 62 |
| 25 | 45 | 25 | 36 |
| 30 | 9 | 4 | 9 |
| 35 | 3 | 3 | 4 |
| 40 | 3 | 2 | 2 |
| 45 | 2 | 1 | 1 |
| 50 | 0 | 0 | 0 |
| 55 | 0 | 0 | 0 |
| 60 | 0 | 0 | 0 |
| Total | 150 | 90 | 114 |
| Porcentaje | 50% | 30% | 38% |
| Tamaño promedio (cm) | 2,0 | 1,0 | 1,0 |
El tamaño promedio de las plántulas al final de los 60 días de monitoreo fue mayor en STY (2,0 cm) observándose que, para las plántulas germinadas en los suelos SSE y SLC, el tamaño promedio fue el mismo (1,0 cm).
Las condiciones en la localidad donde se establecieron las unidades experimentales se mantuvieron a una temperatura entre 13,5 y 22,0 ºC y, como las mismas se manejaron en ambiente cerrado, el microclima creado presentó una humedad cercana al 100 %, lo que es común en las zonas en las que se recolectaron las semillas y las muestras de suelo. Esto, según lo que reporta Sánchez y Vásquez, (2010)en el informe del mapa climático del departamento de Cajamarca, en donde la región de Jaén está catalogada como de clima de selva ecuatorial, seco, cálido y húmedo, con temperatura media superior a 18 ºC y sin estación seca, con precipitaciones durante todo el año (60,85 mm en promedio), siendo los meses más lluviosos octubre, noviembre y diciembre.
La replicación de las condiciones de temperatura y humedad presentes en el hábitat natural de la C. officinalis L., demostró que la misma, a pesar de ser una especie adaptada a la selva ecuatorial, puede germinar, si se mantiene la condición de humedad, en zonas de menor altura y con mayores temperaturas a la de su hábitat. Al respecto, Espinosa y Ríos, (2014) en su estudio del crecimiento de plántulas de C. officinalis L., reportaron que las mismas se mantuvieron a una temperatura promedio de 23 ºC, lo que concuerda con la temperatura medida en la presente investigación.
El porcentaje de germinación de las semillas varió en función del tipo de suelo donde se sembraron, llegando a obtenerse un máximo de 50 % en el suelo del sector Tayabamba de textura franco arenosa. El porcentaje de germinación obtenido concuerda con los reportados por Lima et al., (2018), quienes muestran valores entre 41,1 y 74,4 %. Igualmente se observó concordancia con los resultados de Caraguay-Yaguana, (2016), quienes obtuvieron 50 % de germinación de semillas para condiciones de poca luz a nivel de laboratorio. Campos-Ruíz et al., (2016) también reportan valores de germinación superiores a los obtenidos; sin embargo, los autores citados utilizaron semillas de Cinchona pubescens y aplicaron tratamientos para mejorar los resultados. Jeréz, (2017) también reportó, para semilla de C. officinalis L. germinación de más de 80 %, pero bajo condiciones controladas de laboratorio, lo que evidentemente incide en la diferencia respecto a los resultados de la presente investigación, donde las semillas germinaron en condiciones de invernadero sin tratamientos para mejorar su germinación. Solo se buscó simular las condiciones naturales de su hábitat.
Respecto al crecimiento de las plántulas a los 60 días, se observó que en STY el tamaño superó a los otros suelos en 100 %, lo que demostró que no solo hay mayor germinación en este suelo, sino que las plántulas se desarrollan con un mayor tamaño en un mismo período de tiempo respecto a los otros dos suelos utilizados. Al comparar estos resultados con los reportados por Asicona, (2013) se observa que el desarrollo de las plántulas fue mayor en el presente estudio, debido a que el autor citado reporta un máximo de 3,2 cm a 150 días, por lo que, si se considera un crecimiento lineal, sería aproximadamente 1,3 cm a 60 días; resultado similar a los obtenidos en las muestras de suelo SSE y SLC, pero inferior al del suelo STY.
La tasa de crecimiento de plántulas de C. officinalis L. también fue estudiada por Espinosa y Ríos, (2014), quienes reportaron un valor de 2,63 cm en 120 días (0,022 cm/día), resultado que también es inferior al obtenido en la investigación, debido a que la tasa de crecimiento diario fue de 0,033 cm/día. La tasa de crecimiento de las plántulas de quina varía de acuerdo a la especie, lo que se observa al comparar el resultado obtenido con trabajos como el de Gómez et al., (2016), quienes reportan que la C. pubescens, Vahl (quina roja) alcanzó una altura entre 3 y 4 cm en 60 días, lo que significa una tasa de crecimiento entre 0,05 y 0,067 cm/día, valores superiores a los obtenidos en la investigación para la C. officinalis L.
Las curvas de germinación se estabilizan a partir de los 40 días, independientemente del tipo de suelo, con cese de la misma a partir de 45 días (Figura 1).
Las curvas de germinación por tipo de suelo fueron similares en comportamiento y uniformidad, observándose una ligera diferencia en cuanto al tiempo de estabilización en los suelos SSE y SLC y los resultados en STY. En su investigación, Moreno y Conde, (2016) determinaron que las semillas de C. officinalis L. estabilizaron su curva de germinación en un tiempo mínimo de 50 días, lo que contrasta con lo obtenido en la presente investigación, donde se observó que la estabilización ocurrió cinco días antes (45 días), lo que se debe a las diferentes condiciones de los ensayos establecidas para la presente investigación, más favorables en comparación con los resultados de los autores citados.
Otro resultado que contrasta con el obtenido fue el de Campos et al., (2016), quienes obtuvieron tiempos de estabilización de germinación entre 23 y 29 días; sin embargo, los autores aplicaron tratamientos para acelerar la germinación, lo que es causa de las diferencias, ya que indujeron a que la mayoría de las semillas germinaran en menor tiempo. En todos los casos revisados, las semillas de C. officinalis L. fueron germinadas bajo condiciones controladas de laboratorio; en su mayoría sometidas a tratamientos de fertilización, por lo que la investigación realizada representa un aporte significativo y se logró la germinación bajo condiciones de invernadero y solo con condiciones ambientales que aseguraran su desarrollo.
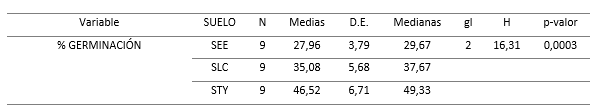
De acuerdo a las pruebas de normalidad realizadas (Shapiro-Wilks), donde se obtuvieron resultados de p-valor < 0,05, el crecimiento de las semillas no sigue una distribución normal, por lo que para la comparación de los resultados se realizó la prueba de varianza no paramétrica de Kruskal-Wallis. El análisis mostró que el porcentaje de germinación de las semillas se vio influenciado significativamente por el tipo de suelo con nivel de significancia de 0,05 (Tabla 3) y (Tabla 4).
Tabla 3 - Resultados del análisis de varianza de Kruskal-Wallis
Fuente: elaboración propia a partir de resultados de InfoStat
Los resultados estadísticos mostraron que existe dependencia entre el tipo de suelo y el porcentaje de germinación de las semillas de C. officinalis L. La germinación presentó diferencias significativas en los suelos utilizados en el estudio. La germinación en un suelo de textura franco-arenosa también fue estudiada por Suárez, (2018), quien obtuvo porcentajes de germinación de dos variedades de Cinchona entre 47,5 y 55,8 %, lo que es similar a lo obtenido en la presente investigación (Tabla 3).
En la Tabla 4, se observa que la germinación de semillas en los suelos presenta diferencias significativas (p-valor < 0,05), lo que se ve reflejado en la ubicación de cada tipo de suelo en grupos diferentes, según la letra correspondiente.
Tabla 4 - Resultados del análisis de rangos múltiples de Kruskal-Wallis
| Tratamiento | Rank | Grupo | ||
| SEE | 6,44 | A | ||
| SLC | 14,00 | B | ||
| STY | 21,56 | C | ||
Medias con una letra común no son significativamente diferentes (p > 0,05) Fuente: elaboración propia a partir de resultados de InfoStat
Lo anterior sugiere que las semillas de C. officinalis necesitan, además, de las condiciones climáticas adecuadas, suelos livianos, que presentan buen drenaje para germinar en mayor proporción. Lo anterior también fue observada por Méndez et al., (2009), quienes muestran que en suelo arenoso se obtiene un mayor porcentaje de germinación de semillas de Psidium guajava L. que, si bien no es la misma especie, demuestra que este tipo de suelo favorece la germinación. Los suelos de granos finos como los SSE y SLC, al retener agua pueden influir en la pudrición de las semillas, sobre todo al ser sembradas a voleo, porque las semillas están directamente expuestas al agua de riego. La influencia del tipo de sustrato en la germinación fue observado por Jiménez et al., (2018), quienes concluyeron que la influencia del sustrato en la germinación de semillas de Ochroma pyramidale fue estadísticamente significativa, lo que es consistente con lo obtenido en la presente investigación.
Se observa el resultado de textura del suelo a partir de un análisis granulométrico aplicando sedimentación (Sandoval et al., 2011) a cada una de las muestras (Tabla 5).
Tabla 5 - Textura de los suelos utilizados
| Suelo | Arena (%) | Limo (%) | Arcilla (%) | Clasificación |
| STY | 85 | 8 | 7 | Franco Arenoso |
| SLC | 20 | 70 | 10 | Limoso Franco |
| SSE | 21 | 12 | 67 | Arcilloso |
El suelo STY se clasifica como de textura gruesa (franco-arenoso) y los suelos SLC y SSE son de textura fina (Jaramillo, 2002). De lo anterior se infiere que las semillas de C. officinalis L. tienden a germinar en mayor cantidad en el suelo de textura gruesa; es decir suelos livianos con buen drenaje. Una de las razones de la menor germinación en los suelos de textura fina se debe a que, por ser suelos con mayor retención de agua (Ibáñez, 2006), causan la pudrición de las semillas, sobre todo en un microclima de alta humedad. Se muestran los resultados de los parámetros de germinación determinados para la interpretación de estos (Tabla 6).
Tabla 6 - Parámetros de germinación calculados
| Suelo | CV | T | IG | M |
| STY | 5,26 | 0,19 | 9,51 | 3,33 |
| SSE | 5,33 | 0,19 | 5,63 | 2,00 |
| SLC | 5,09 | 0,20 | 7,47 | 2,53 |
| Coeficiente de variación (%) | 2,36 | 2,99 | 25,75 | 25,56 |
Como se observa en la Tabla 6, los parámetros que muestran las mayores diferencias son el índice de germinación y la velocidad de germinación. Los coeficientes de velocidad y el tiempo de germinación no mostraron variaciones importantes, lo que se puede observar a través del coeficiente de variación de cada parámetro, donde la variabilidad de los valores fue menor a 5 % para el CV y T.
Los parámetros de germinación estudiados muestran que, en los tres suelos el coeficiente de velocidad de germinación y el tiempo de germinación de las semillas fueron estadísticamente similares, presentando un coeficiente de variación menor a 5 %. Los parámetros, índice y velocidad de germinación mostraron coeficientes de variación mayores a 5 %, por lo que se considera que estos parámetros se vieron influenciados por el tipo de suelo donde se sembraron las semillas. Los mayores índices y velocidades de germinación fueron para las semillas sembradas en STY, lo que corrobora lo observado anteriormente y demuestra que las semillas tienden a germinar en mayor proporción y con mayor velocidad en el suelo franco-arenoso proveniente del sector Tayabamba. Respecto a lo anterior, Gómez et al., (2016) concluyeron que es posible la reproducción de la especie; sin embargo, aclaran que el riego constante no sustituye las condiciones del bosque nublado, lo que influye en la germinación y que va a depender además de la calidad de las semillas, por lo que recomiendan reproducir las plantas en su hábitat, así como analizar la relación entre la germinación y el nivel de luz que reciben las semillas.
A partir de los resultados obtenidos, se demuestra que las semillas de C. officinalis L. pueden ser germinadas manteniendo las condiciones de temperatura ambiente alrededor de 23 ºC y en sistema cerrado por riego atomizado, para mantener la humedad cercana al 100 %.
El suelo del sector Tayabamba fue el de mejores propiedades para la germinación de las semillas, al obtenerse un porcentaje superior a los alcanzados en las otras muestras de suelo, con un nivel de significancia de 5 %.
El crecimiento de las plántulas al final de un período de 60 días fue satisfactorio, llegando a tener una tasa de crecimiento diario superior a las de otras investigaciones revisadas, con una curva de germinación que se estabiliza a los 45 días y una mayor germinación a los 13 días en todas las muestras de suelo.
Se debe continuar investigando sobre la germinación y el crecimiento de la C. officinalis L. fuera de su hábitat natural y bajo condiciones de invernadero, con la finalidad de lograr un sistema de reproducción que permita obtener plántulas que puedan ser utilizadas para la repoblación de las zonas en las que ha desaparecido.











 texto en
texto en