Introducción
Cinchona officinalisL., conocida como árbol de quina o cascarilla, pertenece a la familia Rubiaceae, originaria de la zona Andina suramericana y distribuida desde Bolivia, Perú, Ecuador, Colombia y Venezuela (Gómezet al., 2016; Barrutia et al., 2020). Es una planta medicinal, que ha sido utilizado en tratamientos de la malaria o paludismo salvando muchas vidas humanas a nivel mundial (Álvarez, 2013).
En el Perú, la quina es considerado un símbolo nacional, así mismo aparece en el escudo nacional (Álvarez, 2013), sin embargo, existe un gran desconocimiento por parte de la población acerca del nivel de riesgo del mismo, ya que con la necesidad de desarrollar una agricultura y/o ganadería, deforestan grandes cantidades de bosques naturales, dentro de ellos plantas de quina (Castañeda et al., 2019).
Según información de medios periodísticos, dentro del género Chinchona en el Perú existen 19 especies, los cuales aún no se encuentran registrados en su totalidad en inventarios nacionales (RPP, 2017). En la región Amazonas, se pueden encontrar algunas poblaciones de C. officinalis, principalmente en las provincias de Luya (San Jerónimo), Condorcanqui, Bagua, Rodríguez de Mendoza, Bongará (Progreso, Yambrasbamba) (Castañeda et al., 2019), situados generalmente en bosques nubosos (Carguay-Yaguana et al., 2016).
El problema principal en la especie (quina), es la propagación, si bien la semilla botánica es una alternativa estas han reportado bajas tasas de germinación (Buddenhagen et al., 2004). No obstante, existe otro método de propagación más rápido y sencillo, la asexual mediante la utilización de tejidos vegetales (Osuna et al. 2016). Al respecto, Conde et al., (2017) obtuvieron resultados exitosos mediante el enraizamiento de brotes juveniles de quina (mayores al 90 %) con aplicaciones de auxinas.
En base a lo descrito y con el fin de encontrar una metodología eficiente, para la propagación, el presente trabajo pretende evaluar la influencia de sustratos y concentraciones de AIB en la propagación vegetativa de C. officinalis L. (quina) en Amazonas, Perú.
Materiales y métodos
Ubicación de la investigación
Fase de campo
Las plantas madres fueron seleccionados en el área protegida del bosque de neblina en el distrito San Jerónimo-Perú, con coordenadas latitud 5° 59' 59,2" Sur, y longitud 72° 01' 14" Oeste, a una altitud 2 616 m.s.n.m.
En campo se tomaron muestras de hojas, flores, frutos y semillas, las mismas que fueron caracterizados y contrastados dendrométricamente siguiendo la metodología de Huamán et al., (2019). Las muestras de quina procedentes de San Jerónimo se conservaron en el herbario del Laboratorio de Dendrología en la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas.
Fase de vivero
El proceso de enraizamiento se realizó en el centro experimental de la Universidad Nacional Toribio Rodríguez de Mendoza, en los ambientes de vivero construidos por el Instituto de Investigaciones de la Amazonia Peruana localizado a 6° 25' 39" latitud Sur y a 77° 32' 13" longitud Oeste a una altitud 1 714 m.s.n.m.
Selección y colecta del material vegetal
Se seleccionaron 10 árboles plus de 8 a 10 metros de altura con DAP de 25 cm. Con ayuda de una tijera telescópica, se cortaron ramas ortotrópicas juveniles. Para garantizar el éxito en el enraizado Danaxa et al., (2012) sugieren colectar material de tejido juvenil ya que estas responden mejor a los reguladores de crecimiento. Los brotes colectados fueron envueltos en papel craft, se codificaron y colocaron en una caja de tecnopor, previamente humedecidas para mantener las ramas turgentes (Vásquez et al., 2018), durante el traslado al centro experimental.
Instalación del experimento
En el centro experimental, se construyó una cámara de subirrigación con dimensiones de 3,60 x 1,20 x 0,90 m, de largo, ancho y altura respectivamente, se acondicionó un sistema de riego automatizado, para regular la temperatura entre 18 y 30 °C y humedad relativa mayor al 80 %. Se programó un riego por día por un minuto.
En laboratorio se desinfectaron los brotes con fungicida Propineb 70 % PM, a concentración 3 g.L-1 de agua, dejando los brotes en la solución por tres minutos (Inuma et al., 2018).
El material vegetal desinfectado se cortó uniformemente a 7 cm, dejando un par de hojas cortadas al 50 % del área foliar, en la base de la estaca se realizó un corte en bisel. Para el tratamiento con auxina, se tuvo en cuenta, al momento del corte de la base del brote, se retiró el exceso de savia que emanaban con un papel toalla por 60 segundos. Se colocaron en solución de AIB a diferentes concentraciones, diluido en alcohol 90° por 20 segundos (Torres et al., 2014). Se dejaron los brotes sobre papel por diez minutos a una temperatura de 20°C, para la absorción de la auxina. Se utilizó sustratos, arena 100 %, arena 50 % + turba 50 % y turba 100 %, se desinfectaron, y depositaron en bandejas de polietileno de 40 x 30 x 10 cm.
Diseño experimental
El experimento se instaló bajo un diseño completo al azar con arreglo factorial de 3A x 4B, dando 12 tratamientos, 3 repeticiones y 36 unidades experimentales (Tabla 1).
Tabla 1 - Descripción de factores y tratamientos aplicados a C. officinalis
| Tratamiento | Factor A: sustratos | Factor B: concentraciones de AIB (g.L-1) | Interacción de A x B |
|---|---|---|---|
| T1 | arena | 0 | arena-0 |
| T2 | arena | 1 | arena-1 |
| T3 | arena | 2 | arena-2 |
| T4 | arena | 3 | arena-3 |
| T5 | arena 50 % + turba 50 % | 0 | arena 50 % +turba 50 %-0 |
| T6 | arena 50 % + turba 50 % | 1 | arena 50 % +turba 50 %-1 |
| T7 | arena 50 % + turba 50 % | 2 | arena 50 % +turba 50 %-2 |
| T8 | arena 50 % + turba 50 % | 3 | arena 50 % +turba 50 %-3 |
| T9 | Turba | 0 | Turba-0 |
| T10 | Turba | 1 | Turba-1 |
| T11 | Turba | 2 | Turba-2 |
| T12 | Turba | 3 | Turba-3 |
Evaluación de variables
Sobrevivencia de ramas juveniles: se contabilizaron ramas vivas a los 60 días, luego fueron pasados a un formato digital Excel para transformarlos a porcentaje, dividiendo el número de ramas vivas, entre el total y multiplicados por 100.
Porcentaje de enraizamiento: se contabilizó brotes con presencia de raíces, con un tamaño mayor de 0,5 cm (Vásquez, et al., 2018). Luego estos fueron transformados a porcentaje dividiendo el número total de ramas enraizados sobre el total y multiplicado por 100.
Número de raíces: se contabilizaron las raíces, con tamaño mayor o igual a 0,5 cm (Vásquez et al., 2018).
Tamaño de raíces: las raíces fueron medidas con un vernier digital en mm, luego se transformó a cm, finalmente fueron promediados por repetición.
Análisis estadístico
Previo al análisis de varianza, las variables en porcentaje, sobrevivencia (Y) y enraizamiento (Y) se transformó con la función T= arcoseno (√ Y ). Así mismo el número de raíces (Y) se transformó con la función logaritmo, [T = log10 (Y)], finalmente los valores promedios se retransformaron a las unidades originales, con la función [Y = 100 sen 2 (T)], para variables en porcentaje y con la función Y [Y = 10 T ] para la variable número de raíces (Muñoz et al., 2009).
Se realizó el ANOVA con modelo para un factorial y comparación múltiple Tukey (α=0,05) para la sobrevivencia, así mimo para las variables porcentaje de enraizamiento, número y tamaño de raíces se realizó la prueba no paramétrica de Friedman y el Post-Hoc de Wilcoxon, para determinar la influencia de los sustratos y concentraciones de AIB. Para el procesamiento de datos se utilizó el software estadístico InfoStat versión 2019.
Resultados y discusión
Según el análisis de varianza para la sobrevivencia de ramas de C. officinalis evaluados a 60 días, se observó que existe diferencia significativa, entre los sustratos y concentraciones de AIB, actuando de forma individual e interaccionada (Tabla 2).
Tabla 2 - Análisis de varianza (P< 0,05) para la sobrevivencia de ramas juveniles
| Fuente de variación | SC | gl | CM | F | |
|---|---|---|---|---|---|
| Sustrato | 4990,89 | 2 | 2495,44 | 120,75 | 0,0000** |
| Dosis de AIB | 675,00 | 3 | 225,00 | 10,89 | 0,0001** |
| Sustrato*Dosis de AIB | 2146,00 | 6 | 357,67 | 17,31 | 0,0000** |
| Error | 496,00 | 24 | 20,67 | ||
| Total | 8307,89 | 35 |
**=significación; SC: suma de cuadrados; gl: grados de libertad; CM: cuadrados medios; F: factor
Tabla 3 - Test de Tukey (α=0,05) para la sobrevivencia de estaquillas de quina, influenciados por tipo de sustratos y concentraciones de AIB
| Fuente de variación | Sobrevivencia (%) |
|---|---|
| Sustrato | |
| Arena | 58,67 a |
| Arena + turba | 49,17 b |
| Turba | 30,33 c |
| concentraciones de AIB g.L-1 | |
| 0 | 50,89 a |
| 1 | 48,89 ab |
| 2 | 44,89 bc |
| 3 | 39,56 c |
| Sustratos*concentraciones de AIB g.L-1 | |
| Arena-0 | 77,67 a |
| Arena + turba-1 | 60,00 b |
| Arena-1 | 57,67 bc |
| Arena + turba-2 | 57,00bc |
| Arena-2 | 53,67 bcd |
| Arena-3 | 45,67 cde |
| Arena + turba-0 | 43,00 def |
| Arena + turba-3 | 36,67 efg |
| Turba-0 | 32,00 fg |
| Turba-2 | 32,00 fg |
| Turba-1 | 29,00 g |
| Turba-3 | 28,33 g |
Se encontró que el sustrato arena fue superior respecto a los demás (Tabla 3), mostrando un porcentaje de brotes vivos de 58,67 %, el segundo sustrato fue la mezcla turba + arena con 49,17 %. Así mismo, se encontró que el sustrato turba presentó una alta mortalidad sobrepasando el 50 % de estaquillas tratadas. Es sabido que brotes tiernos y suculentos, en su mayoría mueren por pudriciones, básicamente influenciados por los sustratos, ya que algunos de ellos presentan características como baja porosidad, lo que generan sobresaturación de agua, por ende reduce la respiración de las mismas y crean ambientes favorables para la proliferación de algunos patógenos (Mesén, 1998), dicha afirmación refuerza lo encontrado respecto a la alta sobrevivencia de estaquillas en arena (alta porosidad) y baja sobrevivencia en turba (baja porosidad).
Se encontró que las estaquillas sobrevivieron mejor, cuando menor era la concentración de AIB, tal es así que las estacas sin auxinas sobrevivieron hasta un 50,89 %; concentraciones de 2 y 3 g.L-1 reportaron mayor porcentaje de mortalidad, probablemente por toxicidad (Inuma et al., 2018).
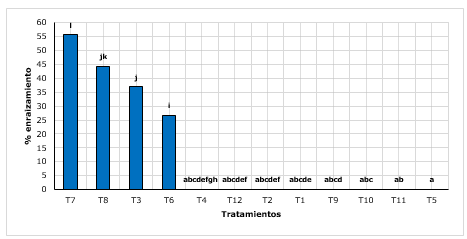
El tratamiento T7 (arena + turba con 2 g.L-1 de AIB), presentó un enraizado de 55,67 %, mostrando superioridad que el T8 (arena + turba con g.L-1 de AIB) con 44,33 %. Así mismo los demás tratamientos en su mayoría no emitieron raíces (Figura 1).
Villar et al., (2018), mencionan que la quina es una especie difícil de enraizar, debido al contenido de quinina, alcaloide que probablemente inhibe la formación de raíces. Por su parte, en otra investigación, Conde et al., (2017), contradice dicha afirmación, ya que encontraron resultados exitosos en el enraizamiento de quina mediante brotes juveniles aclimatados en vivero. Mencionan de hasta un 88,33 % a 96,67 % de enraizado, con y sin tratamientos auxínicos, por lo que exponen que no necesariamente dependen de los tipos de enraizadores, sino del manejo y mantenimiento que se les dé a los brotes durante el proceso en invernadero. Si bien es cierto los resultados reportados, se muestran superiores a lo encontrado en la presente investigación, sin embrago, dicha diferencia estaría afectado quizás por la procedencia del material vegetal, ya que se trabajaron con estaquillas colectados directamente de campo.
Para el enraizado de estaquillas, se encontró que el tratamiento con combinación arena y turba mostraron resultados superiores (55,67 %), respecto a los otros tratamientos. Así mismo, se observó en su mayoría que los tratamientos con contenidos de turba y concentraciones medias y bajas de AIB reportaron 0 % de enraizamiento. Hartmann y Kester (1987), mencionan que los sustratos presentan efectos significativos en el enraizado de plantas, variando estos según el material vegetal y la especie, resaltando además que el mejor sustrato es turba, y si se combina con arena en diferentes proporciones, ésta se repotencia su actividad.
La concentración 2 g.L-1 de AIB sobresalió en el enraizado (55,67 %), seguido por la concentración 3 g.L-1 (44,33 %); al respecto, (Hartmann y Kester, 1987; Vásquez, et al., 2018), mencionan que existe efectos positivos de las auxinas en el enraizamiento, ya que estimulan la división celular, aumenta el transporte de carbohidratos y otros cofactores foliares a los sitios de aplicación, así como a la estimulación en la síntesis de ADN en las células tratadas. Aunque, la sensibilidad de las células varía entre especies, dependiendo de un conjunto de factores intrínsecos (Norberto et al., 2001).
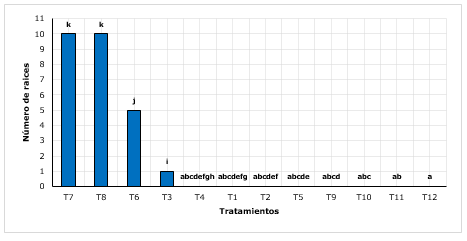
Para el número de raíces, se encontró que el tratamiento T7 (arena+ turba con 2 g.L-1 de AIB) y el T8 (arena + turba con 3 g.L-1 de AIB) obtuvieron el mayor número de raíces (10), superior a los demás tratamientos (Figura 2). Conde et al., (2017), menciona cuando se trabajan con brotes juveniles, incrementa la capacidad enraizativa, tal es así que, reportaron hasta 7 raíces, en promedio por brote. En otro estudio, Castañeda et al., (2019), encontraron un total de 4 raíces, siendo relativamente bajos comparado a lo encontrado, sin embargo, dichos resultados fueron encontrados en enraizamientos de quina mediante estacas lignificadas. Del mismo modo, reportaron que el sustrato sobresaliente en la formación de raíces, fue el sustrato (35 % hojarasca+35 % de franco arenoso+20 % tierra orgánica y 10 % arena).
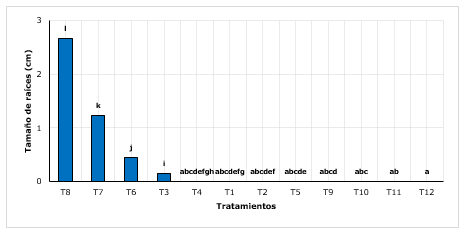
Respecto a la longitud de raíces, se encontró que el T8 (arena+ turba con 3 g.L-1 de AIB) lograron incrementar en promedio máximo a 2,66 cm, siendo superior al T7, T6 y demás tratamientos que en su mayoría no presentaron raíces (Figura 3). Es evidente que los sustratos influyen significativamente en el desarrollo radicular (Castañeda et al., 2019), raíces con tamaños de hasta 4 cm, influenciados por el sustrato (35 % hojarasca + 35 % de franco arenoso + 20 % tierra orgánica y 10 % arena).
Otro factor importante es el material vegetal que en función a su edad tienen capacidad de formar y desarrollar raíces, ya que el tejido juvenil responde mejor a los reguladores de crecimiento que el de células viejas y totalmente diferenciadas, probablemente porque las zonas del genoma que controlan la formación de órganos están menos reprimidas y pueden desbloquearse con los tratamientos con auxinas (Denaxa et al., 2012).
Por su parte, Conde et al., (2017) menciona que los mejores resultados de enraizamiento en quina, lo obtuvieron con brotes juveniles, los cuales generaban raíces con longitudes de 3,23 cm como promedio, siendo superior a lo encontrado en este estudio.
De esta forma, es posible además propagar árboles superiores de la especie asociados o no a un programa de mejoramiento arbóreo y facilitar los programas de rescate y conservación de especies (Figura 4).

Fig. 4 - A Árbol plus de quina, en el bosque de neblina San Jerónimo-Perú; B- estaquilla con formación de callo a 15 días; C- estaquilla de quina enraizado a 60 días
La propagación vegetativa de quina se realizó a partir de ramas ortotrópicas juveniles en cámara de subirrigación, presentó alto porcentaje de sobrevivencia con el sustrato arena, no obstante, para el enraizamiento, número y longitud de raíces, el sustrato sobresaliente fue arena + turba, con concentraciones de 2 y 3 g.L-1 de AIB.











 texto en
texto en