Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.90 no.3 Ciudad de la Habana jul.-set. 2018
ARTÍCULO DE REVISIÓN
El síndrome de intestino irritable como causa de dolor abdominal crónico
Irritable bowel syndrome as a cause of chronic abdominal pain
Trini Fragoso Arbelo, Rebeca Milán Pavón
Servicio de Gastroenterología y Nutrición. Hospital Pediátrico Universitario "Borrás-Marfan". Facultad de Ciencias Médicas "Manuel Fajardo". Universidad Médica de La Habana. La Habana, Cuba.
RESUMEN
Introducción: los trastornos funcionales gastrointestinales son motivo de consulta frecuente en Gastroenterología, y presentan un serio problema social y en la dinámica familiar. El síndrome de intestino irritable en la población pediátrica es poco diagnosticado, y el dolor abdominal crónico es motivo de consulta frecuente en la infancia y adolescencia.
Objetivo: analizar los aspectos más actuales en su diagnóstico y tratamiento, y su relación con el dolor abdominal crónico.
Métodos: se revisaron las bases documentales de PubMed, Scielo y Latindex y el Registro Especializado del Grupo Cochrane de datos relacionados con el síndrome de intestino irritable hasta diciembre de 2017, así como las guías de tratamiento postuladas por distintas organizaciones médicas, basadas en los criterios de Roma y de la Medicina Basada en la Evidencia.
Desarrollo: se realizó una revisión del tema referido a la infancia, y se incluyeron concepto y patogénesis más aceptadas, así como los criterios de Roma establecidos para el diagnóstico. Se hizo énfasis en la etiología, diagnóstico clínico y pruebas diagnósticas. Se analizaron algunos aspectos del tratamiento.
Conclusiones: el síndrome de intestino irritable es relativamente frecuente como causa de dolor abdominal crónico funcional, y el interrogatorio dirigido según los criterios de Roma es útil para su diagnóstico. La mayoría de los pacientes con síndrome de intestino irritable en la infancia deben ser atendidos en la atención primaria.
Palabras clave: trastornos funcionales gastrointestinales; síndrome de intestino irritable; dolor abdominal crónico; diarrea; estreñimiento; criterios de Roma.
ABSTRACT
Introduction: gastrointestinal functional disorders are a frequent reason for consultation in Gastroenterology services, and represent a serious social problem and in family dynamics. Irritable bowel syndrome in the pediatric population is poorly diagnosed, and chronic abdominal pain is a frequent reason for consultation in childhood and adolescence.
Objective: to analyze the ultimate aspects in its diagnosis and treatment, and its relation with chronic abdominal pain.
Methods: PubMed, Scielo and Latindex documentary databases and the Cochrane Specialized Register of data related to irritable bowel syndrome until December 2017 were revised, as well as the treatment guidelines presented by different medical organizations based on the criteria of Rome and of Evidence-Based Medicine.
Development: a review of the subject referring to childhood was carried out, and the most accepted concept and pathogenesis were included, as well as Rome criteria established for the diagnosis. Etiology, clinical diagnosis and diagnostic tests were emphasized. Some aspects of the treatment were analyzed.
Conclusions: Irritable bowel syndrome is relatively common as a cause of chronic functional abdominal pain, and questioning conducted according to Rome criteria is useful for diagnosis. The majority of patients with irritable bowel syndrome in childhood should be treated in the primary care level.
Keywords: gastrointestinal functional disorders; irritable bowel syndrome; chronic abdominal pain; diarrhea; constipation; Rome criteria.
INTRODUCCIÓN
El dolor abdominal crónico (DAC) es un motivo de consulta muy frecuente, constituye del 2 al 4 % de las visitas al pediatra de Atención Primaria (AP) y hasta el 50 % al gastroenterólogo pediátrico.1,2 El síndrome de intestino irritable (SII) se caracteriza por DAC, de localización en hemiabdomen inferior, y alteraciones en la defecación. Es un trastorno funcional intestinal en el que el dolor abdominal crónico está relacionado con la defecación o un cambio en los hábitos del intestino. Los desórdenes en el hábito intestinal son típicos, y están presentes la diarrea, el estreñimiento, o mixto con diarrea y estreñimiento alternante, y se añade flatulencia y distensión abdominal.
El SII es uno de los trastornos funcionales gastrointestinales (TFGI) más comunes en adolescentes, representa el 3 % de los motivos de consulta en los cuidados primarios, con predominio importante en el sexo femenino; entre el 10 y el 20 % de los adolescentes tienen síntomas consistentes con este síndrome, y aunque se plantea en la literatura científica su mayor frecuencia en los países industrializados, este trastorno aparece igualmente en el tercer mundo.3,4 Estudios en distintas latitudes, como Colombia y Sri Lanka, han reportado prevalencias entre 4,9 y 5,4 %, respectivamente, y en Estados Unidos, según información de los padres, se reporta entre 1,2 a 2,9 %.4,5
La prevalencia mundial es de 11,2 %, con intervalo entre 9,8-12,8 %, basado en un meta-análisis de 80 estudios que involucran 260 960 pacientes. La incidencia se estima en 1,35 % y 1,5 %, basado en 2 estudios longitudinales de la población entre 10 y 12 años. Tiene predominio en el sexo femenino, y los jóvenes son los más afectados. El SII es descrito como el más frecuente (8,8 %) de los trastornos gastrointestinales de la infancia. La prevalencia entre los distintos estudios varía ampliamente.6
Por el uso de la práctica clínica diaria y con los avances de investigaciones empíricas, en 1999 se definieron los criterios de ROMA II para los TFGI pediátricos, basados en síntomas según la edad: vómitos, dolor abdominal, diarrea funcional y trastornos de la defecación.7 En el 2006, se definen los criterios de ROMA III y se mantienen los mismos según el síntoma predominante, pero en 2 categorías: lactantes-preescolares y en escolares-adolescentes. En 2006 se describió un consenso sobre los TFGI en la edad pediátrica. En ese momento, se disponía de poca evidencia sobre epidemiología, fisiopatología, diagnóstico, estrategias de tratamiento y seguimiento. En consecuencia, los criterios para las entidades clínicas se basaron más en la experiencia que en la evidencia. En la última década, se han obtenido nuevos conocimientos sobre los diferentes TFGI en estos grupos de edades, y sobre la base de ellos, se han realizado nuevas revisiones a los criterios. En 2016 en ROMA IV hubo consenso basado en la experiencia clínica y en una revisión de la literatura científica para el grupo de edad de 4-18 años; los cambios realizados, como aspectos relevantes respecto a los criterios previos, destacan la participación de la AP y la consideración multidimensional, no solo clínica, sino también psicosocial del problema, fundamentados en la evidencia disponible. Estos criterios se convirtieron en una herramienta de utilidad en la investigación y en la asistencia, para evitar estudios innecesarios y permitir un tratamiento integral del paciente.8-10
El término "disconfort" fue removido de Roma III, por no estar claro si la distinción entre disconfort o incomodidad y dolor, es cuantitativo o cualitativo.
La caracterización de los TFGI de la infancia y la adolescencia ha evolucionado durante un largo proceso de dos décadas, que ahora culmina en Roma IV. La era del diagnóstico de un TFGI solo cuando se ha excluido la enfermedad orgánica está disminuyendo, ya que actualmente hay evidencias para apoyar el diagnóstico basado en los síntomas. En Roma, en el grupo escolar-adolescente, se amplía este concepto eliminando el criterio de que "no hay evidencia de enfermedad orgánica" en todas las definiciones, reemplazándolo por "después de una evaluación médica adecuada, los síntomas no pueden atribuirse a otra condición médica". Este cambio permite al clínico realizar pruebas selectivas -o ninguna- para apoyar un diagnóstico positivo de un TFGI, conociendo que pueden coexistir con otras afecciones médicas, que a su vez, provocan síntomas gastrointestinales como la enfermedad inflamatoria del intestino.11
Los criterios diagnósticos basados en Roma IV se señalan a continuación, y deben incluir todos los criterios siguientes al menos 2 meses antes del diagnóstico:
1. Dolor abdominal al menos 4 días al mes, asociado con uno o más de los siguientes:
a) Relacionado con la defecación.
b) Cambio en la frecuencia de las deposiciones.
c) Cambio en la forma/apariencia de las deposiciones.
2. En niños con estreñimiento, el dolor no se resuelve con la resolución del estreñimiento.
3. Los síntomas no se pueden atribuir a otra enfermedad, después de una evaluación médica adecuada.
La diferencia entre estreñimiento funcional y SII ha sido aclarada, debido a que el 75 % de los niños con estreñimiento funcional presentan dolor, y si el niño no resuelve el dolor con un tratamiento apropiado, es que tiene un SII con estreñimiento, por lo que se recomienda tratamiento para el estreñimiento funcional, y si el dolor persiste, a pesar de resolver el estreñimiento, se trata de un SII con estreñimiento, y si el dolor desaparece el diagnóstico es estreñimiento funcional.12 Los siguientes síntomas acumulativos apoyan el diagnóstico:
- Frecuencia anormal de las heces: más de 3 movimientos intestinales por día, o menos de 3 movimientos por semana.
- Forma anormal de las heces: escíbalos/dura o amorfas/acuosas (escala de Bristol).
- Pasaje anormal de las heces: esfuerzo, urgencia o sensación de evacuación incompleta, deposición de mucus, plenitud, o sensación de distensión abdominal.
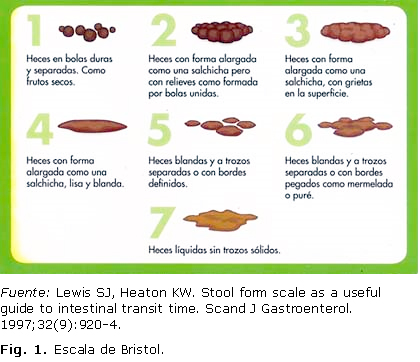
En los criterios de Roma IV el SII se incluye igual que en el adulto, según el patrón defecatorio predominante.9,11,12 Se señalan 4 subtipos de este trastorno funcional, y se recomienda utilizar la escala de Bristol como una guía útil para medir el tiempo de tránsito intestinal (figura 1). La escala de heces de Bristol -o gráfico de heces de Bristol- es una tabla visual de uso en Medicina, destinada a clasificar la forma de las heces humanas en 7 grupos. Fue desarrollada por Heaton y Lewis en la Universidad de Bristol, y se publicó por primera vez en la Revista Escandinava de Gastroenterología en 1997.13
- SII-diarrea: más del 25 % de movimientos del intestino con heces tipo 6 y 7 de la escala, y menos de 25 % de los movimientos del intestino con heces de tipo 1 o 2.
- SII-estreñimiento (SII-E): más del 25 % de movimientos del intestino con heces del tipo 6 o 7, y menos de 25 % de los movimientos del intestino heces del tipo 1 o 2.
- SII-mixto: más del 25 % de movimientos del intestino con heces de tipo 1 o 2, y más de 25 % de los movimientos del intestino con heces del tipo 6 o 7.
- SII-inespecífico: pacientes que reúnen el criterio diagnóstico de SII, pero cuyos hábitos intestinales no pueden ser con precisión categorizados en 1 de los 3 grupos ya señalados, por lo que deben determinarse como SII no clasificado.
El objetivo de esta puesta al día es analizar los aspectos más actuales en su diagnóstico y tratamiento, y su relación con el DAC.
MÉTODOS
Se revisaron las bases documentales de PubMed, Scielo y Latindex y el Registro Especializado del Grupo Cochrane de Datos relacionadas con el SII hasta diciembre de 2017, así como las guías de tratamiento postuladas por distintas organizaciones médicas, basadas en los criterios de Roma y de la Medicina Basada en la Evidencia. Se revisaron los artículos redactados en los idiomas español e inglés.
DESARROLLO
Patogenia
El SII se considera un trastorno del eje cerebro-intestino, es una enfermedad de complejo origen multifactorial, y los cambios en el comportamiento del músculo liso intestinal constituyen la característica central; sin embargo, esta motilidad anormal del músculo liso intestinal no es la explicación fundamental de todos los síntomas, los cuales están determinados por múltiples factores, que incluyen: disturbios de la motilidad, hipersensibilidad visceral, inflamación y disfunción inmune de la mucosa, disfunción del eje cerebro-intestino y factores psicosociales de la infancia.8,9,11,14-16 La hipersensibilidad visceral puede estar relacionada con la angustia psicológica del niño (ansiedad, depresión, impulsividad, ira).
Existen evidencias de que uno de los signos esenciales que presenta este trastorno es la hiperalgesia intestinal (hipersensibilidad), concordante con el dolor. Algunos niños con SII tienen hiperalgesia rectal, pero no gástrica, contrariamente a los pacientes con dolor abdominal funcional no especificado (en inglés FAP-NOS).16 Se ha identificado un recorrido serotoninérgico intenso involucrando los receptores 5-HT3 en el sistema nervioso intrínseco; estos receptores se consideran claves en la percepción del dolor abdominal y en la regulación de la motilidad gastrointestinal, lo que llevará a nuevos objetivos de tratamiento.
Ha sido demostrado un aumento de citokinas proinflamatorias en la mucosa intestinal y pueden ser inducidas como consecuencia de una gastroenteritis aguda, y es el llamado SII posinfeccioso; alteraciones del microbioma intestinal también han sido demostradas, aunque no se sabe si estos cambios son causa o resultados del SII y sus síntomas.9,14,17-19 Cualquier evento ha sido asociado como el detonante, por ejemplo cirugía, con alto riesgo de desarrollar trastornos funcionales de dolor abdominal, incluyendo SII.2,20-22
Ampliamente conocido e investigado, múltiples estudios epidemiológicos del SII en diferentes países arrojan una prevalencia y factores de riesgo sugerentes de una presencia bastante común entre adolescentes.4-6,9 De un total de 194 niños con TFGI, Mieli23 reporta 27 (13,9 %) con SII (media 5,0 ± 3,3 años, sexo M/F=12/15). Estos niños presentaban historia de dolor abdominal bajo de 8 ± 5 meses de duración, asociado a cambios en la frecuencia o forma de las heces, y aliviado por la defecación. Se demostró historia familiar en el 41 % (6 madres y 5 padres). El dolor abdominal fue severo, provocó ausencias escolares, y en 5 casos (18,5 %), la necesidad de acudir al servicio de urgencias. Fueron tratados con modificaciones dietéticas: incremento en fibra en los que predominaba el estreñimiento y eliminación de líquidos con alto contenido en fructosa en los que presentaron la diarrea; 12 (44 %) fueron tratados con antiespasmódicos (trimebutina a dosis de 1 mg/kg 3 veces al día por 4 semanas). En el seguimiento, la mayoría de los pacientes tuvieron una evolución satisfactoria. Los autores explican la baja prevalencia en esta población, por los pocos pacientes adolescentes en la muestra.
Walker,24 en Estados Unidos, planteó la hipótesis de que la mayoría de los niños con dolor abdominal recurrente pueden ser clasificados en uno o más de los subtipos definidos por los criterios de Roma; en su estudio, el 44,9 % cumplió los criterios de SII. En Moscú, un estudio de Reshetnikov25 en estudiantes entre 14 y 17 años de edad, informó una prevalencia de 14 a 24 % de SII, de los cuales el 24 % había sido atendido en diferentes hospitales.
Según Dong,26 el SII fue un trastorno común entre adolescentes y niños en China, aunque estadísticamente diferente según las áreas geográficas. La prevalencia fue de 13,25 %; la mayor prevalencia fue 14,02 % en la provincia de Heilongjiang, seguida de 11,72 % en Shanghai. La relación hombre/mujer fue de 1:1,8. Este estudio indica que el SII en adolescentes y niños pudiera tener relación con factores psicológicos, hábitos alimentarios, medio ambiente y condiciones familiares inadecuadas.
Caplan, en Canadá,27 en su estudio de validación de los criterios de Roma según los TFGI en 315 pacientes de 4 a 18 años de edad que fueron remitidos a gastroenterólogos en cuidados terciarios con un diagnóstico de trastorno funcional sospechado, encontró el SII como el trastorno funcional más prevalente, que representó el 22 % de los TFGI de los 4 a 9 años y el 35,5 % de los 10 a 18 años.
En nuestro estudio,28 en Cuba, de 2 años de duración y realizado en un servicio ambulatorio de Gastroenterología, consideramos 227 pacientes menores de 17 años con TFGI según los criterios de Roma II. Se diagnosticaron 19 con síndrome de vómitos cíclicos (8,4 %), de entre 2 y 10 años (media 5 años), el 57,9 % del sexo femenino, asociado a migraña en 6 (31,5 %) y a SII en 2 (10,5 %), y 32 con SII (14,09 %), de entre 5 y 15 años (promedio 9,5 años), 53,2 % femeninos.
En otro estudio cubano29 se reporta, según los criterios de Roma II: con dolor abdominal crónico 90 pacientes (entre 5-16 años, media 10 años). Predominó la dispepsia funcional en 31 (34,5 %, entre 6,5-16 años, media 12 años), el 64,5 % era del sexo masculino, 5 tenían antecedentes familiares de úlcera péptica (16,1 %), acidez 22 (70,9 %), y 5 con signos de SII asociados (16,1 %). Con SII hubo 32 (35,6 %, entre 5-15 años, media 9,5 años) y 53,2 % del sexo femenino. Sin antecedentes familiares de enfermedad inflamatoria intestinal, presentaban diarreas 24 (75 %) y 15 (46,8%) estreñimiento. Se pudo observar que el SII se asocia con frecuencia a otras patologías funcionales, como también reportan otros autores.1,9,23-27
El inicio de los síntomas del SII y otros síntomas funcionales gastrointestinales relacionados, frecuentemente datan de la infancia. La prevalencia estimada de SII en niños es similar a la de los adultos.23,28-33
Diagnóstico
El diagnóstico se apoya en un examen físico y crecimiento normales. Durante las visitas iniciales se debe precisar la historia psicosocial del niño y la familia, porque es necesario establecer una historia nutricional, si hay una ingesta adecuada de fibra en los estreñidos, o una ingestión de azúcares como el sorbitol y fructosa en los diarreicos. La gastroenteritis bacteriana puede estar seguida del desarrollo de un SII en 5-10 % de los pacientes, dependiendo de la severidad del episodio inicial y del estado previo de ansiedad o depresión.17,18,32-35 Debe interrogarse también sobre la dinámica familiar, ya que hay estudios en los que se ha demostrado que pacientes adultos con esta enfermedad refieren antecedentes de abuso infantil (físico, emocional y sexual).20,22
Para completar el diagnóstico puede incluirse: hemograma, eritrosedimentación, estudios parasitológicos y bacteriológicos de las heces, sangre oculta y calprotectina en heces, prueba de hidrógeno espirado para Helicobacter pylori, y dieta libre de leche para excluir la malabsorción de lactosa.35-37
Se precisa estar alerta ante signos de alarma de enfermedad, como son, dolor o diarrea nocturnos, pérdida de peso, hemorragia rectal, fiebre, artritis, pubertad retardada, historia familiar de enfermedad inflamatoria intestinal, o enfermedad celíaca. El SII puede ocurrir conjuntamente con enfermedad inflamatoria intestinal y con sensibilidad al gluten no celíaca.9,10,36
La calprotectina fecal es en 60 % del total de la fracción proteica citosólica en los granulocitos neutrófilos y los macrófagos; es un marcador no invasivo directo de inflamación, es superior que la proteína C reactiva, y la eritrosedimentación es útil para discriminar entre enfermedad inflamatoria intestinal y SII, que se debeutilizar cuando hay signos de alarma.9,37,38
En pacientes con síntomas intratables, se debe realizar colonoscopia con biopsia. Si el íleon terminal no es explorado, se debe realizar estudio radiológico de intestino delgado o scan de leucocitos con tecnecio.9
Tratamiento
La regla de oro en el tratamiento es asegurar la mejoría de los síntomas. La presencia y severidad del dolor debe ser reconocido. Es necesario educar y asegurar al niño y a la familia, que aunque causa molestias, el SII no es una enfermedad seria, y explicar que el efecto del stress y la ansiedad pueden exacerbar el dolor, lo que ayuda a comprender al niño y a la familia el por qué ocurre este.20-22,34,35
Dificultades psicosociales y eventos detonantes pueden ser identificados y tratados. La calidad de vida se torna baja, y varios estudios lo han demostrado, basándose en la percepción del paciente y los padres, valorando la enfermedad con una connotación biopsicosocial importante.20-22 Di Lorenzo y otros1 informaron las intervenciones más beneficiosas en el SII, de acuerdo con el reporte del subcomité de dolor abdominal crónico: dieta libre de lactosa (5 %), suplementación con fibra (40 %) y aceite de hierbabuena (cápsulas de aceite de menta) en 65 %. Hay evidencias de que el tratamiento con aceite de hierbabuena por 2 semanas puede beneficiar a los niños con SII.9
En algunos pacientes el sorbitol, las grasas, el alcohol, el trigo, los frutos secos o los lácteos, pueden exacerbar la sintomatología del SII, aunque las dietas con exclusión de estos alimentos no han mostrado resultados concluyentes.
El tratamiento con antidepresivos tricíclicos (ADT) puede reducir los síntomas y mejorar la calidad de vida en adolescentes con SII. Algunos pacientes responden a la dieta sin lactosa, o a dietas ricas en fibra vegetal; otros, con ansiedad y depresión, responden a intervenciones psicológicas.6,9,35,38,39 Los ADT (amitriptilina) logran sus efectos mediante la capacidad de modulación de la percepción del dolor a nivel central. Los inhibidores de la recaptación de la serotonina (ISRS) (fluoxetina, paroxetina, citalopram y escitalopram) disminuyen la sensibilidad visceral, mejoran la sensación de bienestar global, poseen propiedades ansiolíticas y potencian los efectos de otros fármacos como los ADT. Los inhibidores de la recaptación de la serotonina y noradrenalina (duloxetina, venlafaxina y desvenlafaxina), mejoran el control del dolor mediante el bloqueo dual de los receptores de serotonina y noradrenalina.
En relación con los comúnmente usados ADT, se propone que actúan sobre varios mecanismos patológicos en el SII: la motilidad intestinal alterada, la reducción del tiempo de transito oro rectal y la sensibilidad visceral alterada. El sistema nervioso central modula el dolor, y es el mayor sitio de regulación de este; se plantea que en el SII hay un aumento de la activación de la corteza anterior-media del cíngulo, y consecuentemente, una disfunción del control del dolor. Los ADT pueden revertir el dolor disfuncional por una acción analgésica central y disminuir los síntomas psicológicos que acompañan a este síndrome, especialmente la depresión y la ansiedad, que intensifican los síntomas digestivos de estos pacientes. La analgesia y efectos neuromoduladores ocurren a bajas dosis, no así los efectos antidepresivos.39-41
La amitriptilina, por sus efectos sedativos y anticolinérgicos, se debe seleccionar para los pacientes con diarrea, y la imipramina, en los que predomina el estreñimiento. Bajas dosis de amitriptilina (10 mg diarios) son bien toleradas y pueden ser efectivos en reducir los síntomas en los que predomina la diarrea; este efecto es más pronunciado en el segundo mes de tratamiento, sin embargo, es necesario realizar estudios más amplios para verificar estos resultados. Los antidepresivos más recomendados en el SII-E son los ISRS, evitando los ADT; sin embargo, la mayor experiencia en la infancia y adolescencia es con los ADT. Cuando clínicamente son eficaces, se recomienda prolongar el tratamiento al menos 6 meses.40,41 Debería reservarse su uso a pacientes con persistencia de estos síntomas tras otros tratamientos (medidas higiénico-dietéticas, laxantes y linaclotida).
Los espasmolíticos se han utilizado clásicamente en el tratamiento empírico del SII, basándose en que la contracción espástica del músculo liso colónico contribuye a los síntomas del SII, especialmente al dolor. Se distinguen 3 clases principales: antagonistas de canales del calcio (otilonio y pinaverium), relajantes directos del músculo liso (mebeverina) y anticolinérgicos/antimuscarínicos (hioscina, cimetropium e hidrocloruro de diciclomina), aunque no hay estudios bien diseñados que confirmen su eficacia y tienen beneficios limitados en aliviar el dolor. En cuanto a los antiespasmódicos, el más efectivo fue la hioscina, y es el medicamento que se debería usar primero entre los antiespasmódicos.6,9,39
La esencia de menta, con frecuencia también llamada aceite, tiene propiedades espasmolíticas y en la modulación del dolor, al atenuar la hipersensibilidad visceral. La esencia de menta ha demostrado ser eficaz para el control del dolor y la distensión en pacientes con SII, con escasos efectos adversos y transitorios trastornos digestivos ligeros, como acidez, ardor o "disconfort" anal y perianal. Una o dos cápsulas entéricas (180-200 mg) diarias durante 2-4 semanas, puede mejorar los síntomas, y estas pueden ser masticadas.
La serotonina 5-HT juega un papel crucial en el tracto gastrointestinal, influyendo en las funciones secretora, motora y sensorial. Existen 7 subtipos de receptores de 5-HT a nivel intestinal, de ellos, el receptor 5-HT4 favorece la secreción intestinal, aumenta el peristaltismo y el tránsito intestinal. Prucaloprida es un agonista altamente selectivo del receptor 5-HT4, y que, por tanto, actúa estimulando la motilidad intestinal. En los ensayos fase III prucaloprida fue superior al placebo a la hora de mejorar el estreñimiento, el dolor y la distensión abdominal, así como la calidad de vida, pero solo se recomienda en SII-E en casos seleccionados y con poca respuesta a otros tratamientos.39,42 El estreñimiento responde a agonistas 5-HT4 (prucalopride, mosapride), mientras que los síntomas diarreicos pueden responder a antagonistas 5-HT3 (ondansetrón, granisetrón) y a la loperamida, aunque no alivia el dolor.42
Los laxantes osmóticos contienen iones no absorbibles o moléculas que retienen agua en la luz intestinal. Los más utilizados son el polietilenglicol (PEG), la lactulosa y las sales de magnesio. Este tipo de laxantes mejoran el estreñimiento y la consistencia de las heces, pero se obtiene una pobre respuesta en el dolor y la distensión abdominal. La mayor evidencia, por los estudios disponibles, es para el PEG, pero las sales de magnesio se utilizan frecuentemente en la práctica clínica con resultado satisfactorio. Entre los laxantes estimulantes se incluyen los difenilmetanos (fenolftaleína, bisacodilo, picosulfato sódico) y las antraquinonas (senna, cáscara sagrada, aloe vera). Estos fármacos favorecen la secreción de agua y electrolitos en el colon, o inducen su peristalsis, como ocurre con los laxantes osmóticos. Estos fármacos no han demostrado su eficacia en el control del dolor y la distensión abdominal, e incluso, pueden empeorar estos síntomas, por lo que su utilidad es muy limitada en el SII-E. Su perfil de seguridad es menor que el de los laxantes osmóticos.32-35,38,39
Para combatir el estreñimiento se debe enriquecer la dieta en fibra (edad en años + 5 g/día), pues los laxantes pueden ayudar, aunque pueden exacerbar el dolor y la distensión abdominal. Se reporta por algunos autores la reducción del dolor y la distensión abdominal en niños con la dieta con fibra con psyllium.43 La utilización de fibra dietética -o suplemento de fibra- como primera medida terapéutica, es razonable en cualquier paciente con estreñimiento, asociado o no a molestias abdominales, con mayor evidencia con la fibra soluble, por lo que debe considerarse que un curso de tratamiento de 6 semanas es suficiente para evaluar su eficacia. Se aconseja aumentar la cantidad de fibra de forma progresiva para evaluar no solo la eficacia sino también la tolerancia. En los ensayos en adultos que compararon la fibra con el placebo, la fibra insoluble como el salvado no fue efectiva. En cambio, solo la fibra soluble como la cáscara de ispágula (plantagoovata) reducía los síntomas.9,39
La lubiprostona, prostaglandina E1 activadora local intestinal del canal de cloro tipo-2, provoca mejoría significativa de los síntomas del SII con estreñimiento (induce aumento de la secreción intestinal con el consecuente ablandamiento de las heces, aumento de la motilidad intestinal y disminución de los gases y dolor abdominal, no se han demostrado efectos sobre la sensibilidad visceral), especialmente en adultos a dosis altas de 48 microgramos (mcg) al día, pero presentan muchos efectos adversos, en cambio, se ha demostrado que con dosis de 16 mcg al día es una combinación efectiva y segura, aunque con limitaciones en menores de 18 años. Los efectos adversos más comunes son la cefalea, la diarrea y las náuseas.44
La linaclotida es una agonista de la guanilatociclasa C, cuyo estímulo produce un aumento del guanosínmonofostafocíclico (GMPc) intracelular en el enterocito. Este GMPc actúa a nivel intracelular y produce un aumento de la secreción de bicarbonato y cloro hacia la luz intestinal, y se difunde al espacio extracelular para ejercer una acción sobre las terminaciones sensitivas y disminuir su actividad. Desde el punto de vista farmacodinámico, el efecto final es un aumento de la secreción intraluminal, con la consiguiente aceleración del tránsito, y un efecto analgésico visceral, con disminución de umbrales sensitivos a la distensión mecánica. Sus efectos no se limitan solo a su acción sobre los síntomas de estreñimiento, sino que se muestra una mejoría del dolor y la distensión en los ensayos clínicos (un beneficio de 15-30 % sobre el placebo). Es el fármaco de elección en pacientes con estreñimiento y molestias abdominales, como dolor y distensión, cuando la fibra dietética y los laxantes han fracasado en dosis de 290 mcg una vez al día desde el punto de vista práctico. El único efecto adverso registrado relevante es la diarrea, cuya importancia ha de ser evaluada con el paciente, y que su uso en menores de 18 años es limitado.45
Se han utilizado en pacientes pediátricos con buenos resultados terapias biopsicosocial, especialmente en adolescentes de 11 a 18 años, la terapia conductual, la hipnoterapia intestinal directa, el uso de yoga y la acupuntura. Las terapias florales no han sido de utilidad.1,9,39,46,47 La terapia conductual puede ser efectiva, aunque la necesidad de múltiples sesiones limita su práctica.47 La hipnoterapia ha tenido efectos beneficiosos en niños, que han persistido asintomáticos al menos 5 años después de finalizar la terapia. Se piensa que reduce la hiperalgesia visceral y las contracciones del colon, y mejora el pensamiento negativo acerca de su condición, aunque la evidencia es controversial. Una revisión sistemática encontró mejoría estadísticamente significativa en las escalas de dolor abdominal.46 Los ejercicios de yoga han sido efectivos en niños específicamente en reducir la intensidad y frecuencia del dolor.
La acupuntura se basa en el efecto de la estimulación de determinadas zonas o "puntos gatillo" repartidas por todo el cuerpo, que tienen relación con las distintas vísceras y otras partes del organismo (articulaciones, paquetes músculo esqueléticos, entre otros), a través de la inserción superficial en la piel de finas agujas. A este respecto, determinados puntos de estimulación se relacionan con el dolor abdominal, la diarrea y el estreñimiento, y pueden actuar sobre estos síntomas tratando de estimular los puntos necesarios con esta técnica. No hay evidencia disponible que permita recomendar la acupuntura para mejorar los síntomas y la calidad de vida, aunque puede disminuir el uso de opiáceos para calmar el dolor.
Los probióticos son bacterias vivas que poseen diversas características, como son, la supervivencia en el tracto gastrointestinal, la adherencia al epitelio intestinal y la modulación de la microbiota intestinal, porque inhiben las bacterias potencialmente patógenas y producen diversos efectos inmunomoduladores e inmunoestimulantes, como el estímulo para la proliferación de células inmunitarias, el aumento en la actividad de las células fagocíticas, o el incremento en la producción de IgA. Todo ello determina su potencial efecto beneficioso en la prevención de infecciones, especialmente, por patógenos de origen intestinal y de la translocación bacteriana.
Dada la falta de evidencia actual a favor por los resultados contradictorios que arrojan los diversos estudios respecto a su eficacia en el alivio de los síntomas de dolor abdominal, distensión y mejoría en el ritmo defecatorio en los pacientes con SII-E, no se debe recomendar su uso. En niños, el Lactobacillus GG (LGG), con dosis de 3 x 109 a 1010, y duración entre 4 y 8 semanas, es el más estudiado, incluyendo un meta análisis. Ha demostrado eficacia en el SII con respuesta clínica favorable respecto a placebo, aunque con un nivel de evidencia bajo. A efectos prácticos se podría valorar el uso de LGG en niños con SII con predominio de diarrea, en particular, si los síntomas se han exacerbado tras un episodio de gastroenteritis.48
La rifaximina es un antibiótico sintético derivado de la rifamicina, con actividad grampositiva, gramnegativa y frente a microorganismos aerobios y anaerobios, no absorbible a través de la mucosa intestinal (< 0,01 % tras la administración oral), por lo que actúa intraluminal, con nulo efecto sistémico. Impide la adherencia de los patógenos a la mucosa intestinal y la invasión de las células epiteliales por estos, al unirse a la subunidad β del ácido ribonucleico (ARN) polimerasa microbiana, inhibiendo de este modo la transcripción y la síntesis de ARN. Su uso parece reducir, según las revisiones de los estudios llevados a cabo, los síntomas de distensión, flatulencia y dolor abdominal en los pacientes con SII sin estreñimiento. No se reflejan en los distintos estudios y revisiones efectos secundarios mayores o más frecuentes que los comparados con placebo. No existen suficientes datos actualmente para recomendar su utilización, aunque podría disminuir la hinchazón y la flatulencia.34,35,39,42
En relación con la fermentación de hidratos de carbono (FODMAP: oligo, di y monosacáridos fermentables y polioles), las dietas bajas en FODMAP contienen 0,15 g/kg/día (máximo 9 g/día) y las dietas habituales contienen 0,7 g/kg/día (máximo 50 g/día) de FODMAP. Se han publicado estudios de gran importancia que apoyan el papel de los FODMAP como agentes capaces de inducir síntomas en el SII y en la sensibilidad no celíaca al gluten.33,36
La fermentación bacteriana de estos hidratos de carbono produce ácidos grasos de cadena corta, lactato y gas, y se ha asociado con la aparición de hinchazón abdominal, meteorismo, dolor abdominal y diarrea. La aparición de síntomas digestivos tras la ingesta de trigo se ha relacionado con su alto contenido en fructanos, oligosacáridos de cadena larga que son pobremente absorbidos, y por tanto, susceptibles de fermentación bacteriana, así como con la presencia intestinal de bacterias reductoras de sulfatos.49-53 La fermentación de proteínas del gluten por estas bacterias intestinales podría producir liberación de amonio y sulfuro de hidrógeno, que pueden ocasionar tanto síntomas digestivos locales como sistémicos, entre otros, astenia.37 Un reciente estudio en niños con SII (todos los subtipos) sugiere eficacia con dietas de reducción de la ingesta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables.9,53
Chumpitazi,52 en un estudio doble a ciegas, aleatorizado, en 33 niños con SII, reporta mejoría del dolor abdominal después de recibir durante 48 horas dieta baja en FODMAP. Aunque estos resultados sean promisorios, son necesarios estudios a largo plazo para demostrar eficacia y seguridad con esta dieta en niños y adolescentes.
El papel de algunos componentes de la dieta como desencadenantes de los síntomas o en la patogénesis del SII es objeto de interés creciente. La dieta sin gluten, o la dieta baja en FODMAP, parece mejorar los síntomas de dolor y distensión abdominal en el SII, pero no el estreñimiento. En definitiva, la evidencia actual es limitada para su recomendación rutinaria en la práctica clínica para el SII-E. Como efectos secundarios de este tipo de dietas hay que señalar la posible malnutrición si se mantienen de forma prolongada, por lo que se utiliza por período cortos de tratamiento.
Se ha publicado recientemente un estudio retrospectivo abierto de niños de 1a 18 años, con varios tipos dolor abdominal funcional según criterios Roma III, tratados con ciproheptadina, un antihistamínico clásico utilizado habitualmente para la profilaxis de la migraña. El estudio reporta una elevada eficacia en la resolución completa de los síntomas (72,8 %) en todos los subgrupos estudiados (incluye dispepsia, SII, dolor abdominal funcional no especificado y migraña abdominal). Este efecto puede relacionarse con su acción antiserotoninérgica y leve acción anticolinérgica. En general es bien tolerado, con somnolencia y ganancia de peso como efectos secundarios más frecuentes.9,54
Mearin y otros,55 en esta Guía de Práctica Clínica adaptada a los criterios de Roma IV difundidos a finales de mayo de 2016, analiza los criterios de derivación entre AP y Gastroenterología, y plantea que, aunque es para pacientes adultos, se ajusta a los pacientes pediátricos, que en mayor frecuencia son adolescentes.
¿Cuándo se debe derivar a un paciente con SII con diagnóstico de certeza, a una consulta de Gastroenterología o de otras especialidades? En la actualidad, pueden existir vías de actuación diferentes en cada departamento o área asistencial, en función de la existencia o no de protocolos de actuación. Lo ideal es crear unos sistemas de actuación por procedimientos, según los cuales el médico de AP tenga acceso directo al especialista de Gastroenterología, con el fin de consultar cambios en el tratamiento, o derivar al paciente para la realización de estudios complementarios o tratamientos específicos únicamente accesibles a asistencia especializada. En este sentido, sería razonable la derivación del paciente en los casos siguientes (cuadro):
1. No respondedores o intolerantes a tratamiento con medidas básicas higiénico-dietéticas, cambios de estilo de vida y laxantes habituales, incluyendo tratamiento de rescate con laxantes estimulantes (bisacodilo y picosulfato sódico). Si existen vías de acceso no presenciales, la prescripción de fármacos agonistas de la serotonina o secretagogos puede realizarse por el médico de AP consensuando con el especialista el seguimiento. En los pacientes con SII-E se incluirán los no respondedores a tratamiento con espasmolíticos o con antidepresivos.
2. Pacientes que con un control satisfactorio de los síntomas experimenten un empeoramiento no justificable. En estos casos la derivación puede al especialista de Gastroenterología, o en función de síntomas o signos asociados a consultas específicas (Endocrinología, Ginecología, Cirugía, Psiquiatría, entre otras).
3. Pacientes o familiares cuyas características psicológicas, actitud frente a los síntomas, o cuestionamiento en la búsqueda constante de la organicidad de sus molestias, requieran el refuerzo de la opinión de un especialista.
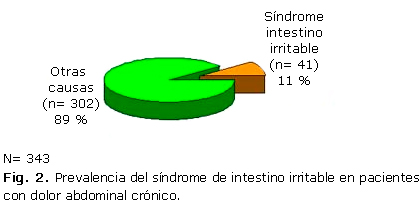
El SII en la población pediátrica es poco diagnosticado y el DAC es motivo de consulta frecuente en la infancia y adolescencia. En esta investigación se describen las características clínicas y la historia natural del SII en niños y adolescentes atendidos en nuestra consulta de Gastroenterología, basado en los criterios de Roma. Durante un período de 3 años, a los pacientes -y/o padres o tutores- atendidos ambulatoriamente con diagnóstico de DAC, se les realizó una encuesta de los síntomas a pacientes, y el examen físico completo en la primera visita. Se indicaron complementarios que incluyeron: pruebas bioquímicas y hematológicas, anticuerpo antitransglutaminasa tisular, estudios parasitológicos y bacteriológicos de heces, sangre oculta en heces, urocultivo, pruebas metabólicas en orina, estudios endoscópicos y anatomopatológicos del tractus digestivo, ecografía abdominal y electroencefalograma, para descartar causas orgánicas, y se seleccionaron los que reunieron los criterios para SII. Los resultados se vertieron en una base de datos confeccionada al respecto y procesada por el sistema estadístico Epinfo 6, a través de frecuencias absolutas y relativas. Se consideraron 343 pacientes con DAC funcional y 41 (11 %) como SII (figura 2), entre 5-15 años (media 9,5), y el 51,2 % entre 5-9 años, 22 masculinos (53,7 %), sin antecedentes familiares de enfermedad inflamatoria intestinal.
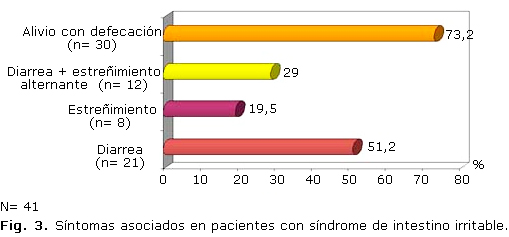
El dolor o molestia abdominal se localizó en el hipogastrio en 28 pacientes (68,3 %) y en 13 en la región periumbilical (31,7 %); 21 (51,2 %) presentaban diarreas, 8 (19,5 %) estreñimiento, 12 (29 %) diarrea y estreñimiento alterno, y en 30 alivio con la defecación, para 73,2 % (figura 3). Presentaron giardiasis 9 (22 %), el 12,2 % estaba malnutrido y 12,2 % era obeso. El tiempo de evolución osciló entre 3 meses y más de 2 años, con predominio del 31,6 % en más de un año.
Se concluye que el SII es relativamente frecuente como causa de DAC funcional, y que el interrogatorio dirigido, según los criterios de Roma, es útil para su diagnóstico. La mayoría de los pacientes con SII en la infancia deben ser atendidos en la AP.
CONSIDERACIONES FINALES
Por su elevada prevalencia y dificultades terapéuticas, y por su costo económico para el sistema de salud, los pacientes con TFGI constituyen un reto para el médico de AP, el pediatra y el gastroenterólogo.
Los nuevos criterios de Roma IV, recién establecidos, definen con más precisión algunos aspectos, y establecen la interrelación con otras entidades del ámbito funcional. Se repasa en esta revisión la epidemiología, la fisiopatología y las orientaciones terapéuticas, según los subtipos, el impacto en la calidad de vida y en recursos, que precisan estos pacientes. Se establece la importancia de detectar la presencia o no de síntomas de alarma. Se revisan todas las herramientas terapéuticas basadas en el manejo, según el síntoma predominante, teniendo en cuenta la evidencia disponible.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses en la realización del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Di Lorenzo C, Colletti RB, Lehmann HP, Boyle JT, Gerson WT, Hyams JS, et al. AAP Subcommittee; NASPGHAN Committee on Chronic Abdominal Pain. Chronic Abdominal Pain In Children: a Technical Report of the American Academy of Pediatrics and the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr (JPGN). 2005;40(3):249-61.
2. Spiller RC. Postinfectious irritable bowel syndrome. Gastroenterology. 2003;124:1662-71.
3. McFerron BA, Waseem S. Chronic recurrent abdominal pain. Pediatr Rev. 2012 Nov;33(11):509-16.
4. Saps M, Nichols-Vinueza DX, Rosen JM, Velasco-Benítez CA. Prevalence of functional gastrointestinal disorders in Colombian school children. J Pediatr. 2014;164:542-45.e1.
5. Van Tilburg MAL, Walker LS, Palsson OS, Kim SM, Spiegel BM, Siller RC, et al. Prevalence of child/adolescent functional gastrointestinal disorders in a national U.S. community sample. Gastroenterology. 2014;146(sup 1):S143-S44.
6. Korterink JJ, Diederen K, Benninga MA, Tabbers MM. Epidemiology of pediatric functional abdominal pain disorders: A Meta-Analysis. PLoS ONE. 2015;10(5):e0126982.
7. Rasquin-Weber A, Hyman PE, Cucchiara S, Fleisher DR, Hyams JS, Milla PJ, et al. Childhood functional gastrointestinal disorders. Gut. 1999;45(sup II):1160-8.
8. Rasquin A, Di Lorenzo C, Forbes D, Guiraldes E, Hyams JS, Staiano AM, et al. Childhood Functional Gastrointestinal Disorders: Child Adolescent ROMA III. Gastroenterology. 2006;130(5):1527-37.
9. Hyams JF, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M. Childhood Functional Gastrointestinal Disorders: Child/Adolescent. ROMA IV. Gastroenterology. 2016;150:1456-68.
10. Rey E, Balboa A, Mearin F. Chronic constipation, irritable bowel syndrome with constipation and constipation with pain/discomfort: Similarities and differences. Am J Gastroenterol. 2014;109:876-84.
11. Schmulson MJ, Drossman DA. What Is New in Rome IV. J Neurogastroenterol Motil. 2017 Apr 30;23(2):151-63.
12. Self MM, Czyzewski DI, Chumpitazi BP, Weidler EM, Shulman RJ. Subtypes of irritable bowel syndrome in children and adolescents. Clin Gastroenterol Hepatol. 2014;12(9):1468-73.
13. Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transittime. Scand J Gastroenterol. 1997;32(9):920-4.
14. Carabotti M, Sciroccoa A, Masellib MA. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Annals Gastroenterology. 2015;28:203-9.
15. Drossman DA, Hasler WL. Rome IV-Functional GI disorders: disorders of gut-brain interaction. Gastroenterology. 2016;150:1257-492.
16. Di Lorenzo C, Youssef NN, Sigurdsson L, Scharff L, Griffiths J, Wald A. Visceral hyperalgesia in children with functional abdominal pain. J Pediatr. 2001;139:838-43.
17. Saulnier DM, Riehle K, Mistretta TA, Diaz MA, Mandal D, Raza S, et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome. Gastroenterology. 2011 Nov;141(5):1782-91.
18. Rajilic-Stojanovic M, Biagi E, Heilig HG, Kajander K, Kekkonen RA, Tims S, et al. Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology. 2011;141:1792-801.
19. Shankar V, Agans R, Holmes B, Raymer M, Paliy O. Do gut microbial communities differ in pediatric IBS and health? Gut Microbes. 2013 Jul-Aug;4(4):347-52.
20. Waters AM, Schilpzand E, Bell C, Walker LS, Baber K. Functional gastrointestinal symptoms in children with anxiety disorders. J Abnorm Child Psychol. 2013 Jan;41(1):151-63.
21. Bonilla S, Saps M. Early life events predispose the onset of childhood functional gastrointestinal disorders. Rev Gastroenterol Mex. 2013;78:82-91.
22. Gulewitsch MD, Enck P, Schwille-Kiuntke J, Weimer K, Schlarb AA. Rome III criteria in parents' hands: pain-related functional gastrointestinal disorders in community children and associations with somatic complaints and mental health. Eur J Gastroenterol Hepatol. 2013;25:1223-9.
23. Mieli E, Simeone D, Marino A, Greco L, Auricchio R, Novek SJ, et al. Functional Gastrointestinal Disorders in Children: An Italian Prospective Survey. Pediatrics. 2004;114 (1):73-8.
24. Walker LS, Lipani TA, Greene JW, Caines K, Stutts J, Polk DB, et al. Recurrent abdominal pain: symptom subtypes based on the Rome II. Criteria for pediatric functional gastrointestinal disorders. J Pediatr Gastroenterol Nutr. 2004;38:187-91.
25. Reshetnikov OV, Kurilovich SA, Denisova DV. Prevalence of dyspepsia and irritable bowel syndrome among adolescents of Novosibirsk, Western Siberia. Int J Circumpolar Health. 2001;60:253-7.
26. Dong L, Dingguo L, Xiaoxing X, Hanming L. An Epidemiologic Study of Irritable Bowel Syndrome in Adolescents and Children in China: A School-Based Study. Pediatrics. 2005;116(3):393-6.
27. Caplan A, Walker L, Rasquin A. Validation of the pediatric Rome II criteria for functional gastrointestinal disorders using the questionnaire on pediatric gastrointestinal symptoms. J Pediatr Gastroenterol Nutr (JPGN). 2005;41(3):305-16.
28. Fragoso T, Díaz T, Rivas D, Llorian ME, Benech Y. Diagnosis of Functional Gastrointestinal Disorders According to Roma II Criteria. J Pediatric Gastroenterol Nutrition (JPGN). 2006;43:E60-E61.
29 Fragoso T, Rivas D, Trujillo ME, Milán R, Purón B, Benech Y. Diagnóstico del dolor abdominal según criterios de Roma II. Revista Gastroenterología México. 2006;71(sup 2):132.
30. Thornton GCD, Goldacre MJ, Goldacre R, Howarth LJ. Diagnostic Outcomes Following Childhood Non-specific Abdominal Pain. Arch Dis Child. 2016;101(4):305-9.
31. Cheng P, Shih W, Alberto M, Presson A, Licudine A, Mayer E, et al. Autonomic response to a visceral stressor is dysregulated in irritable bowel syndrome and correlates with duration of disease. Neurogastroenterol Motil. 2013;25:e650-e659.
32. Ford AC, Lacy BE, Talley NJ. Irritable Bowel Syndrome. N Engl J Med. 2017;376:2566-78.
33. Lacy BE, Mearin F, Chang L, Chey WD, Lembo AJ, Simren M, et al. Bowel disorders. Gastroenterology. 2016;150:1393-407.
34. Sandhu BK, Siba Prosad P. Irritable bowel syndrome in children: Pathogenesis, diagnosis and evidence-based treatment. World J Gastroenterol. 2014 May 28;20(20):6013-23.
35. Chogle A, Mintjens S, Saps M. Pediatric IBS: an overview on pathophysiology, diagnosis and treatment. Pediatr Ann. 2014 Apr;43(4):e76-82.
36. Aziz I, Sanders DS. The irritable bowel syndrome-celiac disease connection. Gastrointest Endoscopy Clin Am. 2012;22:623-37.
37. Henderson P, Casey A, Lawrence SJ, Kennedy NA, Kingstone K, Rogers P, et al. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am J Gastroenterol. 2012;107:941-9.
38. Hungin APS, Molloy-Bland M, Claes R, Heidelbaugh J, Cayley Jr. WE, Muris J, et al. Systematic review: the perceptions, diagnosis and management of irritable bowel syndrome in primary care-A Rome Foundation Working Team Report. Aliment Pharmacol Ther. 2014;40:1133-4.
39. Korterink JJ, Rutten JM, Venmans L, Benninga MA, Tabbers MM. Pharmacologic treatment in pediatric functional abdominal pain disorders: a systematic review. J Pediatr. 2015 Feb;166(2):424-31.
40. Vahedi H, Merat S, Momtahen S, Kazzazi AS, Ghaffari N, Olfati G, et al. Clinical trial: the effect of amitriptyline in patients with diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther. 2008 Apr;27(8):678-84.
41. Bahar RJ, Collins BS, Steinmetz B, Ament M. Double-blind placebo-controlled trial of amitriptyline for the treatment of irritable bowel syndrome in adolescents. J Pediatr. 2008 May;152(5):685-9.
42. Lucak S, Chang L, Halpert A, Harris L. Current and emergent pharmacologic treatments for irritable bowel syndrome with diarrhea: evidence-based treatment in practice. Ther Adv Gastroenterol. 2017;10:253-75.
43. Shulman RJ, Hollister EB, Cain K, Czyzewski DI, Self MM, Weidler EM, et al. Psyllium Fiber Reduces Abdominal Pain in Children With Irritable Bowel Syndrome in a Randomized, Double-Blind Trial. Clin Gastroenterol Hepatol. 2017 May;15(5):712-9.
44. Wilson N, Schey R. Lubiprostone in constipation: Clinical evidence and place in therapy. Therapeutic Advances in Chronic Disease. 2015;6(2):40-50.
45. Atluri DK, Chandar AK, Bharucha AE, Falck-Ytter Y. Effect of linaclotide in irritable bowel syndrome with constipation (IBS-C): A systematic review and metaanalysis. Neurogastroenterol Motil. 2014;26:490-9.
46. Rutten JM, Reitsma JB, Vlieger AM, Benninga MA. Gut-directed hypnotherapy for functional abdominal pain or irritable bowel syndrome in children: a systematic review. Arch Dis Child. 2013 Apr;98(4):252-7.
47. Rutten JM, Korterink JJ, VenmansLM, Benninga MA, Tabbers MM. Nonpharmacologic treatment of functional abdominal pain disorders: a systematic review. Pediatrics. 2015 Mar;135(3):522-35.
48. Didari T, Mozaffari S, Nikfar S, Abdollahi M. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol. 2015;21:3072-84.
49. De Roest RH, Dobbs BR, Chapman BA, Batman B, O'Brien LA, Leeper JA, et al. The low FODMAP diet improves gastrointestinal symptoms in patients with irritable bowel syndrome: A prospective study. Int J Clin Pract. 2013;67:893-5.
50. Chumpitazi BP, Hollister EB, Oezguen N, Tsai CM, McMeans AR, Luna RA, et al. Gut microbiota influences low fermentable substrate diet efficacy in children with irritable bowel syndrome. Gut Microbes. 2014;5(2):165-75.
51. Tuck CJ, Muir JG, Gibson PR. Fermentable oligosaccharides, disaccharides, monosaccharides and polyols: role in irritable bowel syndrome. J Expert Review Gastroenterology & Hepatology. 2014;8(7):819-34.
52. Chumpitazi BP, Cope JL, Hollister EB, Tsai CM, McMeansAR, Luna RA, et al. Randomised Clinical Trial: Gut Microbiome Biomarkers are Associated with Clinical Response to a Low FODMAP Diet in Children with Irritable Bowel Syndrome. Aliment Pharmacol Ther. 2015 August;42(4):418-27.
53. Böhn L, Störsrud S, Liljebo T, Collin L, Lindfors P, Törnblom H, et al. Diet low in FODMAPs reduces symptoms of irritable bowel syndrome as well as traditional dietary advice: a randomized controlled trial. Gastroenterology. 2015;149:1399-407.
54. Madani S, Cortes O, Thomas R. Cyproheptadine use in children with functional gastrointestinal disorders. J Pediatr Gastroenterol Nutr. 2016;62:409-13.
55. Mearin F, Ciriza C, Mínguez M, Rey E, Mascort JJ, Peña E, et al. Guía de Práctica Clínica: Síndrome del intestino irritable con estreñimiento y estreñimiento funcional en adultos. Rev Esp Enferm Dig (Madrid). 2016;108(6):332-63.
Recibido: 25 de febrero de 2018.
Aprobado: 27 de abril de 2018.
Trini Fragoso Arbelo. Servicio de Gastroenterología y Nutrición. Hospital Pediátrico Universitario "Borras-Marfan". Calle F y 27, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: fragoso@infomed.sld.cu