Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Cultivos Tropicales
versão impressa ISSN 0258-5936
cultrop vol.31 no.2 La Habana abr.-jun. 2010
Micorrización in vitro e in vivo de plántulas de papa (Solanum tuberosum var. Alfa)
Mycorrhization in vitro and in vivo of potato plantlets (Solanum tuberosum var. Alpha)
Ms.C. Kalyanne Fernández
Investigadora Agregada del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana, Cuba, CP 32 700. E-mail: kalyanne@inca.edu.cu
RESUMEN
Las condiciones artificiales en las que se desarrollan las plantas obtenidas por micropropagación hacen que sean más susceptibles a la sequía durante el transplante. Los hongos micorrízicos arbusculares contribuyen a la supervivencia y el crecimiento de las plantas al reducir el estrés asociado con la nutrición, las relaciones con el agua, la estructura del suelo, el pH, las sales, los metales tóxicos y los patógenos, por lo que son considerados de extrema utilidad como inoculantes durante las diferentes fases de micropropagación de los cultivos. Teniendo en cuenta estos aspectos se realizó este trabajo, con el objetivo de evaluar la factibilidad de la inoculación micorrízica durante los estadios in vitro e in vivo del proceso de micropropagación del cultivo de la papa (Solanum tuberosum L var. Alfa). Para dar respuesta al trabajo, se estudió la inoculación micorrízica sobre plantas de papa en condiciones de crecimiento in vitro, empleando diferentes medios de cultivo (MS, M y un nuevo medio N), bajo un diseño completamente aleatorizado (DCA) y la inoculación de plantas de papa durante el transplante a fase adaptativa empleando tres especies del género Glomus y dos concentrados de especies de HMA (selva y desierto) sobre dos sustratos diferentes, utilizando un DCA bajo arreglo bifactorial. En el estudio in vitro se obtuvieron efectos positivos sobre las plantas inoculadas en el medio M, aun cuando quedó clara la necesidad de encontrar nuevos medios, nutricionalmente balanceados, que garanticen tanto el crecimiento de las plántulas como el establecimiento eficiente de la micorrización. Además, en la fase adaptativa se encontró una respuesta altamente positiva a la inoculación de las cepas, mostrando un comportamiento diferenciado en función de los sustratos, apreciable en todas las variables estudiadas (nutricionales, fúngicas y fisiológicas), lo cual demostró la factibilidad del uso de dichos microorganismos en este estadio de la micropropagación del cultivo.
Palabras clave: micorrizas arbusculares, inoculación, micropropagación, adaptación, Solanum tuberosum, medio de cultivo.
ABSTRACT
The artificial conditions under which micro-propagated plants develop make them more susceptible to drought when transplanted. Arbuscular mycorrhizal fungi contribute to plant growth and survival by reducing the stress associated to nutrition, water relations, soil structure, pH, salts, toxic metals and pathogens, so that they are considered extremely useful as inoculants during the different stages of plant micropropagation. Taking these aspects into account, this work was developed to evaluate the mycorrhizal inoculation feasibility during in vitro and in vivo stages of potato (Solanum tuberosum L var. Alfa) crop micropropagation process. Therefore, mycorrhizal inoculation was studied on potato plants under in vitro growing conditions, with different culture media (MS; M and a new medium N), with a randomized complete design (RCD) and potato plants inoculated, when transplanted to adaptation stage, by three single Glomus species and two concentrates of AMF species (forest and desert) on two different growth substrates using a bifactorial arranged RCD. Positive effects were obtained on in vitro plants inoculated in the M medium, even though it is evident to look for new nutritionally-balanced media that guarantee both plant growth and an efficient mycorrhizal establishment. Besides, at the adaptation stage, there was a highly positive strain inoculation response, showing a differentiated behaviour according to the substrates, which was appreciated in all variables studied (nutritional, fungal and physiological), so proving the feasibility of using such microorganisms at this potato micropropagation stage.
Key words: arbuscular mycorrhizae, inoculation, micropropagation, adaptation, Solanum tuberosum, culture media.
INTRODUCCIÓN
La papa es el cultivo no cereal más importante para la alimentación y uno de los de mayor consumo a nivel mundial, formando parte de la dieta de más de un billón de personas (1). Se cultiva a gran escala en más de 130 países y los modos de propagación varían en función de los intereses de los productores, siendo la micropropagación una de las técnicas más empleadas con estos fines. Por lo general, la aplicación de estas técnicas tiene aún determinados problemas que limitan su uso generalizado y no garantizan totalmente las condiciones para el posterior desarrollo de las plántulas derivadas en ambientes naturales.
En la última década, se ha informado sobre el uso de microorganismos que habitan las plantas de manera natural, como una posible solución para incrementar la adaptación de las plántulas producidas in vitro (2, 3, 4).
Desde años recientes, la introducción de microorganismos beneficiosos como los Hongos Micorrizógenos Arbusculares (HMA) o las Rizobacterias Promotoras del Crecimiento Vegetal (3), obviamente ausentes en los cultivos axénicos, han incrementado el vigor y la sobrevivencia de gran variedad de cultivos como: fresa (Fragaria sp.), banano (Musa sp.), aguacate (Persea americana), piña (Annanas comosus), café (Coffea sp.), boniato (Ipomoea batata), agave (Agave sp.), etc. Los HMA juegan un rol importante en la nutrición de la mayoría de los cultivos (5) y contribuyen a la supervivencia y el crecimiento de las plantas, al reducir el estrés asociado con la nutrición, las relaciones con el agua (6), la estructura del suelo (7), el pH, las sales, los metales tóxicos y patógenos (8, 9). No obstante, en algunos casos, los efectos beneficiosos sobre el crecimiento solo se observan después que las plantas in vitro están totalmente aclimatadas.Por otra parte, otros aseguran que el crecimiento y la supervivencia podrían incrementarse durante la aclimatización (10), si los inoculantes fueran introducidos durante el estadio de enraizamiento in vitro; sin embargo, existen algunas dificultades relacionadas con el establecimiento de la simbiosis en esta fase, debido a los contaminantes que habitan las paredes de los propágulos micorrízicos, al comportamiento del hospedero y a la naturaleza obligada de este endófito (11, 12). No obstante, existen algunos estudios que presentan a los HMA como inoculantes en cultivos monoxénicos a partir de clamidosporas germinadas con marcados efectos sobre el crecimiento y desarrollo, la producción de embriones y el estado fisiológico de diferentes especies de plantas (13, 14), en los cuales se modifican las condiciones de cultivo y se combinan medios con sustratos para incrementar su similitud con los sistemas naturales. Considerando la importancia de los aspectos tratados se realizó este trabajo, con el objetivo de evaluar la factibilidad de la inoculación micorrízica durante los estadios in vitro e in vivo del proceso de micropropagación de la papa a través del uso de indicadores fúngicos, fisiológicos y nutricionales.
MATERIALES Y MÉTODOS
Se realizaron dos experimentos que incluyeron la inoculación de plántulas de papa in vitro e in vivo (invernadero) empleando diferentes especies de HMA.
1. Inoculación en estadio de enraizamiento in vitro con esporas de Glomus clarumMaterial vegetal. Se utilizaron vitroplantas de papa en estadio de enraizamiento obtenidas por micropropagación (cultivo de cortes nodales) sobre el medio Murashige & Skoog (MS) (15), que tenían entre siete y 10 días de subcultivadas, un sistema radical poco desarrollado (entre tres y cinco raíces) y cuatro o seis hojas por planta.Establecimiento del cultivo dual. Se inocularon vitroplantas de papa con esporas germinadas de Glomus clarum sobre dos medios de cultivo (Tabla I): MS y N (medio nuevo diseñado con el propósito de garantizar el crecimiento y desarrollo de ambos organismos). Este medio estaba compuesto por una combinación de nutrientes de los medios MS y M (16) mezclado con vermiculita estéril en proporción 1:1 (v/v).Se sembraron tres plantas por frasco y se colocaron cinco frascos por tratamiento bajo un diseño completamente aleatorizado. Los tratamientos fueron los siguientes: -1-Medio N+HMA, -2-Medio N y -3-Medio MS (control). En una segunda fase de este experimento se incluyó en los tratamientos el medio M; en este caso se trabajó con igual número de plantas por tratamiento, los cuales se describen a continuación: -1-Medio N+HMA, -2-Medio N, -3-Medio M+HMA, -4-Medio M y -5-Medio MS (control). Las esporas previamente desinfectadas y germinadas se inocularon directamente sobre las raíces con una micropipeta Finnipipette® de 1000 µL a razón de 100 µL por planta, aportando entre 50 y 55 esporas por aplicación. Los frascos se colocaron en una cámara de crecimiento durante 35 días, con un fotoperíodo de 16 horas luz y 8 de oscuridad, 200-300 mE.m-2.seg-1 de iluminación y 20oC de temperatura. 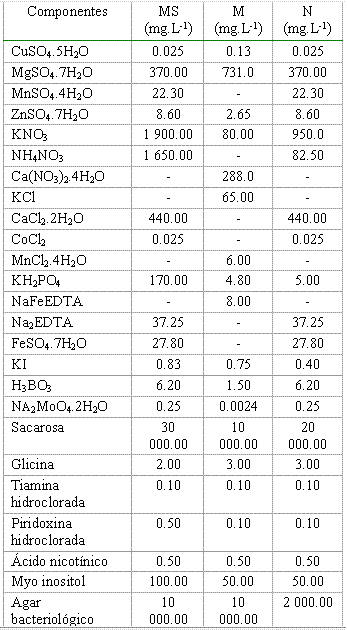
El pH de los medios se ajustó a 5.5 antes de la esterilización
Leyenda: MS: Murashige & Skoog; M: Medio mínimo y N: Medio nuevo
Determinaciones realizadas.
A los 35 días después de la inoculación se muestrearon 12 plantas por tratamiento, a las que se les realizaron las siguientes determinaciones: largo radical (cm), altura de la planta (cm), masas frescas foliar y radical (g), así como la concentración de clorofila total (µg de clorofila/g masa fresca) utilizando un espectrofotómetro UV visible (CARY 50) (17).
Además, se realizaron tinciones a las raicillas de las vitroplantas utilizando la técnica descrita por Elmeskaoui (18), modificada en este trabajo, al sustituir el colorante fuchina ácida por azul de tripano, para comprobar la presencia o no de colonización. 2. Inoculación con HMA de vitroplantas de papa en fase de adaptación En este experimento se inocularon vitroplantas aptas para el trasplante con tres cepas de hongos micorrizógenos (Glomus clarum, G. fasciculatum-Taxter-Gerdemann & Trappe emend. Walker & Koske y G. intraradices Schenck & Smith) procedentes del cepario del Instituto Nacional de Ciencias Agrícolas (INCA) y dos concentrados de especies, uno de selva y otro de desierto, obtenidos en el laboratorio de Bioquímica Ecológica del Centro de Investigación y Estudios Avanzados del IPN (CINVESTAV, Unidad Irapuato, México). El inóculo simple empleado contaba con las siguientes características: G. clarum (140 esporas.g-1), G. fasciculatum (100 esporas.g-1) y G. intraradices (60 esporas.g-1). Se evaluaron asimismo dos sustratos diferentes, uno compuesto totalmente por musgo (Sunshine no. 3) y otro por una combinación del musgo mencionado y vermiculita en proporción 2:1 (v/v). El trasplante de las vitroplantas se hizo colocando una planta en macetas (2.5 L) y un total de 10 macetas por tratamiento.La inoculación se realizó en el momento del trasplante a razón de 2 g de inóculo por planta con riego manual a una frecuencia dependiente del grado de humedad del sustrato. A los 15 días del trasplante se le añadió solución nutritiva de Long Ashton, LANS (19), con pH ajustado a 5.6 y la mitad de la concentración de fósforo (22 ppm) en el caso de los tratamientos micorrizados. Se empleó un diseño completamente aleatorizado bajo arreglo bifactorial (6x2) y los factores estudiados fueron las cepas (tres cepas de HMA, dos concentrados de especies de HMA nativas y un control - 6 -) y los sustratos (2). Determinaciones realizadas.A los 35 días después del trasplante se realizaron las siguientes evaluaciones a cinco plantas por tratamiento: morfoagronómicas: masa seca aérea, masa seca radical, masa seca de tubérculos y masa seca total (g). Las muestras se secaron en estufa a 70oC hasta obtener el peso constante. fúngicas: porcentaje de colonización (%) y densidad visual (%) empleando estereomicroscopio (Zeiss, West Germany-5-). Para realizar la tinción de las muestras se empleó la técnica de Phillips y Hayman (20), y se evaluó el porcentaje de colonización a través del método de los interceptos desarrollado por Giovanetti y Mosse (21). El cálculo matemático de densidad visual se realizó a través de la metodología de Trouvelot (22). fisiológicas: tasa fotosintética (µmol CO2.m-2.s-1) y transpiración (µmol H2O.m-2.s-1) utilizando un analizador portátil de fotosíntesis (LI-6250, LI-COR, Inc. Nebraska, USA), así como se determinó la eficiencia en el uso de agua EUA (%) a partir de la siguiente expresión matemática: EUA= Tasa fotosintética (µmol.m-2.s-1) Transpiración (µmol.m-2.s-1)
Las mediciones se realizaron en horas del mediodía y se escogieron las hojas del tercio superior de la planta. . Contenidos nutricionales foliares: macronutrientes P (%), K (%), Ca (%) y Mg (%), micronutrientes Mn (ppm), Cu (ppm) y Zn (ppm), empleando para el caso del P el método colorimétrico informado por Paneque (23) y para el resto de los elementos el espectrofotómetro de absorción atómica U-2001, HITACHI. Procesamiento estadístico. Para procesar la información del experimento de inoculación in itro, se realizaron análisis de varianza de clasificación simple y posterior prueba de Tuckey, en caso de existir diferencias significativas entre las medias, auxiliadas del programa estadístico “Statgraphs 4.1”. En el experimento de inoculación de plántulas en el momento del trasplante, se realizaron análisis multivariados de componentes principales y de conglomerado jerárquico de ligamento completo (24), utilizando el paquete estadístico “Statistical for Windows”, con el propósito de realizar una valoración integral de los diferentes tratamientos en estudio (cepas y concentrados de especies de HMA y sustratos) y agruparlos en función de sus efectos. Se realizaron análisis de varianza a las variables que estuvieron más correlacionadas con la formación de las componentes, utilizando el programa estadístico Statgraphs 4.1, así como transformaciones a los valores de porcentaje pertenecientes a las variables fúngicas colonización y densidad visual, según la expresión 2arcsenÖx (25). Resultados 1. Inoculación de plántulas en estadio de enraizamiento in vitro con Glomusclarum.
En la Tabla II se puede observar el efecto de la inoculación con G. clarum sobre el comportamiento de la altura de las plantas y las masas frescas foliar y radical en los dos experimentos; existió un marcado efecto negativo del medio N o nuevo sobre el desarrollo de las plántulas de papa. Al analizar cada una de las variables, puede verse cómo se diferencian los valores significativamente, haciéndose menores en el caso del tratamiento micorrizado con respecto a su homólogo y al control sin inocular en el medio MS.
Tabla II. Efecto de la inoculación de Solanum tuberosum con G. clarum sobre las variables estudiadas a los 35 días
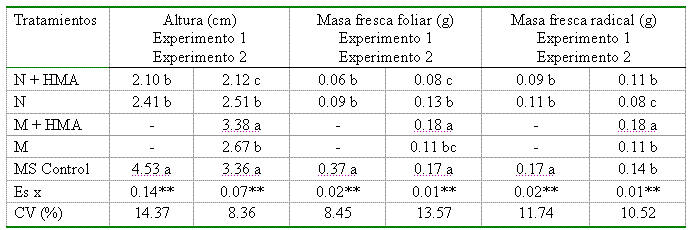
Leyenda: N: Medio nuevo; M: Medio mínimo y MS: Murashige y Skoog. Medias con letras desiguales en cada columna difieren entre sí significativamente para p≤0.05, según prueba de Tuckey
En dicho medio las plantas se desarrollaron adecuadamente (Figura 1a) y mostraron incrementos en la altura que oscilaron entre 47 y 54 %, comportamiento que fue similar en el resto de las variables.
Las plantas que crecieron en el medio N mostraron un crecimiento atrofiado y poco armónico, sobre todo en los tratamientos inoculados, con un marcado cambio de coloración, de verde a purpúreo, en la parte aérea de todas las plantas (Figura 1b).
La variación en la coloración de las plántulas se observó a partir de los 10 días después de inoculadas y apareció primeramente en el envés de las hojas, extendiéndose lentamente sobre estas hasta abarcar toda el área foliar, incluidos los tallos en algunos casos; a los 22 días de inoculadas las plantas, mostraban esta afección en todas sus hojas.
Las plantas que crecieron en el medio N sin inocular no mostraron variación en la coloración, aun cuando su crecimiento fue inhibido y su desarrollo muy retardado.
Al analizar el comportamiento de estas variables en el segundo experimento (Tabla II), se observó un efecto diferenciado de los medios de cultivo, inoculados o no, sobre el crecimiento de las plántulas de papa. Los medios MS y M+HMA ofrecieron condiciones favorables para el desarrollo de las plántulas, reflejado en los altos valores alcanzados por las variables estudiadas. De igual forma, las plantas que crecieron sobre el medio N presentaron un comportamiento similar al antes descrito, manifestando un efecto depresor sobre las variables estudiadas y valores de altura y masas frescas foliar y radical inferiores a las inoculadas sobre el medio M y a los controles sobre el MS. Al comparar los valores de clorofila total (Figura 2), obtenidos en ambos tratamientos (plantas micorrizadas y no micorrizadas), no se encontró efecto de estos sobre su comportamiento, reflejando valores estadísticamente no significativos en ambas repeticiones del experimento. 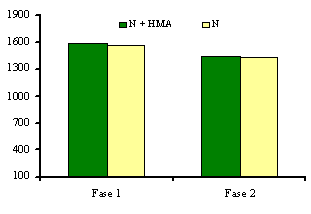
Figura 2. Efecto de la inoculación con HMA sobre la concentración de clorofila
total de las plántulas desarrolladas sobre el medio N2.
Inoculación con HMA de vitroplantas de papa en fase de adaptación
Al realizar el análisis de Componentes Principales, se encontraron dos componentes que explicaron 53.85 y 20.23 % de la variabilidad total, respectivamente (Tabla III), para alcanzar una varianza acumulada de 74.08 %. La primera componente está caracterizada fundamentalmente por la colonización, densidad visual, tasa fotosintética, eficiencia en el uso del agua (EUA) y el contenido de magnesio foliar; mientras que en la segunda aparecen la masa seca total, el contenido de manganeso foliar y calcio.
Se debe destacar que, en este caso, se encuentran incluidas tanto las variables directamente relacionadas con la inoculación y el funcionamiento micorrízico como las dependientes de la inoculación e indicativas del crecimiento y el estado nutricional y fisiológico de las plantas.
En la Figura 3 puede apreciarse la formación de siete grupos: A, B, C, D, E, F, G. Se destacaron los grupos F y C, integrados por los tratamientos inoculados con las especies G. intraradices y G. fasciculatum sobre el sustrato 1, respectivamente, situados en el extremo derecho del cuadrante positivo. Cercano a estos se encuentra el grupo A, que incluye los tratamientos 4 y 5 inoculados con los concentrados de especies de selva y desierto, también en el sustrato 1, así como el tratamiento 8 producto de la inoculación de G. fasciculatum en el sustrato 2, compuesto por una combinación de la mezcla Sunshine no. 3 + vermiculita en proporción 2:1 (v/v). Luego se encuentra el grupo B, compuesto por la especie G. intraradices (9) y los concentrados de especies de selva y desierto (10, 11), todos sobre el sustrato 2. Por otra parte, se hallan los grupos D y E integrados por G. clarum en los sustratos 1 y 2, respectivamente. Finalmente y bastante alejado del resto de los grupos se ubica el grupo G, compuesto por los tratamientos controles en ambos sustratos.
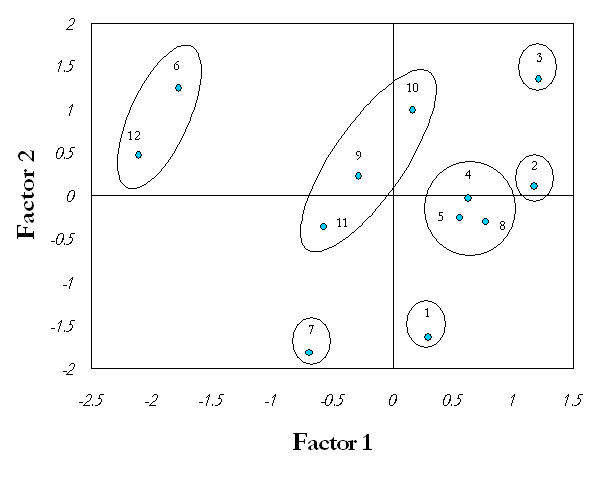
El análisis multivariado permitió encontrar, de forma integral, un efecto positivo de la inoculación micorrízica sobre las plántulas de papa, dado por una conducta superior de los tratamientos micorrizados en relación con los testigos y donde se destacan los tratamientos en los que se emplearon las especies G. intraradices y G. fasciculatum en el sustrato 1 (grupos F y C, respectivamente), como los de mejor comportamiento. Es importante señalar, además, que la inoculación de cada cepa o concentrado de especies de HMA presentó los mayores efectos cuando las plantas crecieron precisamente en el sustrato 1.
Un comportamiento interesante fue el mostrado por G. fasciculatum (Figura 3), el cual además de ejercer sus mayores efectos sobre las plantas que se desarrollaron en el sustrato 1, presentó también un buen comportamiento en el sustrato 2 (grupo A-8-).
Como puede apreciarse en las Figuras 4 y 5, los análisis de varianza realizados a las variables que mostraron mayores coeficientes de correlación con las componentes y que consecuentemente estaban más relacionadas entre sí, corroboraron, en sentido general, los análisis previos realizados y dejaron claro el efecto diferenciado de las cepas y los sustratos, así como de la interacción entre ambos factores.En la Figura 4 se observa que el porcentaje de densidad visual no solo logró diferenciar mejor el efecto de los sustratos que el porcentaje de colonización, sino que también el ordenamiento de los mejores tratamientos basado en la docimación (G. intraradices-S1, G. fasciculatum-S1 y S2 y concentrado de selva-S1) mostró mayor similitud con el realizado por el análisis multivariado, que el obtenido con en el porcentaje de colonización (G. fasciculatum-S2, concentrado de selva-S1 y G. intraradices-S1).
De igual forma que en las variables antes explicadas, los mayores valores de tasa fotosintética se encuentran en los tratamientos inoculados, los cuales muestran respuestas diferenciadas en función de las cepas empleadas y los sustratos (Figura 5); en este caso, el tratamiento 2 (G. fasciculatum-S1) es el que presenta el mayor valor. En el caso de la EUA, no se observan grandes diferencias entre los distintos tratamientos; sin embargo, sus valores sí son superiores a los de los controles en ambos sustratos.
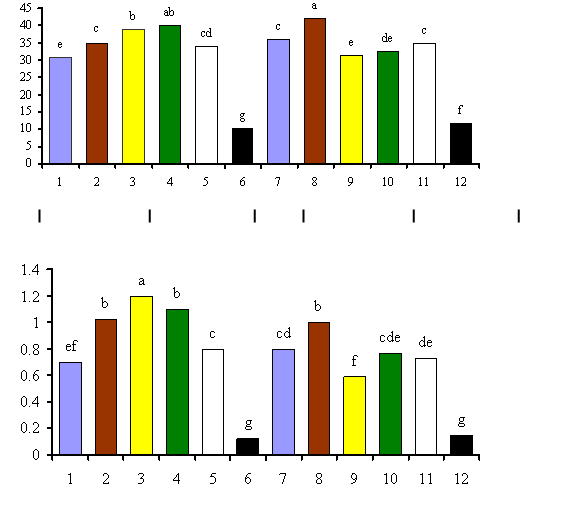
Figura 4. Efecto de la aplicación de diferentes inoculantes micorrízicos y sustratos sobre plántulas de papa expresado en las variables fúngicas Colonización (A) y Densidad Visual (B)
Leyenda: 1 y 7: G. clarum; 2 y 8: G. fasciculatum; 3 y 9: G. intraradices; 4 y 10: Selva; 5 y 11: Desierto y 6 y 12: Controles Sustrato 1: Sunshine # 3 Sustrato 2: Sunshine # 3 + Vermiculita (2:1) Barras con letras desiguales difieren entre si significativamente para p≤ 0.05 según Test de Tuckey Como consecuencia de la integración de los métodos multivariados y análisis de varianza realizados a las variables que mayor influencia ejercieron sobre la conducta de los tratamientos, se obtuvo que las cepas y los concentrados de especies empleados se comportaron de la siguiente forma: G. intraradices-S1>G fasciculatum-S1>G. fasciculatum-S2 y concentrados de especies de selva y desierto ambos en el sustrato 1 (Sunshine no. 3).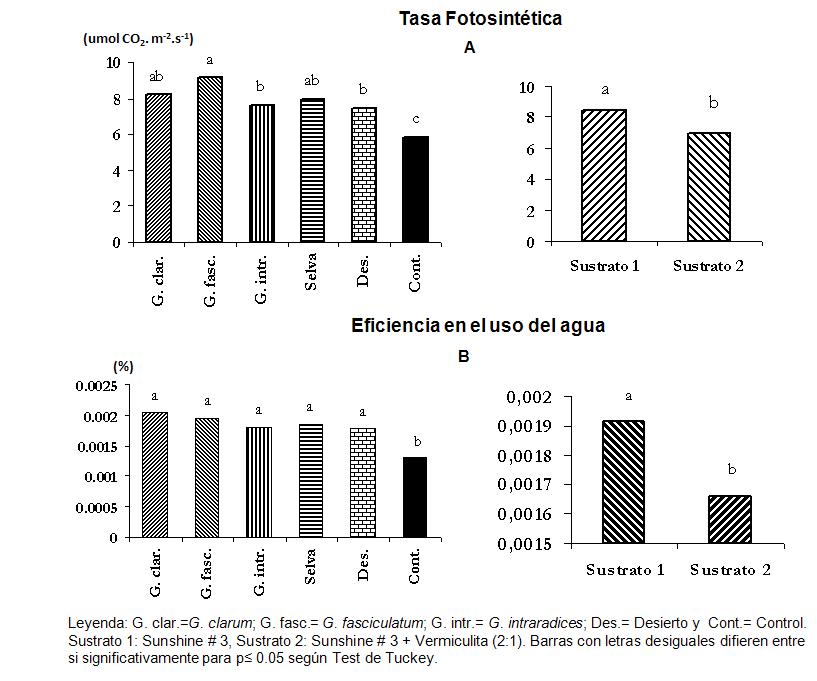
Figura 5. Efecto de la aplicación de diferentes inoculantes micorrízicos y sustratos sobre plántulas de papa expresado en las variables fisiológicas tasa fotosintética (A) y eficiencia en el uso del agua (B). Leyenda: G. clar.=G. clarum; G. fasc.= G. fasciculatum; G. intr.= G. intraradices; Des.= Desierto y Cont.= Control
Sustrato 1: Sunshine # 3 Sustrato 2: Sunshine # 3 + Vermiculita (2:1) Barras con letras desiguales difieren entre si significativamente para p≤ 0.05 según Test de Tuckey
Discusión
Algunos actualmente emplean el sistema de cultivo tripartita (18, 26, 27), para establecer la micorrización durante el estadio in vitro de la micropropagación de las plantas, utilizando como inóculo el cultivo de raíces transformadas o no, previamente inoculadas con hongos micorrizógenos; sin embargo, el principal reto de este estudio fue poder lograr la micorrización de plantas completas en condiciones in vitro utilizando esporas germinadas como propágulos, teniendo en cuenta las dificultades que presentan estos hongos para desarrollarse en medios de cultivo y la falta de autotrofia de las plantas en estas condiciones.
La definición de los medios de cultivo adecuados para el desarrollo exitoso de ambos organismos es una de las etapas más críticas del proceso y depende en gran medida de las especies utilizadas en cada caso.
Bioensayos realizados previamente a la ejecución de este experimento (datos no incluidos en el documento), en el cual se inocularon plántulas de papa en el medio de propagación MS, sugirieron claramente la necesidad de realizar un cambio de medio antes del establecimiento del cultivo dual, aspecto ya informado anteriormente (18, 26, 27), al no garantizarse el crecimiento adecuado del hongo en estas condiciones, pues este medio contiene altas concentraciones de sulfato de sodio, fósforo y sacarosa, las cuales influyen negativamente sobre el establecimiento micorrízico in vitro. Esto fue corroborado por Bressan (28), quien al inocular embriones de boniato (Ipomoea batata) con esporas de Glomus etunicatum sobre diferentes medios de cultivo (MS y White), encontró respuestas diferenciadas de la colonización en función de las concentraciones de nutrientes en los medios y comprobó que cuando se adicionaba sacarosa (3 %) al medio, se producía un efecto depresor sobre el crecimiento hifal y la colonización radical.
El crecimiento atrofiado de las plantas crecidas en medio N pudo haber sido provocado por la interacción entre los componentes del nuevo medio y la vermiculita presente. Como es conocido, las vermiculitas son arcillas con capacidad de intercambio catiónico extremadamente alta (100-260 meq.100 g-1) y se expanden y contraen con gran facilidad, secuestrando gran número de iones entre sus capas (29), lo cual pudo haber ocurrido en este caso al reaccionar con el agar presente en el medio y provocar que los iones quedaran atrapados, ocasionando la indisponibilidad de los nutrientes.
Por otra parte, en presencia de pH ácido, como es el caso (5.5), algunas cantidades de Al3+ y Fe3+, que forman parte de las arcillas, pasan a solución y pueden reaccionar con el escaso fósforo presente en el medio N, el cual contenía una baja concentración de macronutrientes y en especial de este elemento, formando fosfatos insolubles de hierro y aluminio y que, indudablemente, disminuyeron aún más la concentración de fósforo a disposición de las plántulas en crecimiento.
El empleo de vermiculita para tales fines ya ha sido informado (32), los que estudiaron la respuesta de embriones somáticos de boniato a la micorrización con esporas germinadas de Glomus etunicatum,colocando los embriones previamente inoculados en tubos que contenían, además de medio White, una mezcla de vermiculita + arena estéril. En contraste con los resultados presentados en este trabajo, ellos reportaron un efecto estimulador de la micorrización sobre el desarrollo de los embriones inoculados, debido probablemente a que los componentes presentes en el medio White, mucho más rico, no resultaron limitantes para las plantas al interactuar con la vermiculita.
Además de este efecto sobre el crecimiento de las plantas, se encontró un marcado cambio de coloración solo en los tratamientos inoculados con el HMA. Por las características que presentó la afección, no parece estar relacionada con ninguna deficiencia nutricional simple, pues las variaciones de color observadas y el estado de las plantas no coinciden con ninguno de los síntomas provocados por el déficit individual de los elementos esenciales en el cultivo de la papa (33). No obstante, si bien esta modificación pudiera atribuirse a deficiencias de fósforo por la presencia de coloración purpúrea en las hojas y el hecho de ser encontrada como sintomatología típica en otros cultivos como la col (Brassica oleracea) y el colinabo (Brassica napus), no se reporta en el caso específico de la papa (33, 34).
Otros se refirieron a los efectos que provoca la deficiencia nutricional de cada elemento de forma independiente (35), pero no informaron sobre los síntomas que podrían ocasionar la ausencia o el déficit de más de uno de ellos, de lo cual indudablemente pueden resultar patrones más complejos y no ajustarse exactamente a los síntomas individuales.
La marcada reducción del crecimiento y la delgadez de los tallos sí pudiera ser atribuida a la falta de fósforo principalmente y, en consecuencia, se pronuncian los que señalan que la deficiencia de este elemento en plantas de papa podría ocasionar el crecimiento reducido, los tallos delgados y el oscurecimiento de las hojas (33, 35).
Por otra parte, las determinaciones de clorofila a, b y total realizadas a las plantas micorrizadas en el medio N y a sus homólogas sin micorrizar, tampoco arrojaron resultados que relacionaran la presencia de esta coloración con algún efecto producido sobre este pigmento, en especial por acción de la micorrización. De acuerdo con los resultados (Tabla II) y la información consultada, se considera como muy probable que se trate de una deficiencia múltiple de elementos, lo cual ocasiona, indudablemente, una sintomatología más compleja.
Cuando se analizan los resultados, la segunda fase del experimento, en el cual se introduce el medio M como sustrato para ambos organismos, se observa nuevamente el efecto diferenciado de los tratamientos sobre el desarrollo de las plántulas, aunque se aprecia un efecto positivo de la inoculación sobre las plantas que crecieron sobre este medio.
Precisamente, la mayoría de las publicaciones (12, 18, 26, 27), en las que se informan efectos positivos de la micorrización sobre vitroplantas, se refieren a cultivos tripartitas establecidos sobre el medio M, en los que se emplean cultivos de raíces (transformadas o no) sobre las cuales se desarrolla previamente la colonización micorrízica.
Sin embargo, resulta extremadamente interesante destacar el efecto beneficioso de la micorrización puesto de manifiesto en esta fase, en la cual las plantas de papa micorrizadas alcanzaron valores en las variables estudiadas, similares a los controles sobre el medio MS y mostraron una mayor relación raíz/tallo, a pesar de los bajos contenidos nutricionales que caracterizan el medio M (12).
Los efectos encontrados in vitro pueden asociarse a los efectos nutricionales favorables vinculados con la asociación simbiótica e informados in vivo, aunque también puede verse reflejado un efecto hormonal y/o fisiológico de las especies micorrízicas sobre las plantas que colonizan.
Los resultados coinciden con los reportados anteriormente (18), que encontraron efectos estimuladores de la micorrización sobre plántulas de fresa, expresados en una mayor altura y el largo radical de las plantas inoculadas, así como una reducción del potencial osmótico, lo cual podría representar una importante condición preadaptativa para enfrentar el déficit hídrico, que encuentran al ser transferidas a la fase de aclimatización, al aumentar en cierto grado la hidratación de las hojas.
En otro estudio de inoculación, realizado con vitroplantas de cafeto (Coffea canephora var. Robusta) obtenidas por embriogénesis somática, se encontró, además del efecto sobre el crecimiento, una estimulación en la formación de callos embriogénicos en las plantas inoculadas, asociada con alguna liberación de hormonas estimuladoras por parte de los hongos micorrízicos (13).
Por otra parte, la introducción de HMA como inoculante en la fase adaptativa de la micropropagación de plantas ha tomado auge en los últimos años, involucrando un gran número de cultivos de interés económico (12).
Desde el punto de vista de un manejo eficiente de los HMA, en este y en cualquiera de los otros sistemas de cultivo en que se aplican, uno de los aspectos decisivos resulta la dependencia que existe entre la eficiencia de los hongos micorrizógenos y la riqueza nutricional del sustrato, definida por sus componentes. Indiscutiblemente, el empleo de este sustrato permitió no solo el exitoso desarrollo y establecimiento de la asociación micorrízica, expresado en cada una de las variables estudiadas, sino que también garantizó, conjuntamente con la micorrización, el adecuado crecimiento y la adaptación de las plántulas.
La efectividad de las cepas de HMA está ligada a la riqueza del sustrato, por lo que el hecho de que las cepas utilizadas presentaran un mayor efecto en los tratamientos sin vermiculita sugiere o indica que la disminución de los nutrientes provocada por la mezcla con este sustrato limitó en alguna medida el suministro de nutrimentos para las plantas micorrizadas, originando un comportamiento diferenciado de las cepas en función del sustrato empleado: Glomus intraradices (sustrato 1)>G. fasciculatum (sustrato 1)>G. fasciculatum (sustrato 2)>concentrado de especies de selva y desierto (sustrato 1).
De forma general, la micorrización resulta eficiente cuando las plantas se desarrollan en condiciones de suministro subóptimo de nutrientes con respecto a plantas no micorrizadas (36, 37, 38), de manera que exista una ganancia neta para la planta con esta asociación y que la energía y los productos del metabolismo de la planta, que son utilizados para el desarrollo de la micorriza, sean largamente retribuidos a través de los incrementos en absorción y en la tasa de crecimiento neto (39).Dentro de las especies pertenecientes al Orden Glomales, existen marcadas diferencias en cuanto a su distribución en los ecosistemas y a la eficiencia de sus mecanismos de colonización (40). Precisamente, las especies que pertenecen al género Glomus poseen, de manera general, un amplio rango de distribución funcional, predominando en ecosistemas de alta y media fertilidad, en los cuales resultan extremadamente eficientes y competitivas (39, 40).
En estudios realizados en posturas de cafeto sobre diferentes tipos de suelos y combinaciones de sustratos empleando gran número de cepas de HMA (39, 40) se encontró, igualmente, que en cualquiera de los suelos estudiados los mejores efectos sobre el crecimiento de las plantas estuvieron relacionados con las cepas pertenecientes al género Glomus y que también el efecto de las cepas individuales fue mayor en relación con los concentrados de especies (41).
Por otra parte, las variables fúngicas de porcentajes de colonización y densidad visual reflejaron ampliamente el comportamiento micorrízico; no obstante, la segunda logró realizar una mejor diferenciación del efecto de los sustratos, lo cual resulta lógico si tenemos en cuenta que la colonización cuantifica solamente la presencia del hongo en la raíz y no su intensidad.
Resulta de gran importancia el papel que pueden jugar estos microorganismos sobre el estado fisiológico y nutricional de las plantas colonizadas (42, 43). Su impacto en este sistema de cultivo responde a su capacidad de colonizar ampliamente el sistema radical, participando activamente en la absorción de los diferentes nutrientes (macro y micronutrientes) y el agua.
Por cada metro de raíz colonizada se producen entre 7 y 250 m de hifas externas de HMA (43), dependiendo de la especie implicada y las condiciones de crecimiento.El micelio extramatrical ha mostrado ser capaz de captar muy eficazmente agua y nutrientes (44), en especial fósforo (45), nitrógeno (46) y actualmente se reconoce el efecto directo de las micorrizas sobre la absorción de prácticamente todos los elementos esenciales minerales (47), a partir de estructuras captadoras de nutrimentos muy similares a los arbúsculos intraradicales (48). En este caso en particular, la micorrización eficiente de las plantas de papa provocó incrementos en las variables fisiológicas estudiadas, producto no solo de una mayor absorción del fósforo y otros nutrientes, sino también por incrementar la fuerza de la raíz y el sistema aéreo como sitios de consumo, y garantizar una mayor absorción y retención del agua en los tejidos de las plántulas inoculadas.
En consecuencia, se ha manifestado que la micorrización de los sistemas radicales de las plantas tiene un efecto positivo sobre la asimilación del carbono, especialmente en condiciones de estrés (49, 50, 51).
Primeramente, existen evidencias de que la fotosíntesis puede ser regulada por la fortaleza de los sumideros o sitios de consumo, como determinadas estructuras de almacén, frutos u otros órganos (52). Un segundo mecanismo puede ser a través de incrementos en la nutrición de la planta, mediante lo cual el hongo puede incrementar la tasa fotosintética de su hospedero.
En relación con el fósforo específicamente, se plantea que los niveles de Pi citoplasmático en la hojas regulan la exportación del carbono y, por tanto, la fotosíntesis a través del translocador de triosa -P/Pi que se encuentra en la membrana cloroplástica. Los bajos niveles de Pi permiten reconstituir el almidón en los cloroplastos, lo cual puede disminuir la tasa fotosintética (51). Por otra parte, las relaciones con el agua también pueden verse afectadas a causa de la colonización micorrízica, al presentar las plantas micorrizadas mayores valores de conductancia estomática y potencial de agua de las hojas en condiciones de estrés (50). Las hifas son capaces de absorber agua a potenciales más bajos que los pelos radicales, lo que provoca una mayor absorción del agua y, por tanto, que las plantas micorrizadas tengan mayores tasas fotosintéticas y contenidos de agua que las no micorrizadas.Los mecanismos involucrados aún no están totalmente dilucidados; no obstante, las hipótesis elaboradas al respecto relacionan diferentes aspectos, como son: efectos indirectos a partir de incrementos en la absorción de P; aumentos en la toma de agua a través de los sistemas micorrizados, ya sea por incrementos en la conductividad hidráulica de la raíz o por variación de su arquitectura; modificaciones bioquímicas en la regulación del agua en la planta hospedera por cambios en las señales hormonales o una inducción de respuestas osmorreguladoras de las plantas inoculadas comparadas con los controles (26, 50).
En un trabajo similar empleando vitroplantas de guayaba (Psidium guajava) micorrizadas, se concluyó que la tasa fotosintética de las plantas inoculadas incrementó como consecuencia de su estado nutricional, refiriendo que el incremento pudo haber ocurrido independientemente de los niveles de fósforo (47).
En los estudios de inoculación ex vitro, las plantas de papa mostraron una alta respuesta a la inoculación con las diferentes cepas y los concentrados de especies de HMA dependientes de los sustratos empleados. Los mejores tratamientos de micorrización fueron los siguientes: G. intraradices y G fasciculatum, en el sustrato 1, seguidos por G. fasciculatum en el sustrato 2 y los concentrados de especies de selva y desierto en el sustrato 1.
El efecto positivo de la inoculación micorrízica se expresó a través de incrementos en la colonización y densidad visual, así como en el resto de las variables estudiadas, tanto fisiológicas como nutricionales y de crecimiento.REFERENCIAS
- Struik, P. C. y Wiersema, S. G. Seed potato technology. Wageningen: Wageningen Press, 1999. 383 p. ISBN 90-74134-65-3.
- Jackson, A. J.; Walters, D. R. y Marshall, G. Antagonistic interactions between the foliar pathogen Botrytis fabae and isolates isolates of Penicillium brevicompactum and Clamidosporum cladosporioides on faba beans. Biological Control, 1997, vol. 8, no. 2, p. 97-106.
- Nowak, J. Benefits of in vitro “biotization” of plant tissue cultures with microbial inoculants. In vitro Cell. Dev. Biol. Plant. 1998, vol. 34, no. 2, p. 122-130.
- Vestberg, M.; Kukkonen, S.; Saari, K. et al. Microbial inoculation for improving the growth and health of micropropagated strawberry. Applied Soil Ecology, 2004, vol. 27, no. 3, p. 243-258.
- Finlay, R. D. Mycorrhizal fungi and their multifunctional roles. Mycologist, 2004, vol. 18, no. 2, p. 91-96.
- Song, H. Effects of VAM on host plant in the condition of drought stress and its mechanisms. Electronic Journal of Biology, 2005, vol. 1, no. 3, p. 44-48.
- Rillig, M. C. y Mummey, D. L. Mycorrhizas and soil structure. New Phytologist [online] 2006, vol. 171, p. 41-53.
- Vosátka, M.; Jansa, J.; Regvar, M.; Šramek, F. y Malcová, R. Inoculation with mycorrhizal fungi -a feasible biotechnology for horticulture. Phyton, 1999, vol. 39, p. 219-224.
- Rai, M. K. Current advances in mycorrhization in micropropagation. In Vitro Cellular & Developmental Biology–Plant, 2001, vol. 37, no. 2, p. 158-167.
- Wang, H.; Parent, S.; Gosselin, A. y Desjardins, Y. Vesicular-arbuscular mycorrhizal peat-based substrates enhance symbiosis establishment and growth of three micropropagated species. J. Am. Soc. Hort. Sci., 1993, vol. 118, no. 6, p. 896-901.
- Hause, B. y Fester, T. Molecular and cell biology of arbuscular mycorrhizal symbiosis. Planta, 2005, vol. 221, p. 184–196.
- Fortin, J. A.; Bécard, G.; Declerck, S. et al. Arbuscular mycorrhiza on root-organ cultures. Can. J. Bot., 2002, vol. 80, p. 1-20.
- Fernández, K.; Fernández, F.; González, M. E. Micorrización in vitro de plántulas de Coffea canephora Var Robusta: ¿Una realidad?. Cultivos Tropicales, 2002, vol. 23, no. 3, p. 47-52.
- Bressan, W. Factors affecting in vitro plant development and root colonization of sweet potato by Glomus etunicatum Becker y Gerd. Brazilian Journal of Microbiology, 2002, vol. 33, no. 1, p. 31-34.
- Murashige, T. y Skoog, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant, 1962, vol. 15, p. 473-497.
- Bécard, G. y Fortín, J. A. Early events of vesicular arbuscular mycorrhiza formation on Ri-T-DNA transformed roots. New Phytol., 1988, vol. 108, p. 211-218.
- Aguado, S. A. Desarrollo de sistemas para el cultivo de tejidos in vitro y transformación genética de la gramínea forrajera Bouteloa gracilis (H.B.K.) Lag. Ex Steud. Tesis en opción al Grado Científico de Doctor en Ciencias, CINVESTAV. 2001.
- Elmeskaoui, A.; Damont, J. P. y Piché, Y. A culture system for endomycorrhizal inoculation of micropropagated strawberry plantlets in vitro. Mycorrhiza, 1995, vol. 5, p. 313-319.
- Hewitt, E. J. Sand and water culture methods used in the study of plant nutrition. 2nd. Ed. Rev. Farnham Royal, England: Commonwealth Agricultural Bureaux, 1966. 547 p. [Technical communication (Commonwealth Bureau of Horticulture and Plantation Crops (Great Britain)); no. 22].
- Phillips, J. M. y Hayman, D. E. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br Mycol. Soc., 1970, vol. 55, p. 158-161.
- Giovanetti, M. y Mosse, B. An evaluation of techniques to measure vesicular-arbuscular infection in roots. New Phytologist, 1980, vol. 84, p. 489-500.
- Trouvelot, A.; Kough, J. y Gianinazzi‑Pearson, V. Mesure du Taux de Mycorhization VA d'un Systeme Radiculaire. Recherche de Methodes d' Estimation ayantune Signification Fonctionnelle. In: Gianinazzi‑Pearson, V. & Gianinazzi, S. (Eds.) Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae, Dijón, 1‑5 July, 1985. París: INRA, 1986. p. 217-222.
- Paneque, V. M. Manual de técnicas analíticas para el análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos. La Habana: INCA, 2002. 130p
- Varela, M. Análisis multivariados de datos: aplicación a las ciencias agrícolas. La Habana: Ediciones INCA, 1998. 55 p. ISBN: 959-7023-04-0.
- Lerch, G. La experimentación en las Ciencias Biológicas y Agrícolas. La Habana: Editorial Ciencia y Técnica. 1977. 452 p.
- Hernández-Sebastia, C.; Piché, Y. y Desjardins, Y. Water relations of whole strawberry plantlets in vitro inoculated with Glomus intraradices in a tripartite culture system. Plant Science, 1999, vol. 143, no.1, p. 81-91.
- Koide, R. y Mosse, B. A history of research on arbuscular mycorrhiza. Mycorrhiza, 2004, vol. 14, no.3, p. 145–163.
- Louche-Tessandier, D.; Samson, G.; Hernández-Sebastia, C. et al. Importance of light and CO2 on the effects of endomycorrhizal colonization on growth and photosynthesis of potato plantlets (Solanum tuberosum) in an in vitro tripartite system. New Phytol., 1999, vol. 142, p. 539-550.
- Grim, R. E. Clay Mineralogy. 2nd ed. UK: McGraw-Hill Companies, 1968. 596 p. ISBN: 0070248362.
- Daniels, B. A. y Menge, J. A. Hyperparasitism of vesicular arbuscular mycorrhiza fungi. Phytopathology 1980, vol. 70, no. 7, p. 584-588.
- Fernández, F.; Cañizares, E; Orozco, M. O. Influencia de la fertilización fosfórica y la aplicación de enmiendas calcáreas y orgánicas sobre la producción de micelio externo vesículo arbuscular en un cafetal joven. En: VII Seminario Científico. Memorias. La Habana: INCA, 1990, Vol. 1. p. 185-194.
- Bressan, W.; Siqueira-de-Carvalho, C. H. y Sylvia, D. M. Inoculation of somatic embryos of sweet potato with an arbuscular mycorrhizal fungus improves embryo survival and plantlet formation. Canadian Journal of Microbiology; 2000, vol. 46, no. 8, p. 741-743.
- Wallace, T. Lasdeficiencias mineralesen lasplantas: su diagnóstico a través de los síntomas visuales. Barcelona: Editorial Ariel, 1970. 169 p.
- IICA. Vademecum del cultivo de la papa. Federación Colombiana de productores de papa (FEDEPAPA), 2004. 172 p.
- Zagg, D. E. van der, Asscheman, E., Brinkman, H., et al. (Eds.) Potato diseases. The Netherlands: NIVAA, 1996. 179 p. ISBN 90-802036-2-9.
- Marschner, H. y Dell, B. Nutrient uptake in mycorrhizal symbiosis. Plant and Soil, 1994, vol. 159, no.1, p. 89-102.
- Sieverding, E. Vesicular arbuscular mycorrhiza in tropical agrosystem. Eschborn: Deutsche Gesellschaft für Technische Zusammenarbeit (GTZ), 1991. 371 p. ISBN: 3 88085 462 9.
- Barros, A. Micorrizas vesículo-arbusculares em cafeiros da regiao sul do estado de Minas Gerais. Tesis presentada para optar por maestría. Lavras. Minas Gerais. 97 p. 1987.
- Fernández, F. Uso y manejo de las asociaciones micorrízicas y las rizobacterias en la producción de posturas de cafeto. [Tesis en opción al Grado Científico de Doctor en Ciencias Agrícolas] La Habana: INCA. 1999. 145 p.
- Sánchez, C. Uso y manejo de los hongos micorrizógenos y abonos verdes en la producción de posturas de cafeto en algunos suelos del macizo Guamuhaya. [Tesis en opción al Grado Científico de Doctor en Ciencias Agrícolas]. La Habana: INCA, 2001. 105 p.
- Davies, F. T.; Estrada-Luna, A. A.; Finnerty, T. L. et al. Applications of mycorrhizal fungi in plant propagation system. En: Alarcón A., Ferrera-Cerrato R. (Eds.). Ecología, fisiología y biotecnología de la micorriza arbuscular. México D.F.: Mundi Prensa, 2000. p. 129-146.
- Yao, M. K.; Tweddell, R. J. y Desilets, H. Effect of two vesicular-arbuscular mycorrhizal fungi on the growth of micropropagated potato plantlets and on the extent of disease caused by Rhizoctonia solani. Mycorrhiza, 2002, vol. 12, no. 5, p. 235-242.
- Smith, S. E. y Read, D. J. Mycorrhizal Symbiosis, 2nd ed. London: Academic Press, 1997. 605 p. ISBN: 0 12 652840 3.
- George, E.; Marschner, H. y Jackobsen, I. Role of arbuscular-mycorrhizal fungi in uptake of phosphorus and nitrogen form soil. Critical Reviews in Biotechnology, 1995, vol. 15, nos. 3-4, p. 257-270.
- Carreón, Y., Ballesteros, L., Salgado, R. y Alarcón, A. Inoculación de hongos micorrízicos arbusculares en plantas de zarzamora (Rubus sp.) micropropagadas. En: Alarcón A., Ferrera-Cerrato R. (Eds.). Ecología, fisiología y biotecnología de la micorriza arbuscular. México D. F.: Mundi Prensa, 2000. p. 141-148. 2000.
- Ruiz, L. Efectividad de las asociaciones micorrízicas en especies vegetales de raíces y tubérculos en suelos pardos con carbonatos y Ferralíticos Rojos de la región central de Cuba. [Tesis en opción al Grado Científico de Doctor en Ciencias Agrícolas] La Habana: INCA, 2001. 117 p.
- George, E. Nutrient uptake. En: Kapulnik, Y. & David, D. (Eds.) Arbuscular mycorrhizal: Physiology and function. The Netherlands: Kluwer Academic Publisher, 2000. p. 307-343 ISBN: 0-7923-6444-9.
- Bago, B.; Azcón-Aguilar, C. y Shachar-Hill, Y. El micelio externo de la micorriza arbuscular como puente simbiótico entre la raíz y su entorno. En: Alarcón A., Ferrera-Cerrato R. (Eds.). Ecología, fisiología y biotecnología de la micorriza arbuscular. México D. F.: Mundi Prensa, 2000. p. 78-92.
- Shrestha, Y. H.; Ishii, T. y Kadoya, K. Effects of vesicular-arbuscular mycorrhyzal fungi on the growth, photosynthesis, transpiration and the distribution of photosynthates of bearing Satsuma mandarin trees. J. Japan Soc. Hort. Sci. [online], 1995, vol. 64, no.3, p. 517-525.
- Porcel, R. y Ruiz-Lozano, J. M. Arbuscular mycorrhizal influence on leaf water potential, solute accumulation, and oxidative stress in soybean plants subjected to drought stress. Journal of Experimental Botany [online], 2004, vol. 55, no. 403, p. 1743-1750.
- Douds, D. D. J.; Pfeffer, P. E. y Shachar-Hill, Y. Carbon partitioning, cost, and metabolism of arbuscular mycorrhizas. En: Kapulnik, Y. y David, D. (Eds.) Arbuscular mycorrhizal: Physiology and function. The Netherlands: Kluwer Academic Publisher. 2000, p. 107-130 ISBN: 0-7923-6444-9.
- Wright, D. P.; Read, D. J. y Scholes, J. D. Mycorrhizal sink strength influences whole plant carbon balance of Trifolium repens L. Plant Cell Environ., 1998, vol. 21, no. 9, p. 881-891
Recibido: 3 de noviembre de 2009
Aceptado: 18 de diciembre de 2009













