Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão impressa ISSN 0375-0760versão On-line ISSN 1561-3054
Rev Cubana Med Trop v.57 n.2 Ciudad de la Habana maio-ago. 2005
Artículos originales
Universidad de Los Andes, Mérida, Venezuela
Ministerio de Sanidad y Asistencia Social, Caracas, Venezuela
Instituto de Medicina Tropical "Pedro Kourí"
Factores de virulencia asociados a la enteropatogenicidad en cepas de Aeromonas spp. aisladas de niños con diarrea en Mérida, Venezuela
Lic. Aurora Longa,1 Lic. Luisa Vizcaya,1 Dra. Beatriz Nieves,2 Lic. Laura Bravo,3 Lic. Luis Morier,4 Dra. Irene Pérez-Schael5 y Dr. Luis Enrique Cabrera6
Resumen
Se estudiaron las heces de 397pacientes con enfermedad diarreica aguda, y las de 121 pacientes sin diarrea que conformaron el grupo control , e n el estado de Mérida, Venezuela , entre junio de 1993 y diciembre de 1994. El género Aeromonas fue identificado en los pacientes con enfermedad diarreica aguda en 11,83 % y 5,78 % se identific ó en los pacientes del grupo control. Al estudiar los factores de virulencia descritos para Aeromonas (enterotoxina, citotoxina, hemaglutininas, hidrofobicidad celular y actividad hemolítica) en las cepas aisladas, se detectó que todas poseían al menos uno de los factores investigados asociados a la enteropatogenicidad. De las especies aisladas, Aeromonas caviae result ó ser la que se identific ó con mayor frecuencia. Todos estos resultados sugieren que las especies de Aeromonas son patógenos entéricos potenciales en e sta población.
Palabras clave : Aeromonas , d iarrea, factores de virulencia.
Las especies del género Aeromonas se consideran patógenos oportunistas, también se han asociado con una gran variedad de infecciones, luego de una exposición a aguas o suelos que contengan estas bacterias. En los últimos años estos organismos han adquirido importancia como patógenos entéricos,1 además de poseer una taxonomía muy compleja por la gran heterogeneidad genética constitutiva de este género.2
La diarrea asociada a Aeromonas ocurre comúnmente en niños menores de 5 años, ancianos y pacientes inmunocomprometidos.3,4
Se ha observado un incremento de aislamiento de Aeromonas en los meses de verano y las cepas de pacientes sintomáticos usualmente presentan propiedades de virulencia, como capacidad de producir enterotoxinas, citotoxinas, hemolisinas y una gran variedad de enzimas o habilidades de invasión, o ambas. La combinación de los factores de virulencia bacterianos, así como también el estado inmunológico del huésped, pueden ser necesarios para que se produzca la infección gastrointestinal.5,6
Las proteínas activamente biológicas producidas por las Aeromonas móviles incluyen hemolisinas, citotoxinas y enterotoxinas, que es considerado como el factor de virulencia más asociado con el cuadro diarreico. De igual forma se le ha descrito a este género bacteriano una importante capacidad de adhesión e invasión.7 Aunque todos estos factores de virulencia son codificados en el nivel cromosomal, también se ha reportado la presencia de plásmidos que le pueden conferir factores de patogenicidad y aumentar así su virulencia.8
Aunque estas propiedades de patogenicidad se asemejan a las de Escherichia coli y Vibrio cholerae, el papel de las exotoxinas en la patogénesis de la infección por Aeromonas permanece sin esclarecer.9,10
Por todo esto, el presente estudio se realizó con el propósito de investigar la incidencia y significación de las especies de Aeromonas en pacientes con diarreas aguda en el estado de Mérida, Venezuela.
Métodos
Durante un período de 18 meses (junio de 1993 a diciembre de 1994), en el Laboratorio de Síndromes Gastrointestinales se analizaron muestras de heces o hisopados rectales de 397 pacientes con enfermedad diarreica aguda para investigar la presencia de Aeromonas sp., así como también la de otros enteropatógenos bacterianos como Vibrio, Salmonella spp., Escherichia coli enteropatógena, enteroinvasiva, enterotoxigénica y enterohemorrágica, Yersinia sp. De igual forma también fueron investigados Rotavirus y parásitos (Entamoeba histolytica, Giardia lamblia y Cryptosporidium). (Urrestarazu M, González R. Manual de técnicas. Taller sobre diagnóstico de laboratorio de agentes productores de diarrea. Caracas - Venezuela. 1993).
Todos los pacientes con enfermedad diarreica aguda (EDA) n= 397 y el grupo control n= 121 (niños sin EDA) fueron admitidos sobre las bases y criterios del Proyecto Nacional de Diarrea. CONICIT MPS - RP -IV - 140031. Venezuela.
La mayoría de los pacientes eran menores de 5 años y pertenecían a un bajo nivel socioeconómico. La investigación fue realizada con el comité de ética social y el consentimiento de los padres o tutores.
Las muestras de heces se recibieron en cajas estériles y los hisopados rectales en medio de transporte Cary Blair, procesándose dentro de las 2 h posteriores a la recolección (Urrestarazu M, González R. Manual de técnicas. Taller sobre diagnóstico de laboratorio de agentes productores de diarrea. Caracas - Venezuela. 1993).
Aislamiento e identificación de las cepas de Aeromonas
Todas las muestras fueron sembradas directamente sobre las placas de Agar McConkey, Agar Shigella-Salmonella y Agar DNA. Se hicieron subcultivos en los mismos agares después del enriquecimiento en caldo Selenito de 6-8 h (pH 7,4) a 37 °C. La identificación presuntiva del género Aeromonas se realizó por los métodos bioquímicos convencionales,11 y hasta nivel de especie siguiendo el esquema propuesto por Abbott.12 Todas las cepas fueron analizadas para observar su producción enzimática (beta hemolisina, gelatinasa, lecitinasa, DNasa). Para determinar la actividad hemolítica las cepas fueron sembradas en agar sangre, incubadas a 37 °C por 48 h, para la actividad proteolítica se sembraron en agar gelatina nutriente y yema de huevo para observar producción de gelatinasa y lecitinasa respectivamente y en agar DNA para la producción de DNAsa e incubados a 37 °C por 48 h.11
Aislamiento de otros patógenos
Todas las muestras fueron sembradas en Agar McConkey, Agar Salmonella - Shigella, Agar tiosulfato-citrato-novobiocina y en el medio Preston modificado.
Todos los medios excepto el Preston fueron incubados a 37 °C por 24 h. Este último se incubó en frasco con vela a 42 °C por 48 h. (Urrestarazu M, González R. Manual de técnicas. Taller sobre diagnóstico de laboratorio de agentes productores de diarrea. Caracas - Venezuela. 1993).
Los parásitos y rotavirus fueron investigados según los procedimientos de rutina para cada uno. (Urrestarazu M, González R. Manual de técnicas. Taller sobre diagnóstico de laboratorio de agentes productores de diarrea. Caracas-Venezuela. 1993).
Determinación de factores de virulencia
En este estudio, el total de cepas fueron sometidas a los ensayos siguientes: prueba de agregación salina (SAT o salting out), según la técnica descrita por Lindahl y otros;13,14 prueba de hemaglutinación (HA) e inhibición de la hemaglutinación con manosa, según Nishikawa y otros;15 Determinación de la actividad hemolítica (microtitulación de hemolisina [HL]) según Burke y otros, citado por Deodhar y otros;6 determinación de citotoxina (CT) y enterotoxina (ET) en células Vero por Vadivelu y otros.10
Para el análisis estadístico se aplicó el test de diferencias de proporciones para ver la significación estadística de los resultados obtenidos.16
Resultados
Se recuperaron Aeromonas en 11,83 % de los 397 niños con EDA y en 5,78 % de los 121 niños pertenecientes al grupo control. Fueron encontrados como patógenos únicos en 38,29 %. La especie más aislada fue Aeromonas caviae.
En relación con las especies identificadas 23 resultaron ser Aeromonas caviae; 16 Aeromonas hydrophila; 2 Aeromonas trota y 1 Aeromonas veronii bv. sobria.
Como patógenos únicos se aislaron 13 Aeromonas, Aeromonas aisladas junto a otros enteropatógenos 25, Aeromonas aisladas del grupo control 4.
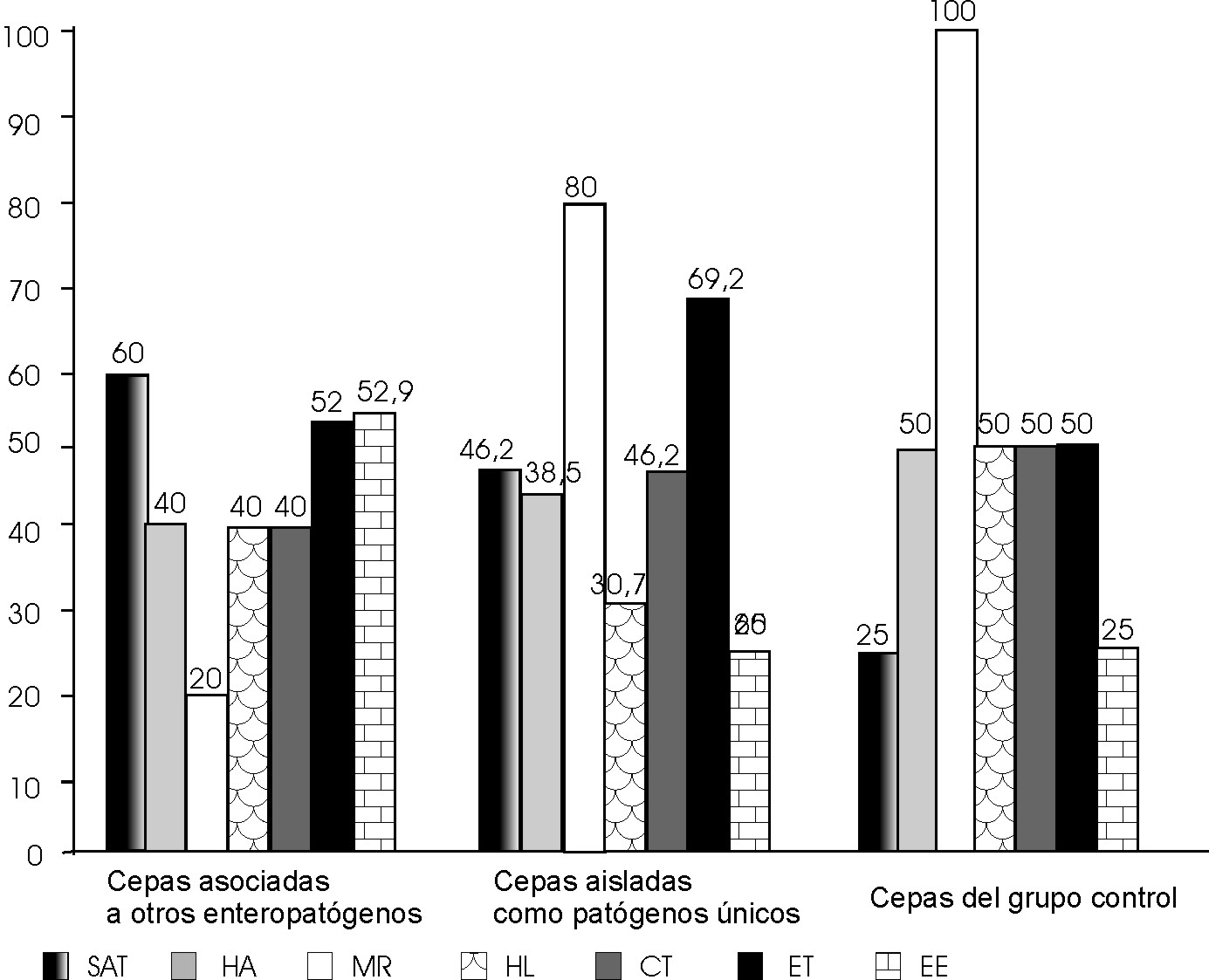
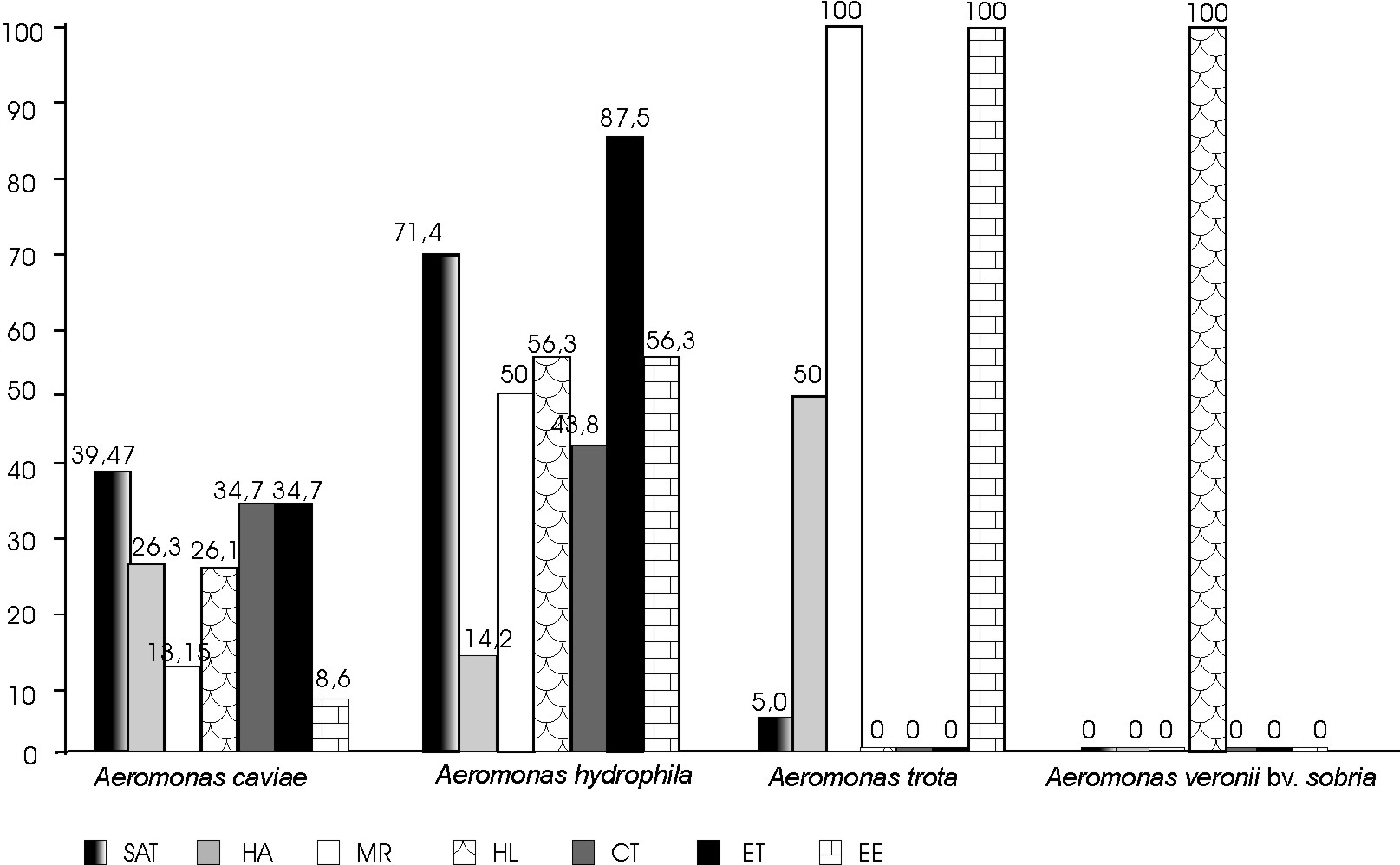
En todas las cepas investigadas al menos 1 de las 4 de las enzimas (beta hemolisina, DNasa, gelatinasa, lecitinasa) estudiadas estuvo presente. En relación con el SAT resultaron positivas a esta prueba 22 cepas (52,38 %), de estas 20 (90,9 %) presentaron valores bajos (entre 0,5-2 M), el resto tuvieron valores de intermedio a alto (entre 0,02-0,I M). En cuanto a las cepas aisladas como patógenos únicos, dieron positiva a esta prueba 46,15 % (6/13), de estas 83,3 % (5/6) tuvieron valores bajos (0,5 M). Las aisladas junto a otros enteropatógenos fueron positivas a la prueba de SAT 60 % (15/25) y en el grupo control solo 1 cepa 25 % (1/4) (fig. 1). De las 22 cepas positivas al SAT 11(50 %) fueron Aeromonas hydrophila, 10 (45,4 %) Aeromonas caviae y 1 (4,5 %) Aeromonas trota (fig. 2).
SAT: prueba de agregación salina, HL: actividad hemolítica, HA: hemaglutinación, CT: citotoxina
MR: manosa resistente, ET: enterotoxina, EE: hidrofobicidad celular.
Fig. 1. Porcentaje de la producción de los diferentes factores de virulencia en los 3 grupos de cepas de Aeromonas spp. estudiados.
SAT: prueba de agregación salina, HL: actividad hemolítica, HA: hemaglutinación, CT: citotoxina, MR: manosa resitente, ET: enterotoxina, EE: hidrofobicidad celular.
Fig. 2. Relaciones porcentuales entre la producción de factores de virulencia y las especies de Aeromonas spp. aisladas de niños con EDA y grupo control.
En el ensayo de hemaglutinación e inhibición de la hemaglutinación, 40,4 % de las cepas dieron positiva la primera prueba, encontrándose que las cepas de Aeromonas sp. aisladas junto a otros enteropatógenos aglutinaron los glóbulos rojos en 40 % (10/25), mientras que el grupo control lo fue en 50 % (2/4) (fig. 1). En cuanto a la actividad hemolítica, estuvo representada en 38 % (16/42) de las cepas. Las Aeromonas aisladas junto a otros enteropatógenos en 40 % (10/25), como patógenos únicos en 30,7 % (4/13) y en las recuperadas del grupo control con 50 % (2/4) (fig. 1). En las cepas de Aeromonas hydrophila estuvo presente en 56,25 % (9/16), en Aeromonas caviae en 26,08 % (6/23), no se observó producción de hemolisinas en las cepas de Aeromonas trota, y la única cepa de Aeromonas veronii bv. sobria produjo hemolisina (fig 2). Los títulos de hemolisina oscilaron entre 1:32 a 1:512, 1:4 a 1.64 y 1:4 para Aeromonas hydrophila, Aeromonas caviae y Aeromonas veronii bv sobria, respectivamente.
En la prueba de inhibición de la hemaglutinación con manosa, se observó que el total de cepas que hemaglutinaron (40,4 %) hubo 35,29 % (6/17) que fueron manosa sensible (HAMS) y 64,7 % (11/17) manosa resistentes (HAMR). De las cepas aisladas junto a otros enteropatógenos hubo patógenos únicos 20 % (1/5) HAMS y 80 % (4/5) HAMR, y en los casos control 100 % (2/2) fueron HAMR (fig 1).
La prueba de hemaglutinación en las cepas de Aeromonas caviae resultó positiva en 70 % (14/20), de estas 35,7 % (5/14) fueron HAMS y 64,2 % (9/14) HAMR. En cuanto a Aeromonas hydrophila y Aeromonas trota la prueba de hemaglutinación solo fue positiva en 2 cepas 2/24 (14,2 %) y 1 cepa (1/2) (50 %), respectivamente. En relación con la inhibición de hemaglutinación solo una cepa de Aeromonas hydrophila fue HAMR al igual que Aeromonas trota (fig. 2).
La actividad hemolítica estuvo representada en 38 % (16/42) de las cepas. En las Aeromonas aisladas junto a otros enteropatógenos se observó esta actividad en 40 % (10/25), como patógenos únicos en 30,7 % (4/13) y en las recuperadas de los casos del grupo control en 50 % (2/4) (fig. 1). En las especies Aeromonas hydrophila estuvo presente en 56,25 % (9/16), en Aeromonas caviae en 26,08 % (6/23), no se observó su producción en las cepas de Aeromonas trota, y la única cepa de Aeromonas veronii bv. sobria, produjo hemolisina (fig 2). Los títulos de hemolisina oscilaron entre 1:32 a 1:512, 1:4 a 1.64 y 1:4 para Aeromonas hydrophila, Aeromonas caviae y Aeromonas veronii bv sobria, respectivamente.
La producción general de toxinas fue de 76,1 % (32/42), la de citotoxina de 40,6 % (13/32), enterotoxina 59,3 % (19/32) y la producción simultánea de los 2 tipos fue de 32,25 % (10/38). La producción general de toxinas en las cepas aisladas junto a otros enteropatógenos fue de 68 % (17/25) y ambos tipos de toxinas en 52,9 % (9/17). En las aisladas como patógenos únicos la producción fue de 92,3 % (12/13) y ambos tipos de toxinas 25 % (3/12) y en cuanto a las cepas aisladas del grupo control se observó que 75 % (3/4) y 25 % (1/4) produjeron toxina en forma general y ambas toxinas, respectivamente (fig.1).
La producción de citotoxinas fue demostrada en 40 % (10/25) en las cepas aisladas junto a otros enteropatógenos, en los patógenos únicos se observó en 46,15 % (6/13) y en el grupo control 50 % (2/4). En cuanto a la enterotoxina en estos mismos grupos, se observó 52 % (13/25), 69,2 % (9/13) y 50 % (2/4), respectivamente (fig. 1).
Por especie se determinó que de las 16 cepas de Aeromonas hydrophila, 14 (87,5 %) fueron enterotóxicas y 7 (43,75 %) citotoxicas y en 6,25 % (9/16) se observó la producción simultánea de ambas toxinas. De las 23 cepas de Aeromonas caviae 8 (34,7 %) fueron enterotóxicas y 34,7 % citotóxicas, y en 8,6 % (2/23) se observó la producción simultánea de ambos tipos de toxinas. Finalmente las 2 cepas de Aeromonas trota analizadas en este estudio produjeron simultáneamente los 2 tipos de toxina 100 % (2/2) y la cepa de Aeromonas veronii bv sobria no produjo exotoxinas (fig. 2).
Discusión
Con la finalidad de conocer la importancia y frecuencia del género Aeromonas como agente causal de diarreas en niños menores de 5 años en Mérida, Venezuela, y querer esclarecer su enteropatogenicidad, se hizo imperioso realizar un estudio, que permitiera conocer el potencial patógeno de estas bacterias. Se ha demostrado que cepas de Escherichia coli enteropatogénicas y de Salmonella typhi tienen alta superficie hidrofóbica; característica dada por la presencia de pilis y otras adhesinas, por lo que la determinación de esta propiedad puede dar idea del grado de adhesión de las bacterias.13,15,17 A pesar de que algunos investigadores no han encontrado relación entre la virulencia y la existencia de superficie hidrofóbica,18 la demostración de la hidrofobicidad mediante la prueba SAT, da una estimación indirecta de la presencia de adhesinas en la superficie celular bacteriana. En este trabajo contrariamente a lo reportado por Nishikawa y otros, más de 50 % de las cepas resultaron ser hidrofóbicas y más de 90 % de estas presentaron valores bajos entre 0,5 y 2 M, lo que concuerda con los hallazgos de algunos investigadores, quienes reportaron valores similares, pero en cepas de origen ambiental; aunque existen otros autores que han sugerido que las cepas de origen ambiental son más fimbriadas que las de origen fecal, por lo tanto tendrán mayor superficie hidrofóbica, afianzando ese hecho los resultados obtenidos en este trabajo.19 (Kirov S. Morphology, expression and funtional significance of Aeromonas pili. In: Fourth International Symposium on Aeromonas and Plesiomonas. Atlanta; 1993. p. 22).
Los estudios de hidrofobicidad se han realizado con más frecuencia en cepas de Aeromonas salmonicida.18,19 También se han reportado en Aeromonas hydrophila y Aeromonas veronii bv sobria observándose una gran superficie hidrofóbica en estas especies.15,20,21 En este estudio los resultados obtenidos fueron similares a los reportados por estos autores con respecto a Aeromonas hydrophila, observándose además un comportamiento similar entre esta especie y Aeromonas caviae.
Mediante la prueba de hemaglutinación se puede determinar la capacidad de adherencia de las cepas de Aeromonas. Se ha reportado que el mecanismo de hemaglutinación está relacionado con las adhesinas no fimbriales o la no producción de pilis.22 El hecho de haber observado que 40,4 % de las cepas analizadas dieron la prueba de hemaglutinación positiva, sugiere la presencia en estas de adhesinas tipo lectina.23 El elevado porcentaje obtenido a esta prueba por el grupo de cepas aisladas como patógenos únicos sugiere que este grupo de cepas tiene mayor capacidad de adhesión. Varios patrones de hemaglutinación e inhibición de la hemaglutinación con D-manosa y L-fucosa, se han reportado en cepas de Aeromonas de origen clínico, pero en la mayoría de los casos estos son difíciles de interpretar, por lo cual esta prueba se realiza frecuentemente, con Manosa.24
En 1986, algunos investigadores reportaron bajos porcentajes de positividad en la HAMR por cepas de origen no diarreico, por lo que sugirieron que este tipo de adhesión podía ser un marcador de cepas fecales.25 Por otra parte, otros autores describieron que cepas con HAMR fueron encontradas con mayor frecuencia en aislamientos de origen fecal que en las provenientes de alimentos y agua, sugiriendo nuevo que esta adhesión puede ser un marcador de virulencia en patógenos diarreogénicos15 Los resultados de este trabajo coinciden con los autores antes mencionados.
Aunque se ha reportado Aeromonas caviae como avirulenta, los datos encontrados en este estudio muestran una elevada capacidad de adherencia en esta especie, similar a lo reportado por otros investigadores, quienes demostraron que Aeromonas caviae posee propiedades enteropatogénicas como la adherencia (Namdari H, Uroskie J, Hughes J, Wardach D. In Fourth lntemational Symposium on Aeromonas and Plesiomonas. p. 44. Abstract p. 10.1993).
Se ha reportado que la adherencia de tipo lectina no es un factor importante en Aeromonas hydrophila, esto explicaría el bajo porcentaje (14,2 %) de cepas que fueron positivas a la prueba de hemaglutinación, siendo esto similar a lo reportado en otro estudio.24
En los últimos años se ha sugerido que la hemolisina y la citotoxina son producidas principalmente por cepas hemolíticas de Aeromonas spp., y la síntesis de la primera se ha sugerido como rasgo de virulencia en este grupo bacteriano.6 Los resultados de este estudio en relación con la actividad hemolítica son similares a lo reportado por otros autores, donde se indica que las cepas de origen entérico son menos hemolíticas que las extraintestinales.10
Al analizar la producción de los distintos factores de virulencia de los distintos grupos de cepas, se observa un cuadro similar, aunque con tendencia a aumentar en el grupo de únicos.
Al igual que en trabajos anteriores la producción de factores de virulencia fue mucho mayor en las cepas aisladas de casos con EDA que en las aisladas del grupo control.6
Aunque las cepas aisladas del grupo control mostraron una producción no despreciable de factores de virulencia, la respuesta inmune inducida por el microorganismo debido a exposiciones continuas, podría crear algún grado de protección como ya se ha reportado; esto explicaría la presencia de la bacteria en niños asintomáticos, convirtiendo al hombre en reservorio de infección.26 En cuanto a las especies Aeromonas hydrophila mostró una vez más que tiene un elevado potencial patógeno, aunque le sigue muy de cerca Aeromonas caviae, considerada avirulenta años atrás, pero que hoy día ya se sabe de su gran potencial enteropatógeno, contribuyendo los resultados de este estudio a corroborar este aspecto.22 Los hallazgos obtenidos en las diferentes especies sugieren lo descrito, por algunos autores, quienes proponen que la enteropatogenicidad en el género Aeromonas es cepa específica, más que especie específica (Alabi S, Islam T, Quadri F, Faruque A, Albert M, Sack B. Serum antibody response in children with Aeromonas associated diarrhoea. In: 5th International Aeromonas and Plesiomonas Symposium. Heriot-Watt University Edimburgh, Scotland, 1995).
Basado en estos resultados, se podría deducir que en esta localidad, las cepas de Aeromonas pueden ser consideradas como patógenos intestinales primarios en niños menores de 5 años con EDA.
Agradecimientos
A la valiosa ayuda del CONICIT. Proyecto Nacional de Diarreas MPS - RP -IV - 140031 y a la Universidad de las Naciones Unidas. Programa UNU/Biolac.
Referencias bibliográficas
1. Joseph S, Carnahan A. The isolation, identification and systematics of the motile Aeromonas species. Ann Rev Fish Dis 1994;4:315-43.
2. Borrel N, Acias S, Figueras M, Martínez-Murcia A. Identification of Aeromonas clinical isolates by restriction fragment length polymorphism of PCR -. Amplified 16S rRNA Genes. J Clin Microbiol 1997;35:1671-4.
3. Golik A, Leonor Y, Schlaeffer F, Gluskin I, Lewinsonh G. Aeromonas species Bacteremia in non immunocompromised hosts. lsr J Med Sci 1990;26:87-90.
4. Janda J, Guthertz L, Kokka R, Schimada T. Aeromonas species in Septiciemia: Laboratory characteristies and clinical observations. Clin lnfect Dis 1994;17:77-83.
5. Kirov S, Hayward L. Virulence traits of Aeromonas in relation to species and geographic region. Aust J Med Scien 1993;14:54-8.
6. Deodhar L, Saraswathi K, Varudkar A. Aeromonas spp. and their association with human diarrhoeal disease. J Clin Microbiol 1991;29:853-6.
7. Nishikawa Y, Hase A, Ogawasara J, Scotland S, Smith H, Kimura T. Adhesion to and invasion of human colon carcinoma Caco-2 cells by Aeromonas strains. J Med Microbiol 1994;40:55-61.
8. Brown R, Sanderson K, Kirov S. Plasmids and Aeromonas virulence. FEMNS 1997;17:217-23.
9. Gosling P, Tumbulí P, Lighttoot N, Pethes J, Lewis R. Isolation and purification of Aeromonas sobria cytotonic enterotoxin and Beta haemolysin. J Med Microbiol 1993;38:227-34.
10. Vadivelu J, Puthucheqry S, Nacaratman P. Exotoxin profiles of clinical isolates of Aeromonas hydrophila. J Clin Microbiol 1991;35:363-7.
11. Mac Faddin J. Biochemical test for identification of medical bacteria. Baltimore:The Williams & Wilkins Co.; 1987. p. 61-120.
12. Abbott S, Cheang W, Kroeske - Brystom' 5, Malekzadeh T, Janda M. Identification of Aeromonas strains to the genoespecies level in the clinical laboratory. J Clin Microbiol 1992;30:1262-6.
13. Lindhal M, Faris A, Wadstrom T, Hyesten S. A new test based on "salting out" to measure relative surface hydrophobicity of bacterial cells. Bioch Bioph Acta 1981;677:471-6.
14. Guine P, Veldkamp J, Jansen W. Improved Minca medium for the detection of K99 antigen in calf enterotoxigenic strains of Escherichia coli. lnfect lmmun 1987;15:676-8.
15. Nishikawa Y, Kimusa T, Kishi T. Mannose-resistant adhesion of motile Aeromonas to INT 407 cells and the differences among isolates from humans, food and water. Epidemiol lnfect 1991;107:171-9.
16. Fleiss J. Statistical Methods for rates and proportions. 20 ed. New York: Jonh Willy & Sons. p. 320. 1981.
17. Megraud F. Incidence and virulence of Aeromonas species in feces of children with diarrhea. Eur J Clin Microbiol 1986;5:311-6.
18. Fernández A, Pérez M, Rodríguez L, Nieto T. Surface Phenotipic characteristics and virulence of spanish isolates of Aeromonas salmonicida after passaje throug fish. Suppl Envirom Microbiol 1995;61:2010-2.
19. Mateos D, Anguita J, Rivero O, Naharro G, Paniagua C. Comparative study of virulence and virulence factors of Aeromonas hydrophila strains isolated from water and sediments of a river. Zbl Hyg 1992;193:114-22.
20. Quinn D, Wong C, Atkinson H, Flower R. Isolation of carbohydrate reactive auter membrane proteins of Aeromonas hydrophila. lnfect Inmun 1993;61:371-7.
21. Chu S, Noonan B, Gavaignae S, Trust T. Endogenus mutagenesis by an insertion sequence element identifies Aeromonas salmonicida AbcA as an ATP building cassette transport protein required for biogenesis of smooth lipopolisaccharide. Proc Natl Scand Sci 1995;92:5754-8.
22. Pal A, Ramamurthy T, Ghosh A, Pal S, Takeda Y, Balarish M. Virulence traits of Aeromonas strains in relation to species and source of isolation. Zlb Bakt 1992;276:418-28.
23. Quinn D, Flower R. "Porin-adhesins" of Aeromonas hydrophila In: 5th International Aeromonas and Plesiomonas Symposium. Edimburgo Scotland: Heriot-Watt University, 1995.
24. Burke V, Grace M. Aeromonas species in human diarrhoeal disease. J Gastoenterol Hepatol 1986;1:237-49.
25. Burke V, Gooper M, Robinson J, Gracey M, Lesmana M, Echev P. Haemagglutination patterns of Aeromonas species in feces of children with diarrhea. Eur J Clin Microbiol 1986;5:311-6.
26. Golik A, Mondai D, Lusken L, Schechter L, Cohen N, Eschar J. Aeromonas in adult diarrhea. J Clin Gastroenterol 1990;12:148-52.
Recibido: 31 de mayo de 2004. Aprobado: 20 de diciembre de 2004.
Lic. Laura Bravo Fariñas. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía Km 6, municipio La Lisa, Ciudad de La Habana, Cuba. Correo electrónico: laura@ipk.sld.cu
1 Máster en Ciencias. Universidad de Los Andes. Mérida-Venezuela.
2 Doctora en Ciencias. Universidad de Los Andes. Mérida Venezuela.
3 Doctora en Ciencias. Licenciada en Ciencias Biológicas. Investigadora Agregada. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
4 Licenciado en Ciencias Biológicas. Investigador Auxiliar. IPK.
5 Licenciada en Química. Investigadora Instituto de Biomedicina. Universidad Central de Venezuela. Ministerio de Sanidad y Asistencia Social. Caracas -Venezuela.
6 Especialista de I Grado en Microbiología. IPK.