Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Hematología, Inmunología y Hemoterapia
versão On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.16 n.3 Ciudad de la Habana set.-dez. 2000
Artículos Originales
Instituto de Hematología e InmunologíaEvaluación del Trofín en el tratamiento de la anemia ferripriva en niños
Dra. Hortensia Gautier du Défaix Gómez,1 MC. Mariela Forrellat Barrios,1 Dra. Norma Fernández Delgado,1 Lic. Irma Gómis Hernández,1 Dra. Elisa Aznar García,2 Dr. Raúl González Hernández2 y Dr. Juan Almaguer Almaguer1RESUMEN
Se realizó la evaluación comparativa de la eficacia y tolerancia del Trofín en dosis de 8 mg/Kg/día, con el fumarato ferroso en igual dosis y vía de administración. Se estudiaron 40 niños entre 6 y 36 meses de edad con anemia por deficiencia de hierro que fueron distribuidos al azar en 2 grupos de tratamiento, 20 pacientes en cada grupo. Se observó un incremento más rápido de los niveles de hemoglobina en el grupo tratado con fumarato ferroso. El tiempo de recuperación de la hemoglobina fue significativamente más prolongado en el grupo tratado con Trofín. Diecinueve niños (95 %) tratados con fumarato ferroso alcanzaron el valor de referencia de hemoglobina en los 3 primeors meses de tratamiento, mientras que en el grupo tratado con Trofín, el 75 % lo alcanzó al cuarto mes. El Trofín fue bien tolerado en el 90 % de los casos. La aparición de vómitos en 2 niños se atribuyó a un marcado rechazo al sabor del medicamento. La eficacia del Trofín como antianémico fue buena, aunque menor que la del fumarato ferroso. Su principal inconveniente lo constituyó el rechazo al sabor.Descriptores DeCS: ANEMIA FERROPRIVA/quimioterapia; NIÑOS; ESTADO NUTRICIONAL.
El hierro es el metal más abundante en la naturaleza, sin embargo, su deficiencia es la carencia nutricional más frecuente y la principal causa de anemia en el mundo, lo que constituye uno de los problemas más graves que enfrenta actualmente la humanidad,1 del cual no estamos exentos en Cuba.2,3
Esta deficiencia se desarrolla fundamentalmente en aquellos grupos donde existe una ingesta deficiente, una disminución en la absorción del hierro de los alimentos como consecuencia de una dieta inadecuada, un aumento de las necesidades debido a un crecimiento acelerado o un incremento en las pérdidas4 como sucede en los niños, las mujeres en edad fértil, especialmente las embarazadas y los adolescentes.5
En el tratamiento de esta deficiencia se emplean tradicionalmente las sales ferrosas, que aunque tienen un efecto corrector rápido sobre el estado carencial, con frecuencia ocasionan reacciones adversas a nivel del tracto gastrointestinal, lo que constituye su principal inconveniente6 y la causa fundamental de abandono del tratamiento.7 Actualmente existe la tendencia de reducir al mínimo su utilización,8 para lo cual se han desarrollado productos que contienen complejos hierro-proteína o hierro-carbohidratos que son mejor tolerados.
En Cuba se han desarrollado una serie de preparados con características similares, entre los que se encuentran el Trofín (BIOCEN, La Habana). Este producto es de origen natural, contiene 4 mg de hierro/mL, proteínas, aminoácidos, miel de abejas y propóleos que contribuyen a mejorar la absorción y biodisponibilidad del mineral, así como su tolerancia.
La introducción de un nuevo medicamento implica la necesidad de realizar su evaluación comparativa con la terapéutica convencional. Nuestro trabajo se realizó con el objetivo de comparar la eficacia y tolerancia del Trofín en dosis de 8 mg/kg de peso corporal/día, con el fumarato ferroso en igual dosis y vía de administración.
MÉTODOS
En el estudio se incluyeron niños entre 6 y 36 meses de edad atendidos en el Instituto de Hematología e Inmunología, a los que se les diagnosticó anemia por deficiencia de hierro, luego de un minucioso estudio del estado nutricional en hierro y otros nutrientes hematopoyéticos.Una vez obtenido el consentimiento de los padres para participar en la investigación, previa explicación detallada de sus características y objetivos, se procedió a llenar un formulario, donde se recogieron datos generales, biológicos y del estado e historia de salud del niño, con los que se conformó una historia clínica para cada paciente.
A todos los niños se les realizó una extracción de sangre venosa en ayunas entre las 7 y las 9 a.m. con material libre de hierro. Una parte de la sangre se dejó coagular para la obtención del suero, que se almacenó a -20 ° C hasta el momento de su utilización para las determinaciones de laboratorio relacionadas con el estado nutricional del paciente. La otra parte de la sangre venosa fue heparinizada y se utilizó para la realización del folato eritrocitario. Además se realizó la determinación de hemoglobina capilar por punción digital por el método de la cianometahemoglobina.9
Se cuantificó el hierro sérico y la capacidad total de fijación del hierro por la transferrina mediante el método de Beale y otros modificado por Loria,10 con lo que se calculó el índice de saturación de la transferrina. Se realizó la determinación de vitamina B12 sérica por un radioanálisis con carbón hemoglobina11 y de ácido fólico sérico12 y eritrocitario13 por el método microbiológico con el Lactobacillus casei.
Se consideraron anémicos aquellos casos que tenían hemoglobina menor que 110 g/L. Los puntos de corte utilizados para el diagnóstico de la deficiencia de hierro fueron: hierro sérico < 10,7 mmol/L, capacidad total de fijación de hierro por la transferrina > 75 mmol/L, índice de saturación de la transferrina < 0,16, folato sérico > 9,1 nmol/L, folato eritrocitario > 340 nmol/L y vitamina B12 > 120 pmol/L.
Se consideraron anémicos por deficiencia de hierro aquellos pacientes que tenían valores de hemoglobina e índice de saturación de la transferrina por debajo del punto de corte, acompañados de niveles de folatos y vitamina B12 superiores a este.
Se incluyeron en el estudio aquellos pacientes con anemia por deficiencia de hierro que no habían recibido tratamiento antianémico ni transfusiones de sangre en los últimos 2 meses. Se excluyeron los que no cumplían estos criterios, los que tenían trastornos gastrointestinales agudos o crónicos que pudieran enmascarar las reacciones adversas al tratamiento y aquellos con enfermedades malignas o crónicas.
Una vez establecido el diagnóstico, los pacientes incluidos en el estudio fueron distribuidos aleatoriamente en 2 grupos de 20 pacientes cada uno. El primer grupo recibió tratamiento con Trofín en dosis de 8 mg/kg/día dividido en 2 subdosis alejadas de las comidas (grupo 1) y el segundo, fumarato ferroso oral (tabletas de 200 mg) en igual dosis y frecuencia (grupo II).
El seguimiento se realizó en consulta a los 15 días y después mensualmente, en las que se determinó hemoglobina, hematócrito y conteo de reticulocitos, para evaluar la respuesta al tratamiento. Además se recogió información del estado general del paciente y la tolerancia al tratamiento. El monitoreo se mantuvo hasta lograr una cifra de hemoglobina ³ 110 g/L.
Con los datos obtenidos de la encuesta se confeccionó una base de datos en la que se incluyeron también los resultados del estudio inicial y del monitoreo del tratamiento, así como el tiempo necesario para la recuperación de las cifras de hemoglobina, lo que se procesó por el sistema STATISTICA.
Se calcularon los valores promedio y las desviaciones estándar de las variables cuantitativas del estudio inicial, de las cifras de hemoglobina y sus incrementos con respecto al valor de hemoglobina en los 3 primeros meses de tratamiento y del tiempo de recuperación de la hemoglobina en los 2 grupos del estudio.
Se determinó la composición de los grupos de tratamiento en cuanto a sexo y color de la piel. Se obtuvieron además las distribuciones de frecuencia del tiempo de recuperación de la hemoglobina y de la presencia de reacciones adversas para ambos grupos.
En la comparación de las variables cuantitativas se empleó la prueba t para muestras independientes y el X2 para las cualitativas. Se calcularon además los coeficientes de correlación de Pearson entre la cifra de hemoglobina inicial y los niveles de hemoglobina, así como sus incrementos con respecto al valor inicial en los 3 primeros meses de tratamiento.
RESULTADOS
En la tabla 1 se observa la composición de los grupos de tratamiento en cuanto a edad, sexo y color de la piel. No se encontraron diferencias estadísticamente significativas al comparar ambos grupos en cuanto a estas variables.
| Grupo ) | | | | ||||||
| |
| | | | | ||||
| Trofín | | | | | | | |||
| Fumarato ferroso | | | | | | | | | |
F: femenino; M: masculino; B: blanco; NB: no blanco (negros y mestizos).
En la tabla 2 se muestran las medias y las desviaciones estándar de las pruebas de laboratorio del estudio nutricional inicial para cada uno de los grupos. No se encontraron diferencias significativas en los indicadores de la deficiencia de hierro (hemoglobina, hierro sérico, capacidad total, índice de saturación); en los niveles de las reservas de ácido fólico medidos a través del folato eritrocitario, ni en los niveles séricos de vitamina B12. Se encontraron diferencias significativas en los niveles de folato circulante.
| Pruebas de laboratorio | | | |||
| |
| |
| | |
| Hemoglobina (g/L) | | | | | |
| Hierro sérico (mmol/L) | | | | | |
| Capacidad total (mmol/L) | | | | | |
| Índice de saturación | | | | | |
| Folato sérico (nmol/L) | | | | | |
| Folato eritrocitario (nmol/L) | | | | | |
| Vitamina B12 sérica (pmol/L) | | | | | |
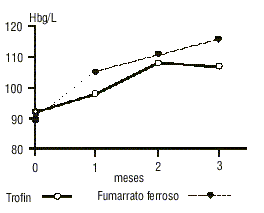
En la figura se representa el comportamiento de la hemoglobina en los 3 primeros meses de tratamiento. La respuesta fue más rápida en el grupo tratado con fumarato ferroso.
FIG. Evolución en los 3 primeros meses de los pacientes tratados con Trofín y fumarato ferroso.
Al comparar el aumento de la hemoglobina con respecto a la hemoglobina inicial de ambos grupos en este período, se encontraron diferencias significativas al mes y a los 3 meses de tratamiento (tabla 3).
| Aumento de la | | | |||||
| hemoglobina | | |
| | |
| |
| Dif Hb 1 | | | | | | | |
| Dif Hb 2 | | | | | | | |
| Dif Hb 3 | | | | | | | |
Dif Hb 1, 2, 3: aumento de la hemoglobina en el primer, segundo y tercer mes con respecto a la hemoglobina inicial.
Se observó una correlación inversa y significativa del aumento de la hemoglobina en este período en el grupo tratado con fumarato ferroso, mientras que en el grupo tratado con Trofín solo fueron significativos los incrementos en los 2 primeros meses de tratamiento (tabla 4).
| | | |
| Hb inicial vs | | |
| Dif Hb 1 | | |
| Dif Hb 2 | | |
| Dif Hb 3 | | |
* p < 0,05.
Dif Hb 1, 2, 3: aumento de la hemoglobina en el primer, segundo y tercer mes con respecto a la hemoglobina inicial.
En cuanto a la recuperación de la hemoglobina se encontró que el 20 % de los niños (n = 4) tratados con Trofín no alcanzaron cifras normales de hemoglobina, a diferencia de lo ocurrido en el grupo tratado con fumarato ferroso, en el que el 100 % de los casos (n = 20) logró alcanzar valores de 110 g/L o más de hemoglobina. Para la comparación entre ambos grupos en cuanto a esta variable, los casos se agruparon como se muestra en la tabla 5, y se encontraron diferencias significativas entre ambos tratamientos (X2 = 10,36, p < 0,01).
| | ||||||
| | | | ||||
| | | | | | | |
| Trofín | | | | | | |
| Fumarato ferroso | | | | | | |
: 10,36; p < 0,01.
El tiempo requerido para la normalización de la hemoglobina osciló entre 1 y 6 meses en el grupo I y entre 1 y 8 en el II. El porcentaje de casos que normalizaron sus cifras de hemoglobina en los 3 primeros meses de tratamiento fue del 95 % en el grupo tratado con fumarato ferroso (n = 19) y 50 % en el tratado con Trofín (n = 10). El tiempo de normalización se prolongó más de 5 meses en solo un paciente (5 %) de cada grupo.
El Trofín fue bien tolerado en el 90 % de los niños (n = 18). En 2 pacientes se produjo un rechazo marcado al sabor del medicamento que obligó a cambiar a fumarato ferroso. No se observó diarrea en ninguno de los niños estudiados.
En el 90 % de los pacientes del grupo I (n = 18) y en el 95 % del grupo II (n = 19) no se utilizaron otros medicamentos. Fue necesario asociar al tratamiento antianémico multivitaminas en 2 pacientes (10 %) del grupo tratado con Trofín y vitamina B12 en 1 (5 %) del grupo II; estos niños tenían cifras de ácido fólico, vitamina B12 o ambos cercanas al límite inferior del intervalo de referencia en el momento del estudio.
DISCUSIÓN
Para la aplicación de un nuevo medicamento resulta imprescindible su comparación con la terapéutica convencional, en cuanto a eficacia y tolerancia, en 2 grupos de pacientes con iguales características.Los valores significativamente más bajos de folato sérico observados en el grupo I pueden ser causados por una ingesta deficiente de esta vitamina en algunos niños, en los días previos a la extracción de sangre, sin repercusión sobre sus niveles tisulares como se evidencia en los niveles de folato eritrocitario,14 con lo que se descarta la posible interferencia de esta vitamina en la respuesta inicial al tratamiento.
La forma más sencilla y efectiva utilizada para evaluar la respuesta al tratamiento con hierro es la determinación de hemoglobina, debido a su rápido aumento una vez iniciada la terapia. El primer mes es el más importante para el éxito del tratamiento,15,16 ya que la respuesta en términos de hemoglobina es virtualmente completa a partir del segundo mes.15
Las diferencias significativas en el aumento de las cifras de hemoglobina observadas en el primer mes de tratamiento, no obstante partir de grupos igualmente anémicos y deficientes de hierro, pueden deberse a la diferencia en la naturaleza del compuesto de hierro presente en cada medicamento, ya que el hierro presente es hemínico en el Trofín, mientras que el del fumarato ferroso es inorgánico y sus mecanismos de absorción son diferentes.17
Se conoce que en la deficiencia de hierro se produce un aumento de la absorción de ambos tipos de hierro. Sin embargo, este incremento es mucho menor en el caso del hierro hemoglobínico que en el del hierro inorgánico.17 Esta diferencia puede explicarse porque la superficie de absorción de la mucosa intestinal no reconoce al grupo hemo como un tipo de hierro, por lo que la regulación de su absorción es diferente. Esto permite explicar la elevación más temprana de las cifras de hemoglobina observada en el grupo II tratado con fumarato ferroso.
La correlación inversa y significativa observada entre los incrementos de la hemoglobina en el período evaluado en el grupo II y solo en los 2 primeros meses en el grupo I, puede explicarse por la existencia de una relación inversa entre la hemoglobina inicial y la respuesta al tratamiento.18
La ausencia de correlación en el tercer mes de tratamiento en el grupo I, puede deberse al retraso de la respuesta de un grupo de los casos tratados con Trofín.
El hecho de que el 95 % de los pacientes tratados con fumarato ferroso alcanzara los valores de referencia de hemoglobina en los 3 primeros meses de tratamiento, mientras que en el grupo tratado con Trofín sólo los obtuviera el 75 % al cuarto mes, evidencia una respuesta más tardía en este grupo, que puede deberse al menor incremento de la absorción del hierro hemiglobínico en los estados de deficiencia de hierro.17 Esto coincide con lo encontrado al utilizar hierro hemiglobínico para el tratamiento de los diferentes estadios de la deficiencia de hierro. En ese estudio se comparó la respuesta de adultos con anemia por deficiencia de hierro tratados con dosis similares de hierro hemiglobínico y sulfato ferroso suministrados en 3 niveles de dosis. Se encontró una respuesta más tardía en el grupo tratado con hierro hemiglobínico en todas las dosis empleadas.19
Aunque en el estudio inicial de los niños a los que fue necesario asociar tratamiento vitamínico no se encontraron otras deficiencias nutricionales que impidieran obtener una respuesta inicial adecuada, sus niveles de ácido fólico, vitamina B12 o de ambas, estaban cercanos al límite inferior del intervalo de referencia. Ambos niños mostraron inicialmente una buena respuesta al tratamiento, pero al avanzar este se produjo un estancamiento de las cifras de hemoglobina, proba-blemente debido al agotamiento de las reservas vitamínicas al producirse un aumento de la eritropoyesis como consecuencia de la ferroterapia, que se resolvió al asociar el tratamiento vitamínico.
Dos de los fallos terapéuticos encontrados en el grupo I se debieron al abandono del tratamiento luego de cuatro meses sin haber alcanzado las cifras de hemoglobina deseadas. Los restantes fallos se debieron a vómitos severos como expresión de rechazo al sabor del medicamento. Estos últimos pacientes fueron tratados con fumarato ferroso y la hemo-globina se normalizó en un breve tiempo. Estos resultados fueron similares a los encontrados cuando se evaluaron 2 su-plementos dietético-terapéuticos cubanos (Ferrical y Nutrivin) en niños de 6 a 36 meses de edad, donde se observó resistencia terapéutica en el 4 y el 13 % de los casos, respectivamente.20
Es bien conocido que el hierro hemoglobínico no produce los efectos indeseados propios de las sales de hierro,19 lo que explica que en nuestro estudio, el Trofín haya sido bien tolerado por la generalidad de los pacientes. La aparición de vómitos observada en 2 niños puede atribuirse a un marcado rechazo al sabor del medicamento referido por los padres, que pudiera ser debido a alguno de los aditivos incluidos en la formulación.
A partir de nuestros resultados, se plantea que la eficacia del Trofín como antianémico es buena, aunque menor que la del fumarato ferroso y su principal inconveniente es el rechazo al sabor.
SUMMARY
A comparative evaluation was made between the effectiveness and tolerance of Trofín at doses of 8mg/kg/day and those of ferrous fumarate at the same dosage and by the same route of administration. 40 children aged 6-36 months with iron-deficiency anemia that were randomly divided into 2 groups of treatment, 20 in each group, were studied. A higher increase of the levels of haemoglobin was observed in the group treated with ferrous fumarate. The time of recovery of haemoglobin was significantly longer in the group treated with Trofin. 19 children (95%) treated with ferrous fumarate attained the haemoglobin reference value during the first 3 months of treatment, whereas in the group treated with Trofin,75% reached this value on the fourth month. Trofin was welll tolerated in 90% of the cases. The occurrence of vomiting in 2 children was attributed to a marked rejection to the drug's flavour.The effectiveness of Trofin as an antianaemic drug was good, althought lower than that of ferrous fumarate. Its main inconvenient was the rejection to flavour.Subject headings: ANEMIA, IRON-DEFICIENCY/drug therapy; CHILD; NUTRITIONAL STATUS.
REFERENCIAS BIBLIOGRÁFICAS
1. United Nations Micronutrient. Deficiency- The Global Situation. SCN 1993;9:11-6.
2. Forrellat M, Gautier du Défaix H, Fernández N, Sánchez Y, Gómis I, Deficiencia de hierro en lactantes de un área de salud. Rev Cubana Hematol Inmunol Hemoter 1998 (en prensa).
3. Gautier du Défaix H. En el XXX Aniversario del Instituto de Hematología e Inmunología. Recuento de 20 años de experiencia en el estudio de las anemias nutricionales. Rev Cubana Hematol Inmunol Hemoter 1996;12:91-6.
4. Rowland TW, Black SA, Kelleher JF. Iron deficiency in adolescent endurance athlets. J Adolesc Health Care 1987;8:322-6.
5. Mora JO, Mora LO. Deficiencias de micronutrientes en América Latina y el Caribe. Anemia ferropriva. Washington; DC: OMNI/PAHO, 1987.
6. Milman N, Agger A, Nielsen O. Iron supplementation during pregnancy. Effect on iron status markers, serum erythropoietin and human placental lactogen. A placebo controlled study in 207 Danish women. Dan Med Bull 1991;38:471.
7. Lipschitz DA. Iron deficiency anemia. The anemia of chronic disease, sideroblastic anemia and iron overload. En: Jay H. Stein Internal Medicine, 4th ed. St. Louis: Mosby Year Book, 1994:835-45.
8. Cremones P, Caramazza I. Chemical and biological characterization of iron succinylate (ITF282). Int J Clin Pharmacol Ther Toxicol 1993;3:40-51.
9. International Committee for Standarization in Hematology. Recommendations for reference hemoglobinometry in human blood and specification for international hemoglobincyanide. Reference preparation. J Clin Pathol 1978;31:139-43.
10. Loria A, Monge B. Técnicas de dosificación séricas de hierro y capacidad de fijación de hierro. Rev Invest Clin 1966;19:17-8.
11. Gómis I, Gautier du Défaix H, González H, Medina C. Desarrollo de un radioanálisis para la determinación de vitamina B12 con carbón hemoglobina. Rev Cubana Hematol Inmunol Hemoter 1985;1:295-303.
12. Waters AH, Mollin DJ. Studies on the folic acid activity of human serum. J Clin Pathol 1961;14:335-44.
13. Hoffbrand AV. Method of assay of red cell folate activity and the value of the assay as a test for folate deficiency. J Clin Pathol 1966;19:17-8.
14. Herbert V. Development of human folate deficiency. En: Folic acid in health and disease. New York: Wiley-Liss, 1990:195-210.
15. De Maeyer E. Preventing and controlling iron deficiency anemia through primary health care. Geneva: World Health Organization, 1989.
16. Dallman PR. Exámenes de laboratorio para el diagnóstico de la deficiencia de hierro en el lactante y en la primera infancia. Anales Nestlé 1995;53:20-6.
17. Uzel C, Conrad ME. Absorption of heme iron. Semin Hematol 1998;35:27-34.
18. Dallman PR. Hierro. En: Conocimientos actuales en nutrición. 6ta. ed. Washington DC: OPS, ILSI, 1991:277-88.
19. Heinrich HC, Gabbe EE. Hemiglobin-iron for the prophylaxis and treatment of iron deficiency. Klin Wschenschr 1977;55:1043-9.
20. Salman GM. La caracterización clínica de la anemia por deficiencia de hierro en niños de 6 a 36 meses y evaluación de la eficacia de dos suplementos dietético-terapéuticos cubanos. Tesis para optar por el Grado Científico de Doctor en Ciencias Médicas, 1997; C. Habana.
Dra. Hortensia Gautier du Défaix Gómez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf.: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato.sld.cu
1 Instituto de Hematología e Inmunología.
2 Centro Nacional de Biopreparados.