Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Pastos y Forrajes
versão impressa ISSN 0864-0394
Pastos y Forrajes vol.37 no.2 Matanzas mar.-jun. 2014
ARTÍCULO DE INVESTIGACIÓN
Características y estabilidad aeróbica de ensilajes de caña de azúcar, tratada con urea, NaOH y maíz
Characteristics and aerobic stability of sugarcane silages, treated with urea, NaOH and corn
W. Santos da Silva, Tania Marta Carvalho dos Santos, C. C. Cavalcanti Neto, A. M. Espíndola Filho, Sybelle Georgia Mesquita da Silva, A. Neves Figueiredo y B. Araújo de Melo
Universidad Federal de Alagoas Av. Lourival Melo Mota, Ciudad Universitaria - Alagoas, 57072-900, Brasil
Correo electrónico: tmcs@ceca.ufal.br
RESUMEN
El objetivo de esta investigación fue determinar el efecto de diferentes aditivos en la estabilidad aeróbica de la caña de azúcar, conservada como ensilaje en silos de laboratorio. Se determinó la materia seca (MS), el extracto etéreo (EE), la materia mineral (MM), la proteína bruta (PB), el pH y la estabilidad aeróbica del ensilaje tratado con urea, NaOH y maíz molido. Se utilizó un diseño completamente aleatorizado, con cuatro repeticiones, para evaluar los siguientes tratamientos: caña de azúcar sin aditivos, caña de azúcar + 4 % de maíz molido, caña de azúcar + 1 % de urea, caña de azúcar + 1 % de urea + 4 % de maíz molido, caña de azúcar + 1 % de NaOH, y caña de azúcar + 1 % de NaOH + 4 % de maíz molido. Los ensilajes tratados con urea tuvieron un mayor porcentaje de EE. En presencia de urea y NaOH, la adición de maíz molido aumentó significativamente la PB. El NaOH incrementó el porcentaje de MM. Las pérdidas de MS causadas por gases fueron significativamente mayores en los ensilajes que no recibieron aditivos químicos. Hubo diferencias significativas en la producción de CO2 en diferentes tiempos de exposición al aire. Se concluye que los aditivos mejoraron las características químicas, excepto el contenido de MS, y redujeron la pérdida por gases en la fermentación anaeróbica.
Palabras clave: aditivos, gases, silos.
ABSTRACT
The objective of this study was to determine the effect of different additives on the aerobic stability of sugarcane, preserved as silage in laboratory silos. The dry matter (DM), ethereal extract (EE), mineral matter (MM), crude protein (CP), pH and aerobic stability of the silage treated with urea, NaOH and ground corn, were determined. A completely randomized design, with four repetitions, was used to evaluate the following treatments: sugarcane without additives, sugarcane + 4 % ground corn, sugarcane + 1 % urea, sugarcane + 1% urea + 4 % ground corn, sugarcane + 1 % NaOH, and sugarcane + 1 % NaOH + 4 % ground corn. The silages treated with urea had a higher percentage of EE. In the presence of urea and NaOH, the addition of ground corn significantly increased the CP. The NaOH increased the MM percentage. The DM losses caused by gases were significantly higher in the silages that did not receive chemical additives. There were significant differences in the production of CO2 at different times of exposure to air. It is concluded that the additives improved the chemical characteristics, except the DM content, and reduced the loss by gases in anaerobic fermentation.
Key words: additives, gases, silage.
INTRODUCCIÓN
El ensilaje es un método de conservación de forraje, basado en la fermentación láctica espontánea en condiciones anaeróbicas. Las bacterias lácticas epífitas fermentan los hidratos de carbono del forraje a ácido láctico y, en menor medida, a ácido acético. Debido a la presencia de dichos ácidos, el pH del material ensilado disminuye y los microorganismos indeseables son inhibidos (Santos y Zanine, 2006).
La caña de azúcar es un forraje que promueve la productividad animal en muchas regiones tropicales, debido a algunas de sus características: la alta capacidad de producción de materia seca (MS) y energía por unidad de superficie en un único corte anual, durante el periodo seco del año; el mantenimiento de su digestibilidad por un tiempo relativamente largo; la posibilidad de obtener un bajo costo por tonelada de MS; y el bajo contenido de fibra detergente neutra (FDN), lo que constituye un sinónimo del alto contenido de carbohidratos no fibrosos (NFC) (Miranda, 2006).
Sin embargo, los ensilajes de caña de azúcar presentan fermentación alcohólica y tienen pérdidas de hasta un 30 % de MS durante el almacenamiento, lo que provoca una gran reducción del valor nutricional del forraje (Pedroso et al., 2005; Freitas et al., 2006b). En este sentido, se han evaluado como aditivos varios productos que modifican la ruta fermentativa principal y reducen las pérdidas del valor nutricional del ensilaje de caña de azúcar, mediante la inhibición del crecimiento de la levadura y/o el bloqueo de la ruta de producción fermentativa de alcoholes, lo que mejora la fermentación estándar (Santos et al., 2009; Pedroso et al., 2011).
La urea, el benzoato de sodio y el hidróxido de sodio se encuentran entre los aditivos estudiados, pero los resultados de su aplicación han sido variables (Siqueira et al., 2007; Mari, 2008; Pedroso et al., 2008). Por ello, se han probado diferentes dosis de aplicación, así como la combinación de aditivos, en busca de una mayor eficiencia de la conservación (Siqueira et al., 2010).
Las investigaciones con caña de azúcar tratada con urea demostraron que su uso requiere una fuente adicional de proteína verdadera. Según Pinto et al. (2003), el salvado de algodón y el arroz son útiles para complementar este tipo de dieta, ya que el aumento del rendimiento de los animales se debe a la fuente concentrada de energía (almidón) y/o proteína, que escapan a la digestión microbiana ruminal y que son absorbidas como glucosa y aminoácidos en el intestino delgado. Asimismo, la mazorca de maíz o el maíz molido son fuentes de energía que se recomiendan para ser añadidos al forraje de caña de azúcar en la alimentación, cuando se utiliza urea como proteína bruta (Andrade et al., 2001).
El objetivo de esta investigación fue determinar el efecto de diferentes aditivos en la estabilidad aeróbica de la caña de azúcar, conservada como ensilaje en silos de laboratorio.
MATERIALES Y MÉTODOS
Los experimentos se realizaron en el Centro de Ciencias Agrícolas de la Universidad Federal de Alagoas Brasil, en el laboratorio de microbiología agrícola de Río Largo AL, situado a 9º 29' 45" de latitud Sur y 35° 49' 54" de longitud Oeste, a 165 m de altitud y con un promedio de precipitación anual de 1 842,5 mm.
Para la producción de ensilaje se utilizó la variedad industrial de caña de azúcar RB4764, cuyos tallos fueron molidos en una troceadora Nogueira DPM 12. En el caso del maíz molido se empleó la troceadora Nogueira Junior. Como aditivos se aplicaron la urea, el NaOH y el maíz molido, y los tratamientos fueron los siguientes: caña (T1, control), caña + 4 % de maíz molido (T2), caña + 1,0 % de urea (T3), caña + 1,0 % de NaOH (T4), caña + 1,0 % de urea + 4 % de maíz molido (T5), caña + 1,0 % de NaOH + 4 % de maíz molido (T6).
El forraje, cortado y troceado, se depositó en una lona de plástico. Después se aplicaron, de manera uniforme, la urea y el NaOH en forma de solución acuosa; así como el maíz molido, según los tratamientos establecidos. Además, se conservó una muestra para la determinación de la materia seca del forraje.
Como minisilos se emplearon baldes plásticos de 20 L de capacidad, con altura de 35 cm y diámetro de 30 cm, los cuales contenían una válvula Bunsen para el escape de gases y efluentes. La caña se comprimió manualmente para lograr la mayor densidad posible. Después de llenarse, los silos se cerraron, se sellaron con cinta adhesiva plástica y se almacenaron a temperatura ambiente, durante 65 días. Para la evaluación de las pérdidas totales, se pesaron los silos cuando estaban vacíos y llenos, así como al final del periodo de conservación.
Después de los 65 días, los silos se abrieron y se desechó el contenido de la porción superior y la inferior del ensilaje. El material de la parte central se homogeneizó en una película de plástico y se tomaron dos muestras. La primera (250 g) se depositó en bolsas de papel y se colocó en una estufa con ventilación forzada a 65°C, durante 72 h, para la determinación de la MS; posteriormente se molió y se colocó en un recipiente de vidrio con tapa identificado y almacenado para determinar la proteína bruta (PB), el extracto etéreo (EE) y la materia mineral (MM), de acuerdo con la metodología descrita por Silva y Queiroz (2002). La segunda muestra (25 g) se utilizó para analizar el pH, para lo cual se le añadieron 100 mL de agua. A continuación, se dejó reposar durante 2 h y se determinó el pH con un potenciómetro.
La pérdida de materia seca causada por gases se cuantificó mediante la diferencia de peso, a través de la siguiente ecuación (Schmidt, 2006):
PG = Pse - Psa x 1 000
Me
Donde:
PG: pérdida por gases (% de MS)
Pse: peso después de la apertura del silo
Psa: peso antes de la apertura del silo
Me: material ensilado (kg de MS)
Me: MFi x MSi
MFi: masa de forraje en el cierre (kg)
MSi: contenido de MS del forraje en el cierre
La siguiente ecuación se utilizó para estimar la recuperación de la MS:
RMS = (MFP MSF x) / (x MSi MFi) x 100
Donde:
RMS: tasa de recuperación de la MS (100)
MFi: masa de forraje en el cierre (kg)
MSi: contenido de MS del forraje en el cierre (100)
MFP: masa de forraje en la apertura (kg)
MSF: contenido de MS del forraje en la apertura (100)
Para la evaluación de la estabilidad aeróbica se utilizó la metodología propuesta por Ashbell et al. (1991), llamada sistema PET. Cada unidad de este sistema se preparó con el empleo de dos botellas de polietileno (PET) de dos litros, con fondo perforado y tapa, lo que permitió la circulación de aire. Para ello, se cortó por la mitad una de las botellas y se rellenó con 450 g de ensilaje, después se ajustó y se selló la parte superior con una cinta. La otra botella se cortó por la mitad y se colocaron en su interior 100 mL de KOH al 20 %, lo que sirvió como soporte para la botella que contenía la muestra de ensilaje. Después de montar este sistema, los materiales se dejaron expuestos al aire durante 4, 8 y 12 días. Posteriormente, se abrió y se retiraron 10 mL de solución de KOH al 20 %, para la titulación con HCl 2N. A continuación, se bajó a 9 el pH de la solución, para liberar el CO2. Asimismo, se realizó una segunda valoración con HCl 1N y se disminuyó de 9 a 3,6 el pH; para reducir el pH en el intervalo de 8,1 a 3,6 se observó la cantidad (mL) de ácido utilizada. Durante este proceso, el electrodo del potenciómetro se mantuvo en contacto con la solución de KOH al 20 %, según la técnica recomendada por Ashbell et al. (1991).
La cantidad de CO2 (g kg-1 MS) se calculó mediante la siguiente fórmula:
CO2 = 0,044 x T x V
(A x S x MS)
Donde:
T: volumen de HCl 1N consumido en la titulación (mL)
V: volumen total de KOH al 20 % (100 mL)
A: volumen de 20 % de KOH utilizado en la determinación (10 mL)
S: cantidad (kg) de ensilaje fresco colocado en las botellas
MS: materia seca del ensilaje
Al multiplicar la cantidad de CO2 por el factor 0,68 proporción de los nutrientes liberados en forma de CO2, se pudo estimar la pérdida de materia seca (Guim et al., 2002).
La estabilidad aeróbica (expresada en horas) se evaluó mediante el control de la temperatura del ensilaje expuesto al aire, según el método adaptado de Kung Jr. et al. (2000). El ensilaje de cada tratamiento se mantuvo en una cubierta. La temperatura se midió cada 12 h con un termómetro que se colocó en el centro geométrico de la masa de forraje de los silos. Se consideró como el inicio del deterioro del ensilaje cuando la temperatura superó en 2°C la temperatura inicial.
El diseño experimental fue completamente aleatorizado, con cuatro repeticiones. Para la determinación de la producción de CO2 se empleó un diseño factorial. Los datos se sometieron a un análisis de varianza (F = p < 0,05) y las medias se compararon por Scott Knott (p < 0,05).
RESULTADOS Y DISCUSIÓN
Los análisis de varianza para la PB, el EE, la MM y el pH mostraron significación estadística (p < 0,01) en los caracteres evaluados, excepto para la MS, cuyo contenido varió de 25,60 a 28,96 % y estuvo dentro del intervalo (25-35 %) propuesto por Sousa et al. (2008) como óptimo para la obtención de ensilaje de buena calidad.
Schmidt (2010) informó que el EE en los ensilajes de caña de azúcar es insignificante. En este sentido, en la presente investigación se obtuvo una concentración de EE significativamente mayor (p < 0,05) en los tratamientos que contenían urea (fig. 1). Estos resultados coinciden con los informados por Pinto et al. (2003), en ensilajes de dos variedades de caña de azúcar (RB806043 y RB72454) en los que se usaron aditivos con urea (1,47 y 1,17 %, respectivamente). Tales valores estuvieron por debajo del límite (8 % de EE) recomendado por McGuffey y Schingoethe (1980) para que no disminuya la ingesta de alimentos, lo que propicia la reducción en el rendimiento del animal.
La cantidad de ceniza se elevó significativamente (p < 0,05) con la adición de urea y NaOH (fig. 2). Los valores más altos se presentaron en T4; este resultado puede ser explicado por la adición de Na mineral, a través de NaOH. Independientemente de la presencia de aditivos, en todos los tratamientos el porcentaje de ceniza fue superior al recomendado por Schmidt (2010) para el ensilaje de caña de azúcar (> 3 %).
El aumento de la fracción mineral en los ensilajes tratados con aditivos químicos es informado en la literatura por varios autores. Simkins et al. (citados por Santos et al., 2008) encontraron un contenido de ceniza de 6,9 % en un ensilaje de maíz tratado con carbonato de calcio (0,5 % de la materia verde) en comparación con 5,2 % en el ensilaje control.
Alcántara et al. (1989), al utilizar un 3 % de hidróxido de sodio en el ensilaje de caña de azúcar, obtuvieron aumentos significativos en el contenido de ceniza (7,03 vs. 4,60 % de la MS para el ensilaje sin aditivo).
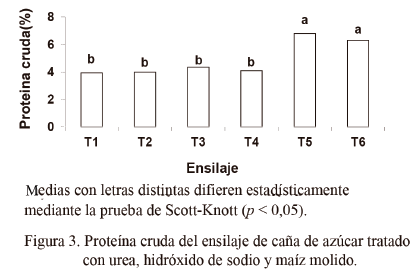
La caña de azúcar presenta, entre sus limitaciones, un bajo contenido de proteína cruda. Sin embargo, cuando se conserva como ensilaje, la adición de urea puede reducir esta deficiencia. En este estudio la presencia del maíz molido y la adición de urea y NaOH aumentaron significativamente el contenido de PC del ensilaje (fig. 3).
Andrade y Lavezo (1998) plantearon que es posible lograr un aumento de la proteína cruda con la adición de salvado y harina de maíz. Según Santos y Zanine (2006), dicha harina puede aumentar los procesos de respiración y fermentación, lo cual provoca que el forraje tenga un mayor contenido de componentes celulares y que aumente el porcentaje de proteína en la MS del ensilaje.
El valor del pH indica la acidez del ensilaje como resultado de la acción de las bacterias ácido lácticas. La disminución de este inhibe el desarrollo de los microorganismos indeseables, con lo que asegura la calidad de la fermentación. En la acidificación inadecuada se desarrollan las bacterias productoras de ácido acético y butírico, y en estas condiciones se estimula la actividad proteolítica, por lo que se produce un ensilaje de media a baja calidad.
En cuanto a este indicador (fig. 4) hubo diferencia significativa (p < 0,05) entre los tratamientos, excepto entre el T1 y el T3. El valor más alto se observó en T4 y en T6.
De acuerdo con lo planteado por Siqueira et al. (2010), el NaOH tiene una gran capacidad para elevar el pH, lo que, combinado con la elevación de la capacidad de amortiguación, proporciona los valores más altos de pH después de la apertura. Castrillón et al. (1978) trataron la caña de azúcar con NaOH al 4 % y observaron que, a pesar de obtener una alta producción de ácido láctico (12,2 %), los ensilajes tratados tenían un pH de 4,41, y los no tratados, de 4,12. Por su parte, Siqueira et al. (2007) obtuvieron valores de pH entre 4,3 y 5,8 en ensilajes de caña de azúcar tratados con NaOH, los cuales son similares a los alcanzados en este trabajo; aunque difieren de lo informado por otros autores (Andrade et al., 2001; Freitas et al., 2006a, 2006b), quienes encontraron valores de pH entre 3,12 y 3,96 en ensilajes tratados o no.
Las pérdidas de MS por gases (fig. 5) fueron significativamente mayores (p < 0,05) en los ensilajes que no recibieron aditivos químicos. Estas se asociaron al tipo de fermentación que ocurre en el ensilaje, ya que cuando se emplea alcohol se promueve la fermentación debido a las bacterias heterofermentativas, las levaduras y las enterobacterias, y en este proceso la tasa de calor producido por la actividad microbiana y las pérdidas de calor por conducción, radiación, convección y evaporación se relacionan directamente con la oxidación de la MS, lo que provoca pérdidas en forma de dióxido de carbono (Hill y Leaver, 2002). Esto no ocurre cuando la fermentación se produce a través de las bacterias homofermentativas las que utilizan glucosa como sustrato para producir lactato, proceso en el que la pérdida de MS es mucho menor.
El momento de apertura del silo se considera una etapa crítica del proceso de ensilaje. En esta fase, el material ensilado entra de nuevo en contacto con el oxígeno y comienza la oxidación de los azúcares y la degradación del ácido láctico producido durante la fermentación, lo que causa su deterioro y la reducción de su valor nutricional. La resistencia de la masa del forraje ensilado ante el deterioro, después de abrir el silo y quedar expuesto al aire, se define como estabilidad aeróbica (Jobim et al., 2007).
Hubo diferencias significativas (p < 0,05) en la cantidad de horas necesarias para aumentar la temperatura de los ensilajes en 2ºC por encima de la temperatura inicial (fig. 6). Los mejores resultados se obtuvieron en los tratamientos T2 y T5 (44 y 48 h, respectivamente), mientras que en el ensilaje sin aditivo esto se alcanzó a las 28 h.
Estos resultados no coinciden con los informados por Britt y Huber (citados por Sousa et al., 2008), quienes emplearon ensilaje de maíz, tratado con 0,5 y 1,0 % de urea. En este caso se necesitaron 11 y 12 días, respectivamente, para que aparecieran signos visibles de crecimiento fúngico en el ensilaje expuesto al aire.
La determinación de la producción de CO2 del ensilaje expuesto al aire puede ser útil en la caracterización de la velocidad de deterioro (Ashbell et al., 1991; Moura et al., 2001), lo que implica el seguimiento de la producción completa de este gas en el proceso, ya que al multiplicar la cantidad de CO2 por el factor 0,68 (relación de nutrientes liberados en forma de CO2) es posible estimar las pérdidas de MS (Honing y Woolford, 1979).
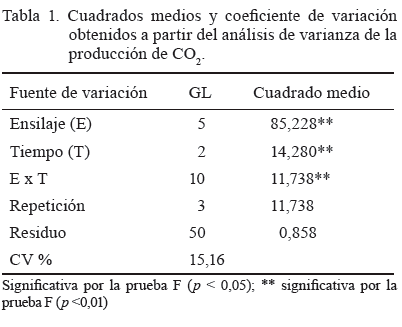
En cuanto a la producción de CO2, hubo un efecto significativo en el ensilaje y el tiempo de exposición, así como en la interacción de ambos factores (tabla 1).
La interacción mostró que el efecto del tiempo fue significativo (p < 0,05) solo en el T3, con los valores más altos a los 8 días después de la exposición al aire (tabla 2), lo que no ocurrió en el resto de los tratamientos. Este ensilaje fue el menos estable y produjo una mayor cantidad de CO2. Se debe destacar que en los restantes, a pesar de existir diferencias significativas entre ellos en los primeros 8 días, la variación que se pudo constatar fue mínima y la producción de CO2 fue similar a los 12 días.
El CO2 producido en los tratamientos fue bajo, si se compara con lo informado en la literatura para los ensilajes de baja calidad. Ashbell et al. (1991), al evaluar la estabilidad aeróbica de ensilajes de gramíneas expuestos al aire durante 4, 8 y 10 días, obtuvieron 31,2; 45,8 y 139,2 g de CO2 kg-1 de MS, respectivamente. Por su parte Guim et al. (2002), al estudiar la estabilidad aeróbica de un ensilaje de pasto elefante marchito, sin inoculación, observaron un aumento gradual de la producción de CO2, con valores de 0,72; 5,97; 12,54 y 20,63 g de CO2 kg-1 de MS, a los 2, 4, 6 y 8 días, respectivamente. Asimismo, Marques et al. (2002) encontraron valores altos (46,54 y 43,65 g de CO2 kg-1 de MS, después de 6 días de exposición) en un ensilaje marchito de girasol, tratado con inoculante.
Los resultados de este estudio permiten concluir que los aditivos utilizados mejoraron las características químicas de los ensilajes y redujeron las pérdidas de MS causadas por gases en la fermentación anaeróbica, aunque el tratamiento con urea al 1 % aumentó la producción de CO2 después de abrir el silo.
REFERENCIAS BIBLIOGRÁFICAS
1. Alcántara, E.; Aguilera, A.; Elliot, R. & Shimada, A. Fermentation and utilization by lambs of sugar cane harvest fresh and ensiled with and without NaOH: ruminal kinetics. Anim. Feed Sci. Tech. 23 (4):323-331, 1989.
2. Andrade, J. B.; Ferrari Junior, E. & Braun, G. Valor nutritivo de cana-de-açúcar tratada com hidróxido de sódio e acrescida de rolão-de-milho. Pesq. Agropec. Bras. 36 (10):1265-1268, 2001.
3. Andrade, J. B. & Lavezzo, W. Aditivos na ensilagem do capim-elefante. I. Composição bromatológica das forragens e respectivas silagens. Pesq. Agropec. Bras. 33 (11):1859-1872, 1998.
4. Ashbell, G.; Weinberg, Z. G.; Azrieli, A.; Hen, Y. & Horev, B. A simple system to study the aerobic determination of silages. Can. Agr. Eng. 33 (1): 391-393, 1991.
5. Castrillón, M. V.; Shimada, A. S. & Calderón, F. M. Manipulación de la fermentación en ensilajes de caña de azúcar y su valor alimenticio para borregos. Técnica Pecuaria en México. 35:48-55, 1978.
6. Freitas, A. W. P.; Pereira, J. C.; Rocha, F. C.; Costa, M. G.; Leonel, F. P. & Ribeiro, M. D. Características da silagem de cana-de-açúcar tratada com inoculante bacteriano e hidróxido de sódio e acrescida de resíduo da colheita de soja. Rev. Bras. Zootecn. 35 (1):48-59, 2006 a.
7. Freitas, A. W. P.; Pereira, J. C.; Rocha, F. C.; Costa, M. G.; Leonel, F. P. & Ribeiro, M. D. Avaliação da qualidade nutricional da silagem de cana-de-açúcar com aditivos microbianos e enriquecida com resíduo da colheita de soja. Rev. Bras. Zootecn. 35 (1):38-47, 2006 b.
8. Guim, A.; Andrade, P.; Iturrino-Schocken, R. P.; Franco, G. L.; Ruggieri, A. C. & Malheiros, E. B. Estabilidade aeróbica de silagens de capim elefante (Pennisetum purpurem Schum) emurchecido, tratado com inoculante microbiano. Rev. Bras. Zootecn. 31 (6):1217-1218, 2002.
9. Hill, J. & Leaver, J. D. Changes in chemical composition and nutritive value of urea treated whole crop wheat during exposure to air. Anim. Feed Sci. Tech. 102 (1-4):181-195, 2002.
10. Honing, H. & Woolford, M. K. Changes in silage expousure to air. In: Forage conservation in the 80's. Proceedings Oxford, British Grassland. Brighton, UK: European Grassland Society, 1979.
11. Jobim, C. C.; Nussio, L. G.; Reis, R. A. & Schmidt, P. Avanços metodológicos na avaliação da qualidade da forragem conservada. Rev. Bras. Zootecn. 36 (suppl.):101-119, 2007.
12. Kung Jr., L.; Ranjit, R. N. K.; Chen, J. H.; Golt, C. M. & Pesek, J. D. Microbial populations, fermentation end products, and aerobic stability of corn silage treated with ammonia or a propionic acid-based preservative. J. Dairy Sci. 83 (7):1479-1486, 2000.
13. Mari, L. J. Desempenho de bovinos de corte alimentados com rações contendo cana-de-açúcar (Saccharum officinarum L.) fresca ou ensilada e o padrão de fermentação e a estabilidade aeróbia das silagens aditivadas. Tesis presentada en opción al grado científico de Doctor en Agronomia. Piracicaba, Brasil: Escola Superior de Agricultura Luiz de Queiroz, 2008.
14. Marques, D. H. M.; Lucas, R. C.; Jatobá, R. B. & Guim, A. Composição química e estabilidade aeróbica de silagens de girassol (Helianthus annus L.) emurchecido tratado com inoculante microbiano. In: Jornada de Iniciação Científica da FACEPE. Resumos. Recife, Brasil, 2002. [CD-ROM].
15. Mcguffey, R. K. & Schingoethe, D. J. Feeding value of high oil variety of sun flowers as silage to lactating dairy cows. J. Dairy Sci. 63 (7):1109-1113, 1980.
16. Miranda, D. C. L. Perdas de matéria seca em silagem de cana-de-açúcar tratada com aditivos químicos e microbiológicos. Disertación presentada em opcion al grado científico de Maestre en Producción Animal. Minas Gerais: Universidad Federal de Lavras, 2006.
17. Moura, M. S. C.; Carvalho, F. F. R.; Guim, A.; Marques, D. H. M. & Ferreira, R. C. Efeito de aditivos sobre a velocidade de deterioração de silagem de capim elefante (Pennisetum purpureum Schum). In: 39 Reunião Anual da Sociedade Brasileira de Zootecnia. Piracicaba, Brasil: Sociedade Brasileira de Zootecnia, 2001. [CD-ROM].
18. Pedroso, A. F.; Nussio, L. G.; Loures, D. R. S.; Paziani, S. F.; Ribeiro, J. L.; & Mari, L. J. et al. Fermentation, losses, and aerobic stability of sugarcane silage streated with chemical and bacterial additives. Scientia Agricola. 65 (6): 567-691, 2008.
19. Pedroso, A. F.; Nussio, L. G.; Paziani, S. F.; Loures, D. R. S.; Igarasi, M. S.; Coelho, R. et al. Fermentation and epiphytic microflora dynamics in sugar cane silage. Scientia Agricola. 62 (5): 427-432, 2005.
20. Pedroso, A. F.; Rodrigues A. A.; Barioni Jr, W.; Barbosa, P. F.; Santos, F. A. P. & Nussio, L. G. Aditivos químicos e inoculante bacteriano na ensilagem de cana-de-açúcar: efeitos sobre a fermentação das silagens e o desempenho de garrotes. Rev. Bras. Zootecn. 40 (6):1181-1187, 2011.
21. Pinto, A. P.; Pereira, E. S. & Mizubuti, I. Y. Caracteristicas nutricionais e formas de utilizacao da cana-de-acucar na alimentação de ruminantes. Semina: Ciências Agrárias. 24 (1):73-84, 2003.
22. Santos, E. M. E. & Zanine, A. M. Silagem de gramíneas tropicais. Colloquium Agrariae. 2 (1):32-45, 2006.
23. Santos, M. C.; Nussio, L. G.; Mourão, G. B.; Schmidt, P.; Mari, L. J.; Ribeiro, J. L. et al. Nutritive value of sugar cane silage treated with chemical additives. Scientia Agricola. 66 (2):159-163, 2009.
24. Santos, M. C.; Queiroz, O. C. M. & Nussio, L. G. Microbiologia de forragens conservadas e suas aplicações. In: Anais II Simposio Produção e utilização de forragens conservadas. Maringá: Brasil: Masson. p. 101-116, 2008.
25. Schmidt, P. Perdas fermentativas na ensilagem, parâmetros digestivos e desempenho de bovinos de corte alimentados com rações contendo silagem de cana-de-açúcar. Tesis presentada en opción al grado científico de Doctor en Agronomia. Piracicaba, Brasil: Escola Superior de Agricultura Luiz de Queiroz, 2006.
26. Schmidt, P. Parâmetros de qualidade da cana-de-açúcar e silagem de cana. Curitiba, Brasil: Universidade Federal do Paraná. 2010. http://www.ensilagem.com.br/parametros-de-qualidade-da-cana-de-acucar-e-silagem-de-cana /. [15 /11/ 2012].
27. Silva, D. J. & Queiroz, A. C. Análises de alimentos (métodos químicos e biológicos). 3a. ed. Viçosa, Brasil: Editoria UFV, 2002.
28. Siqueira, G. R.; Reis, R. A.; Schocken-Iturrino, R. P.; Pires, A. J. V.; Bernardes, T. F. & Amaral, R. C. Perdas de silagens de cana-de-açúcar tratadas com aditivos químicos e bacterianos. Rev. Bras. Zootecn. 36 (6): 2000-2009 (supl), 2007.
29. Siqueira, G. R.; Reis, R. A.; Schocken-Iturrino, R. P.; Pires, A. J. V.; Bernardes, T. F. & Roth, M. T. P. Queima e aditivos químicos e bacterianos na ensilagem da cana-de-açúcar. Rev. Bras. Zootecn. 39 (1):103-112, 2010.
30. Sousa, D. P.; Mattos, W. R. S.; Nussio, L. G.; Mari, L. J.; Ribeiro, J. L. & Santos M. C. Efeito de aditivo químico e inoculantes microbianos na fermentação e no controle da produção de álcool em silagens de cana-de-açúcar. Rev. Bras. Zootecn. 37 (9):1564-1572, 2008.
Recibido el 20 de mayo de 2013
Aceptado el 27 de enero del 2014