Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.36 n.3 Ciudad de la Habana sep.-dic. 1997
Artículos Originales
Hospital Universitario "General Calixto García", Ciudad de La HabanaHidroxiapatita en defectos óseos craneales. Comunicación previa
Dra. Susana A. Fernández Benítez,1 Dr. Ramiro Pereira Riverón,2 Dra. Olga Piera Rocillo3 y Dr. Enrique de Jongh Cobo41 Especialista de I Grado en Neurología.
2 Doctor en Ciencias Médicas. Especialista de II Grado en Neurocirugía.
3 Doctor en Ciencias Médicas. Especialista de II Grado en Anatomía Patológica.
4 Especialista de I Grado en Neurocirugía.
RESUMEN
Se exponen los resultados iniciales de un ensayo experimental y clínico, con gránulos de hidroxiapatita como implante en defectos óseos craneales aun radiológicos y microscópicos (BAAF) el tiempo de los pasos de osificación craneal. Hubo crecimiento de fibroblasto en 7 días; en 2 meses y medio, crecimiento de osteoblastos y de hueso intramembranoso. En 3 meses la plastia presentaba consistencia ósea palpable.Descriptores DeCS: HIDROXIAPATITAS/uso terapéutico; IMPLANTE ENDOOSEO/métodos; HEMATOMA EPIDURAL; CRANEO/cirugía; NEURALGIA DEL TRIGEMINO/cirugía; RATAS WISTAR; BIOPSIA CON AGUJA; HEMATOXILINA/uso diagnóstico; EOSINA AMARILLENTA-(YS)/uso diagnóstico.
Después de algunas operaciones por traumatismos craneoencefálicos y tumores que invaden el hueso craneal, quedan defectos óseos con extensión tal que requieren su reparación, para protección cerebral y por razones cosméticas.
Varios materiales han sido empleados para craneoplastias: metales, resinas acrílicas, huesos autógenos o liofilizados y otros. Muchas desventajas se asocian con estos implantes. Algunos provocan reacciones antigénicas al cuerpo extraño o irritación e infección. Otros se aflojan, por la formación de una capa de tejido conjuntivo entre el implante y el hueso craneal. Algunos implantes óseos sufren una resorción importante; pero la mayor desventaja, sobre todo después de operaciones potencialmente contaminadas, como en los traumatismos craneoencefálicos, constituye la necesidad de esperar y realizar una segunda intervención para la craneoplastia.
Para estos casos y defectos óseos o lesiones vertebrales y de otros huesos es que continúa la búsqueda de materiales de sustitución aplicables en la cirugía neuroquirúgica y ortopédica. Implantes que sean biocompatibles, llenen temporalmente el defecto y estimulen el crecimiento del hueso.1-3
El recambio del hueso o proceso de remodelamiento es esencial para la reparación ósea. En sus pasos elementales, la resorción y formación ósea, actúan células diferentes: los osteoclastos, que resorben el hueso; los osteoblastos que controlan la formación de hueso nuevo y sus precursores.
El tejido esquelético es fuente de factores de crecimiento óseo, algunos de los cuales actúan de forma sistémica, pero principalmente, actúan como reguladores locales. El hueso contiene células como los fibroblastos, células progenitoras óseas, osteoblastos y osteoclastos. Todas son capaces de originar factores de crecimiento tales como: factor de crecimiento de los fibroblastos, factor transformador del crecimiento, factor de crecimiento parecido a la insulina, beta2-microglobulina, factor de crecimiento derivado de las plaquetas y factor osteoinductivo.4 El factor de crecimiento de los fibroblastos actúa sobre la replicación de células endoteliales, la neovascularización y aumenta el número de osteoblastos. De ahí su importancia en el proceso de reparación del hueso.
Por otro lado, el factor de crecimiento derivado de las plaquetas es liberado durante la coagulación.5
La renovación ósea depende también del grado de vascularización; por lo que la porosidad del implante es una consideración importante al seleccionarlo, para facilitar el crecimiento del tejido fibrovascular que, posteriormente, se osificará.
Desde 1951 se informó que la hidroxiapatita (HA) es biocompatible y se une bien al hueso, sin reacciones inflamatorias.6 Está compuesta por calcio y fósforo, y su fórmula química es Ca10(PO4)6(OH)2, con una relación calcio:fósforo de 1,67.
Existen estructuras naturales coralinas cuyo exoesqueleto de carbonato de calcio puede ser convertido directamente en HA.7 También se produce artificialmente como cerámica. Su biocompatibilidad se basa en que los iones de calcio y fósforo se difunden libremente en la superficie del implante y son los mismos iones del hueso natural. Esto permite la acumulación de iones de calcio y fósforo en la superficie del implante y su participación en la formación del hueso nuevo.8
La HA es químicamente estable y bien tolerada. En seguimientos de hasta 6 años, no ha producido resorción o reacciones al cuerpo extraño.9,10
En forma comercial se produce como botones de 15 mm de diámetro; placas de 50 x 75 mm, para craneoplastias en defectos óseos mayores de 3 cm y gránulos con diámetros desde 0,3 hasta 0,6 mm, recomendadas por Yamashima11 para defectos craneales de menos de 3 cm
de diámetro. Este autor encontró que, pasados 6 meses, los gránulos se incorporan al hueso vecino y no son distinguibles en estudios radiológicos realizados pocos años después.
En nuestro trabajo en curso, estamos empleando la forma granulada en craneoplastias aun mayores de 3 cm, por ser la variante del producto más fácil de adquirir en nuestro medio y la menos complicada de aplicar, al no requerir premodelación ni remodelación transoperatoria.
Tratamos también de verificar por exámenes radiológicos y microscópicos, el tiempo de los pasos de osificación craneal, tanto de forma experimental como en un ensayo clínico. Presentamos los resultados iniciales.
MÉTODOS
Se empleó el granulado de HA sintética denominado APAFIL-G, producido por el Centro de Biomateriales de la Universidad de La Habana.PARTE EXPERIMENTAL
En ratas Wistar de 400 g de peso, se realizó una craniectomía de 3 mm de diámetro, sin abrir la duramadre. Se cubrió el defecto óseo con HA en gránulos de 0,5 mm de diámetro como promedio.Estudio microscópico; se utilizaron 2 métodos:
1.Biopsia por punción y aspiración con aguja fina (BAAF) en el área de la plastia y coloreado del material con hematoxilina-eosina (HE).
2. (Descalcificación). Extracción y estudio del área de la plastia y su fijación en formaldehído neutro al 10 %. Se descalcificó el tejido y los cortes hísticos se tiñeron por las técnicas de HE y Van Giesson.
ENSAYO CLÍNICO
En defectos óseos craneales, postraumáticos o no, con diámetros menores o mayores de 3 cm, se utilizaron como implante para craneoplastia gránulos de HA de 1,5 a 3 mm de diámetro. En algunos casos se cubrió el defecto craneal con los gránulos suspendidos en sangre del propio paciente, con el doble objetivo de impedir su dispersión y de facilitar la acción local del factor de crecimiento derivado de las plaquetas. En otros se combinaron los gránulos de HA con un volumen igual de serrín de hueso obtenido durante la trepanación, suspendidos también en la sangre del paciente (figura).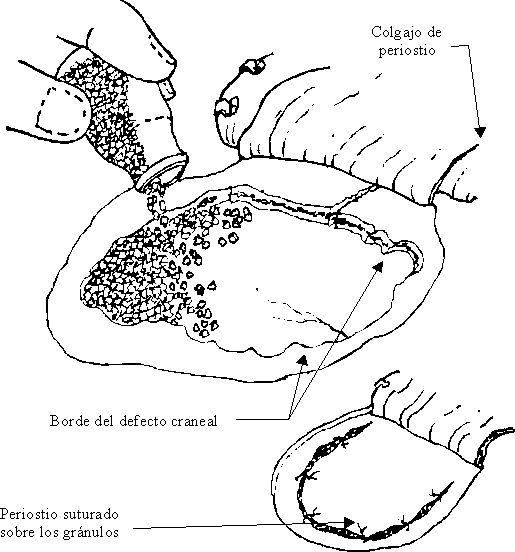
FIGURA. Con gránulos de hidroxiapatita se rellena el defecto craneal. El implante queda después cubierto por el periostio, el plano muscular y la piel.
Se realizaron controles: clínicos para detectar posible irritación local, infecciones, así como la consistencia del implante por palpación; radiológicos para verificar la fusión del implante y microscópicos por BAAF, para comprobar los tiempos de osificación del defecto óseo.
RESULTADOS
Se verificó en la rata 1 sacrificada un mes después de la plastia: BAAF: fibroblastos y algunos capilares; descalcificación: formación de hueso intramembranoso con fibroblastos y osteoblasto.En las ratas 2 y 3 sacrificadas a los 2 meses y medio se observó: BAAF: fibroblastos, capilares, células gigantes escasas con aspecto de osteoclastos y algunas células cuboideas acompañadas de células hemáticas; descalcificación: neoformación ósea a partir de la HA colocada en la plastia y osteoclastos.
En el caso 1, paciente del sexo femenino y 57 años de edad, se realizó craniectomía suboccipital retromastoidea para tratamiento de neuralgia trigeminal. El defecto óseo fue cubierto con una suspensión de gránulos de HA en sangre de la paciente. No se logró un cierre total del periostio sobre los gránulos, sólo un cierre muscular total.
Siete días más tarde, por ocurrir una fístula de líquido cefalorraquídeo (LCR) debida a defecto de cierre de la duramadre, se retiró la craneoplastia de HA. Al examen macroscópico no se observaron signos de sepsis ni de irritación de los tejidos vecinos. Los gránulos de HA mostraban cohesión y, a simple vista, los mantenía unidos una sustancia de aspecto fibrinoide; sin embargo, la concentración de gránulos era mayor en la parte inferior del implante, probablemente por la acción de la fuerza de gravedad al asumir el paciente la posición bípeda y no haber cierre total del periostio.
Para el examen microscópico el material de la plastia se procesó con técnica de descalcificación (ver fase experimental). La HA se encuentra inmersa en un coágulo fibrohemático con zonas donde se aprecian formación de tejido de granulación con fibroblastos, vasos de neoformación y escasa fibrosis.
En el caso 2, paciente del sexo femenino y 18 años, que mostraba hematoma epidural postraumático, se efectuó craniectomía de 3,9 x 3,7 cm de diámetro; la duramadre no fue abierta. El defecto óseo del hueso temporal fue cubierto con gránulos de HA de igual diámetro que en el caso 1 y sangre. Por encima, se suturaron el periostio, el músculo y la piel en 3 planos. La evolución clínica fue satisfactoria. En el último control clínico-radiológico, 3 meses después de la operación, la craneoplastia presentaba consistencia dura (ósea) a la palpación y no había signos locales de rechazo ni de irregularidades en la concentración de los gránulos. En la radiografía simple, se observan los gránulos que cubren el área del defecto, en una imagen igual a la del control posoperatorio inmediato.
DISCUSIÓN
A juzgar por las primeras experiencias, la HA en gránulos puede ser eficiente como implante para craneoplastias aun mayores de 3 cm.Sin embargo, cuando en el área del implante no es posible un cierre hermético del periostio sobre los granulos, al asumir el paciente la posición bípeda, la concentración del granulado puede ser afectada por la fuerza de gravedad; sobre todo durante los primeros días cuando aún la membrana fibrinoide que se forma a partir de la sangre no ha adquirido la solidez suficiente para la cohesión total de la hidroxiapatita.
La información más real de los tiempos de osificación craneal se obtiene por el método de descalcificación. Es más limitada con el método BAAF, único que podemos utilizar en el estudio clínico, sin embargo, entendemos ofrecerá una guía suficiente.
En conclusión podemos decir que las primeras experiencias permiten inferir la eficiencia de la HA en gránulos como material de craneoplastia en defectos óseos aun mayores de 3 cm y las posibilidades de estudiar los tiempos de osificación craneal por el método BAAF.
El cierre total del periostio sobre los gránulos, parece ser importante para prevenir la migración del granulado bajo la influencia de la fuerza de gravedad.
SUMMARY
The initial results of an experimental and clinical assay using hydroxyapatite granules as implants in skull defects over 3 cm are exposed. An attempt is made to verify by clinical, radiological and microscopic examinations (BAAF) the time of the cranial ossification steps. It was observed a growth of fibroblasts in 7 days, and of osteoblasts and intramembranous bone in 2 months and a half. 3 months later the plastic presented a palpable osteal consistency.Subject headings: HYDROXYAPATITES/therapeutic use; DENTAL IMPLANTATION, ENDOSEOUS/methods; HEMATOMA EPIDURAL; SKULL/surgery; TRIGEMINAL NEURALGIA/surgery, RATS; WISTAR; BIOPSY, NEEDLE; HEMATOXYLIN/diagnostic use; EOSINE YELLOWISH-(YS)/diagnostic use.
REFERENCIAS BIBLIOGRÁFICAS
- 1.Burton CV, Mc Fadden JT. Neurosurgical materials and devices: report on regulatory agencies and advisory groups. J Neurosurg 1976;45:251-8.
- Kaufman HH. Voluntary standardization of medical devices and procedures. Neurosurgery 1983;13:464-70.
- Kyoshima K, Gibo H, Kobayashi, S, Sugita K. Cranioplasty with inner table of bone flap. J Neurosurg 1985;62:607-9.
- Canalis E. Factores de crecimiento del hueso. Triángulo 1990;28:13-22.
- Deuel TF, Huang JS. Factor de crecimiento de las plaquetas. J Clin Invest 1984;74:669.
- Ray RD, Ward AA. A preliminary report on studies of basic calcium phosphate in bone replacement. Surg Forum 1951; 2:429-34.
- Roy DM, Linnehan SK. Hydroxyapatite formed from coral skeletal carbonate by hydrothermal exchange. Nature 1974; 247:220-2.
- Rawlings CE. Modern bone substitutes with emphasis on calcium phosphate ceramics and osteoinductors. Neurosurgery 1993; 33:935-8.
- Yamashima T. Reconstruction of surgical skull defects with hydroxyapatite ceramics buttoms and granules. Acta Neurochir (Wien) 1988;90:157-62.
- .Cranioplasty with hydroxyapatite ceramic plates that can easily be trimmed during surgery. Acta Neurochir (Wien) 1989;96:149-53.
- .Modern cranioplasty with hydroxyapatite ceramic granules, buttoms and plates. Neurosurgery 1993;33:939-40.
Dra. Susana A. Fernández Benítez. Hospital Universitario "General Calixto García". Calle 29 esquina a J, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.














