Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.41 n.3 Ciudad de la Habana sep.-dic. 2002
Hospital Universitario Comandante Manuel Fajardo, Ciudad de La Habana
Manejo escalonado en la supuración pleural
Dr. Bruk Bekele Jembere,1 Dr. Orestes N. Mederos Curbelo,2 Dr. Jesús Valdés Jiménez,1 Dr. Juan Carlos Barreras Ortega,3 Dr. Carlos Alberto Romero Díaz,4 y Dr. Alexis Cantero Ronquillo,4
Resumen
Se realizó un estudio de 36 enfermos con empiema pleural, atendidos por el grupo de Cirugía Torácica del Hospital Universitario Comandante Manuel Fajardo entre enero de 1995 y diciembre del 2000. Los enfermos se clasificaron en 3 estadios evolutivos: exudativo, fibrinopurulento y organizado, los que sirvieron de guías para establecer el proceder quirúrgico que se debía realizar. La principal causa fue la neumopatía inflamatoria seguida por las posquirúrgicas. Los gérmenes hallados con mayor frecuencia en los cultivos fueron: el estafilococo, las bacterias gran negativas y el estreptococo. Las intervenciones más realizadas fueron: la pleurotomía mínima con lavado pleural y sin él y la decorticación pleural en sus diferentes variantes. A 3 pacientes se les realizó algún tipo de resección pulmonar. En la fase fibrinopurulenta el 50 % requirió decorticación precoz con el 100 % de curación. En la fase organizada el tratamiento de elección fue la decorticación clásica (62,5 %) o la tardía (18,8 %); los 2 fallecidos fueron de esta fase. Las complicaciones fueron escasas, infecciosas en su gran mayoría; el índice de mortalidad quirúrgica fue 5,6 %.
DeCS: EMPIEMA PLEURAL/cirugía; EMPIEMA PLEURAL/complicaciones; INDICADORES DE MORBIMORTALIDAD; MASCULINO
Las colecciones purulentas en la cavidad pleural son causa de alta mortalidad y su fecuencia disminuye con el desarrollo de la terapéutica antibiótica y la aplicación de la cirugía. Por lo general, se trata de una complicación de un proceso infeccioso pulmonar, con frecuencia mal tratado.1-3 Es significativa su modificación evolutiva, que varía desde derrame serofibrinoso agudo, hasta enquistamiento e inmovilización del pulmón, con adherencias fibrinosas laxas primero y organizadas y firmes después, las cuales forman una verdadera coraza que impide la expansión del pulmón y disminuyen la capacidad ventilatoria del enfermo.4,5
Los factores causales y los problemas que plantean el diagnóstico y la terapéutica han sufrido un cambio importante durante las últimas décadas,6 y destacan el manejo escalonado según el estadio evolutivo.
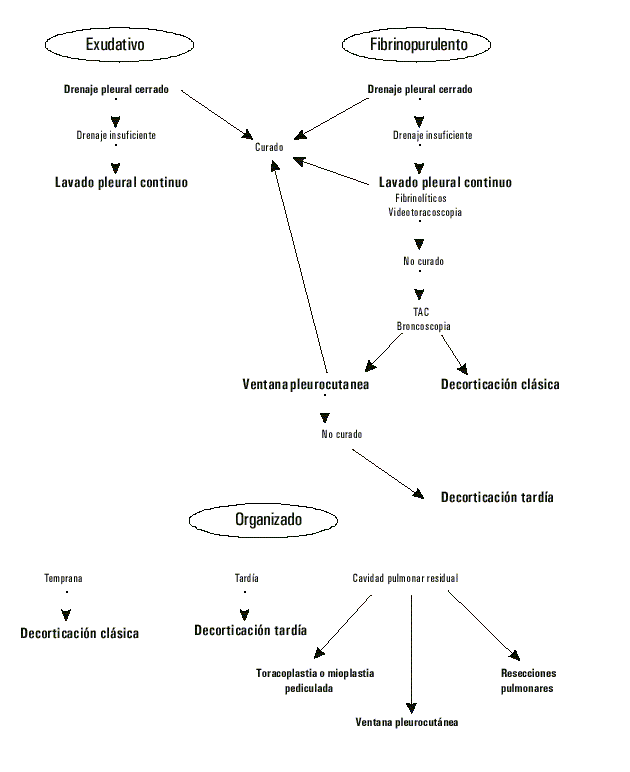
Tomada del general Surgery American Collage of Surgeon 84 th Annual, 1998;3:383-5.
Fig. Algoritmo para el tratamiento del empiema pleural.
Métodos
Se realiza un estudio prospectivo y lineal de los pacientes ingresados en el Hospital Universitario Comandante Manuel Fajardo con el diagnóstico de empiema pleural, en el período comprendido entre enero de 1995 y diciembre del 2000.
Se clasificaron los pacientes según la fase evolutiva de la enfermedad y éstos fueron tratados, en cada caso, siguiendo el algoritmo mostrado en la figura, diseñado por el Grupo de Cirugía Torácica del Hospital.
Toda la información se recolectó en planillas creadas para la investigación, en las que se reflejaban los estudios bacteriológicos del pus extraído de la cavidad pleural a todos los pacientes.
Resultados
El 30,6 % de los enfermos tenía más de 50 años, en una relación hombre/mujer de 3,5 a 1. El 23 % mostraba enfermedades asociadas como asma bronquial, hipertensión, diabetes y cardiopatía.
En la casuística, 18 enfermos (50 %) tenían neumonía lobar; 3 (8,3 %), absceso del pulmón y 2 (5,6 %), neumonía peribronquiectásicas. Esto hace que diferentes formas clínicas de enfermedades infeccioso-inflamatorias inespecíficas del pulmón constituyan el 63,9 %. En segundo lugar estuvieron los empiemas posquirúrgicos (13,9 %); 4 (11,1 %), tras resecciones pulmonares totales o parciales y 1 (2,7 %) pospleurotomía mínima (tabla 1).
Tabla 1. Causas de empiema
| Enfermedad causal | No. | % |
| Neumonía bacteriana | 18 | 50,0 |
| Tuberculosis pulmonar | 4 | 11,1 |
| Posresección pulmonar | 4 | 11,1 |
| Absceso del pulmón | 3 | 8,3 |
| Bronquiectasia | 2 | 5,6 |
| Herida por arma blanca | 2 | 5,6 |
| Cáncer del pulmón | 2 | 5,6 |
| Pospleurostomía | 1 | 2,7 |
| Total | 36 | 100 |
Fuente: Historias clínicas del Archivo del Hospital Universitario
Los microorganismos más frecuentes fueron el estafilococo dorado y el estreptococo, y no se apreció cultivo positivo en 10 enfermos (tabla 2).
Tabla 2. Resultados de cultivos del pus pleural
| Gérmenes aislados | No. | % |
| Estafilococo | 8 | 22,3 |
| Estreptococo | 7 | 19,4 |
| Microbacterium tuberc. | 3 | 8,3 |
| Klebsiella | 3 | 8,3 |
| Pseudomona | 3 | 8,3 |
| Eschericia coli | 2 | 5,6 |
| Cultivos negativos | 10 | 27,8 |
| Total | 36 | 100 |
Fuente: Historias clínicas del Archivo del Hospital Universitario Comandante Manuel Fajardo.
En la fase exudativa se logró la curación con pleurotomía mínima en 5 enfermos y combinado en 2 con lavado pleural continuo. En la fase fibrinopurulenta la decorticación temprana y la ventana de Eldesser fueron 2 tratamientos utilizados y se logró la curabilidad en todos los enfermos que se hallaban en esta fase (tabla 3).
Fueron tratados 16 pacientes en fase organizativa, a 10 (62,5 %) se les realizó decorticación clásica con pleurectomía, a 3 que se encontraban en fase de organización tardía se les realizó paquipleurectomía y los 3 restantes requirieron resecciones pulmonares (2 presentaban abscesos crónicos y en 1 se requirió neumonectomía y en otro lobectomía) (tabla 3).
Tabla 3. Tratamiento escalonado según estadios en el empiema
| Tratamiento | No. |
| Exudativo | |
| - Toracocentesis | 1 |
| - Pleurotomía mínima | 3 |
| - Pleurotomía mínima con lavado pleural | 2 |
| Total | 6 |
| Fibrinopurulento | |
| - Pleurotomía mínima | 1 |
| - Pleurotomía mínima con lavado pleural | 3 |
| - Ventana torácica | 3 |
| - Decorticación precoz | 7 |
| Total | 14 |
| Organizado | |
| - Decorticación clásica | 10 |
| - Decorticación tardía | 3 |
| - Neumectomía | 2 |
| - Lobectomía y pleurectomía parietal | 1 |
| Total | 16 |
Fuente: Historias clínicas del Hospital Universitario “Comandante Manuel Fajardo”.
El otro paciente neumectomizado fue un herido por arma blanca, con antecedentes de tuberculosis pulmonar, tratado en otro centro con una lobectomía superior derecha, al que le quedó como secuela una fístula broncopleurocutánea y una cavidad empiemática.
Las complicaciones más frecuentes fueron las sépticas: respiratorias, urinarias, vasculares y de la herida, con 2 fallecidos (5,6 %); una enferma con empiema de semanas de evolución y un deterioro pulmonar que requirió neumectomía con ligadura vascular intrapericárdica, y murió por fibrilación ventricular. El otro paciente fue un hombre con una decorticación tardía y paquipleurectomía, el cual falleció por disfunción múltiple de órganos (tabla 4).
Tabla 4. Complicaciones
| Complicaciones | No. | % |
| Neumonía | 4 | 11,1 |
| Infección urinaria | 3 | 8,3 |
| Flebitis | 3 | 8,3 |
| Infección de la herida | 2 | 5,6 |
| Fallecidos | 2 | 5,6 |
Fuente: Historias clínicas del Hospital Universitario “Comandante Manuel Fajardo”.
Discusión
El empiema pleural se produce independientemente de la edad y el sexo, sin patrones de frecuencia específicos. En los últimos años ha cambiado, de una enfermedad de niños y jóvenes a una de viejos y débiles.6-8
La Sociedad Americana de Cirugía Torácica divide la evolución del empiema en 3 etapas evolutivas: exudativa, fibrinopurulenta y organizada.
En la etapa exudativa el líquido es claro, con poca celularidad, a diferencia de la fibrinopurulento, la que se muestra con abundantes leucocitos polimorfonucleares y depósitos de fibrina que inician la fijación del pulmón y la proliferación fibroblástica y en la fase organizada lo típico es una gruesa capa de fibrina que en forma de coraza impide los movimientos del pulmón.6,9,10
La antigua clasificación del empiema en agudo y crónico según el tiempo de evolución (cuyo límite se fijaba en la 6ta semana) tiene la rigidez que impone cualquier límite arbitrario.
Los microorganismos más comúnmente hallados coinciden con los de trabajos publicados.4,6,11,12
En el pasado los gérmenes más frecuentes eran el neumococo y otros estreptococos, en la actualidad han sido desplazados por el estafilococo y los gérmenes gramnegativos.
La colección purulenta en el espacio pleural es un problema grave que, salvo excepciones, requiere tratamiento quirúrgico.
En las etapas iniciales del empiema es posible aspirar el líquido pleural a través de una aguja gruesa (toracocentesis),4,5,13,14 además de antibioticoterapia empírica y medidas generales, que deben ser efectuadas con prontitud para evitar complicaciones mayores. Si el líquido se reacumula o no puede evacuar completamente se efectúa pleurotomía mínima en el sitio de mayor declive de la cavidad empiemática. En caso de empiema libre o unilocular se deberá extraer la totalidad y en el empiema multiloculado es necesario comunicar las cavidades empiemáticas o drenarlas por separado. El drenaje por pleurotomía tiene un riesgo ínfimo y ofrece mayor número de curaciones bacteriológicas, anatómicas y funcionales, y es el método de elección en los primeros 10 días de la enfermedad.6,11-14
Si hay dificultad en el drenaje, además del tubo de pleurotomía se puede insertar un catéter en el segundo espacio intercostal e instilar líquidos de soluciones salinas con fibrinolíticos o sin éstos, y se podrán utilizar sustancias fibrinolíticas con actividad intrapleural como la estreptoquinasa.9
Cuando no se obtiene la reexpansión por lesiones parenquimatosas demostradas por tomografía axial computadorizada y se presume la necesidad de evacuación pleural prolongada, se realiza una ventana pleurocutánea; para ello se requiere cierto grado de depósito de fibrina en la pleural.5,6
Si a las 2 semanas del inicio de la enfermedad no se comprueba reexpansión franca y sin lesiones endobronquial y parenquimatosa, se realiza una decorticación temprana o precoz, que permite el desbridamiento sobre una fina lámina de fibrina y las maniobras de limpieza. Este proceder se alterna actualmente con la videotoracoscopia, la cual permite remover los detritus bajo visión directa y drenar la cavidad.4,6-8
Esta conducta agresiva se justifica por el control toxinfeccioso, la prevención del tabicamiento y el menor tiempo con drenaje pleural simple, lo que acorta la estadía hospitalaria. Se contraindica en lesiones pulmonares crónicas, fibrosas o agudas como los abscesos del pulmón.2,3
De los 6 enfermos con supuración pleural en fase exudativa, 5 requirieron pleurotomía, y de ellos en 2 fue necesario el lavado continuo (tabla 3). En la fase fibrinopurulenta se trataron a 14 enfermos y a 7 se les realizó decorticación precoz y ventana de Eldesser a 3; a 3 pacientes se les curó con pleurotomía y lavado continuo y a 1 con pleurotomía solamente.
En la fase organizada se efectuaron procederes complejos, con aumento de la morbilidad y mortalidad. En un estadio no muy tardío el pulmón conserva, a veces, su facultad de reexpansión luego de meses, si la afección está localizada en la pleura. En los tuberculosos, cuando el daño parenquimatoso no es significativo o se presume sea reversible, se espera la negativización del BAAR; antes de decorticar se espera que el enfermo se recupere de la fase aguda, con tratamiento específico de 4 drogas, no obstante lo ideal sería tratarlo con punciones evacuadoras repetidas.
La decorticación clásica comprende la exéresis de la cáscara lo más completa posible de la pleura visceral (incluida la diafragmática), seguida de pleurectomía parietal.
Las técnicas mininvasivas están contraindicadas en este período. La decorticación tardía o paquipleurectomía se realiza en el período de organización tardía, donde el nuevo tejido reemplaza a la pleura hasta hacerla desaparecer. Si la lesión requiere una resección quirúrgica se realiza acompañada de pleurectomía parietal y decorticación del pulmón residual.
La mortalidad promedio informada varía de 1 a 19 % y puede llegar hasta el 23 %, y sus causas principales fueron: la enfermedad maligna y la sepsis por gérmenes anaerobios y gramnegativos.2,12
El éxito en el tratamiento de este síndrome consiste en el manejo agresivo y acertado en cada uno de los estadios, teniendo en cuenta todos los factores involucrados en la elección del proceder quirúrgico que se debe realizar, para evitar que los enfermos avancen a etapas más tardías.1,2,11,14
Se puede concluir en que la principal causa del empiema en nuestra serie fue la neumopatía inflamatoria seguida por la resección pulmonar. Los pacientes en la fase exudativa fueron generalmente continuo o sin él. En la fase fibrinopurulenta se utilizaron diversos métodos quirúrgicos de tratamiento primario, pero el 50 % de los enfermos requirió decorticación precoz con 100 % de curación. Por último en el estadio de empiema organizado el tratamiento de elección fue la decorticación clásica (62,5 %) o la tardía (18,8 %), con un índice de curación de 87,5 %. La complicación posoperatoria más frecuente fue la neumopatía inflamatoria nosocomial (28,6 %), y la mortalidad de la serie fue de 5,6 %.
Summary
A study of 36 patients with pleural empyema that were attended by the Group of Thoracic Surgery from Comandante Manuel Fajardo Teaching Hospital from January, 1995, to December, 2000, was conducted. Patients were classified into 3 evolutive stages:exudative, fibrinopurulent and organized, which were used as guides to determine the surgical procedure to be performed. The main cause was inflammatory pneumopathy followed by the postsurgical ones. The germs most commonly found in cultures were: staphylococcus, Gram-negative bacteria and streptococcus. The most used operations were: minimum pleurotomy with and without pleural lavage and pleural decortication in its different variants. 3 patients underwent some type of lung resection. In the fibrinopurulent stage, 50 % required early decortication with 100 % of healing. In the organized stage, the election treatment was classic (62.5 %) or late (18.8 %) decortication. The two dead patients were included in this stage. There were a few complications, and most of them were infectious. Surgical mortality rate was 5.6 %.
Subject headings: EMPYEMA, PLEURAL/surgery; EMPYEMA, PLEURAL/complications; INDICATORS OF MORBIDITY AND MORTALITY; MALE.
Referencias bibliográficas
- Mandal Ak, Thadepalli H. Treatment of spontaneous bacterial thoracic empyema. J Thorac Cardiovasc Surg 1988; 39: 121-6.
- Grant DR, Finley RJ. Empyema: analysis of treatment technique. Can J Surg 1985; 28: 449-51.
- Lemmer JH, Botham MJ, Orringer MB. Modern management of adult thoracic ampyema. J Thorac Cardiovac Sug 1985; 90: 949-55.
- Serge O. Tratamiento del empiema en niños. Revisión de la literatura. Rev Col Cirugía 1997; 12 (3) 211-18.
- Jebrak G, Pointer P, Pichot MH. Purulent pleurisy and empyema with the exception of pleural tuberculosis. Press Med 1998; 27 (37): 1924-31.
- Alfageme I, Muñoz F, Peña N. Empyema of the thorax in adults: etiology, microbiologic findings and management. Chest 1993; 103: 839-43.
- Streinbrecher HA, Najimalsin AS. Thoracoscopy for empyema in children. J Pediatr Surg 1998; 33 (5): 708-10.
- Kern JA, Rodgers BM. Thoracoscopy in the management of empyema in children. J. Pediatr Surg 1993; 28: 1128-32.
- Davies CW, Lok S, Davies RJ. The systemic fibrinolytics of intrapleural streptokinase. Am J Resp Crit Care Med 1998; 157 (1): 328-30.
- Striffeler H, Gugger M, Imhof, Cervy A, Furner M, Ris HB. Video assisted thoracoscopic surgery for fibrinopurulent pleural empyema in 67 patients. Am Thorac Surg 1988; 65 (2) 319-23.
- Wher CJ, Adams RB. Thoracic empyema: a ten-years experience. South Med J 1986; 79: 171-6.
- Jess P, Brynitz S, Moller AF. Mortality in thoracic empyema. Scand J Thorac Cardiovasc Surg 1984; 18: 85-7.
- Hunnam GR, Flower CD Radiologicaly-guide percutaneous catheter drainage of empyemas. Clin Radiol 1988; 39: 121-6.
- Mandal AK, Thadepalli H Treat of spontaneous bacterial thoracic empyema. J Thoracic Cardiovasc Surg 1987; 94: 414-18.
Recibido: 18 de octubre del 2001. Aprobado: 14 de enero del 2002.
Dr. Bruk Bekele Jembere. Hospital Universitario Comandante Manuel Fajardo, Zapata y D, Vedado, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Cirugía General.
2 Especialista de II Grado en Cirugía General. Profesor Auxiliar de Cirugía General.
3 Especialista de II Grado en Cirugía General. Instructor de Cirugía General.
4 Especialista de II Grado en Cirugía General. Asistente de Cirugía General.