Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión impresa ISSN 0034-7493versión On-line ISSN 1561-2945
Rev Cubana Cir v.45 n.1 Ciudad de la Habana ene.-mar. 2006
ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO
INTRODUCCIÓN
Los procesos metabólicos intracelulares producen ácidos, es decir, sustancias capaces de liberar iones H+ , por oxidación de los hidratos de carbono y las grasas; si es completa da lugar a ácido carbónico (C03H2) y si es incompleta, a ácidos orgánicos, como pirúvico, láctico, acetoacético, betahidroxibutirico, etcétera; también a expensas de los compuestos orgánicos de las proteínas (a partir del fósforo y el azufre que contienen), se forman ácidos.
De igual manera, se forman sustancias capaces de aceptar iones H +, llamadas bases, de lo que resulta la existencia de un justo equilibrio entre la producción de unos (ácidos) y otras (bases), lo que permite un estado normal de neutralidad de los líquidos corporales.
El equilibrio ácido-base del organismo es posible merced a la interrelación de tres sistemas:
- Tampones intra y extracelulares, que amortiguan la intensidad de los cambios agudos del equilibrio ácido-base.
- La compensación respiratoria, íntimamente relacionada con el sistema anterior.
- La excreción renal del exceso de ácidos.
La concentración de iones H+ , existentes en el líquido extracelular, se simboliza por pH, estando su valor entre 7,35 y 7,45; la vida humana se desenvuelve entre límites muy estrechos de pH.
- Acidemia se define como una disminución en el pH sanguíneo (o un incremento en la concentración de H+) y alcalemia como una elevación en el pH sanguíneo (o una reducción en la concentración de H+ ).
- Acidosis y alcalosis se refieren a todas las situaciones que tienden a disminuir o aumentar el pH, respectivamente.
- Estos cambios en el pH pueden ser inducidos en las concentraciones plasmáticas de la pCO2 o del bicarbonato.
- Las alteraciones primarias de la pCO2 se denominan acidosis respiratoria (pCO2 alta) y alcalosis respiratoria (pCO2 baja). Cuando lo primario son los cambios en la concentración de CO3H- se denominan acidosis metabólica (CO3H- bajo) y alcalosis metabólica (CO3H- alto). Con sus respectivas respuestas metabólicas y respiratorias que intentan mantener normal el pH.
- La compensación metabólica de los trastornos respiratorios tarda de 6 a 12 horas en empezar y no es máxima hasta días o semanas después, y la compensación respiratoria de los trastornos metabólicos es más rápida, aunque no es máxima hasta 12-24 horas. Las características de las alteraciones ácido-base y sus respuestas compensadoras se describen en la Figura 1.
FIGURA 1.
--------------------------------------------------------------------------------------------------------------------------------
1.1. Ante todo trastorno del equilibrio ácido-base se debe trazar la siguiente estrategia:
- Identificar de que tipo de trastorno se trata.
- Saber si la compensación es adecuada.
- Conocer la causa del trastorno ácido-base.
1.1.1. Para ello se emplean cuatro parámetros básicos :
1.1.1.1 Concentración plasmática de H+ que en la práctica se mide como pH ( logaritmo negativo de la concentración de H+). Valores normales: 7,35 -7,45 que equivale a una concentración de H+ de 40 +/- 5 nM. Indica la gravedad del trastorno.
1.1.1.2 La presión parcial de CO2 arterial (pCO2) . Valores normales : 35-45 mmHg. Se consideran valores críticos: menos de 20 y más de 70 mmHg. Indica la respuesta respiratoria.
1.1.1.3 La concentración plasmática de bicarbonato o CO2 total. Valores normales de CO3H- : 21-29 mEq/l (mEq/L = mMol/l). Se consideran valores críticos menos de 10 y más de 40 mEq/l. Indica el estado de los sistemas tampón.
1.1.1.4 El anión Gap (intervalo ó brecha aniónica). Diferencia entre las principales cargas positivas y negativas del plasma. Valores normales : 12 +/- 5mEq/l. Orienta el diagnóstico diferencial.
Anión Gap = (Na+) - ﴾ (Cl-) + (CO3H-) ﴿
1.1.1.5 También son de interés :
1.1.1.5.1 Valores normales de PO2 en sangre:
- Arterial: 95- 100 mmHg
- Capilar: 95- 100 mmHg
- Venosa: 28- 40 mmHg
Una disminución de la P02 por debajo de 95 mmHg se conoce como hipoxemia; por debajo de 80 ya se considera moderada y menor de 60, severa o grave.
Recordar que el pulmón envejece igual que el resto del organismo, lo que altera la difusión de los gases. En pacientes entre 60 y 90 años de edad que respiren aire atmosférico, la PaO2 "aceptable" puede calcularse mediante la fórmula: PaO2 = 140 - edad en años .
Ej. Con 75 años la PaO2 "aceptable" será (140 - 75 = 65) de 65 mmHg y no por este valor necesita terapéutica con oxígeno. Mayores de 90 años, la PaO2 normal se considera que es de 50 mmHg y a cualquier edad, una PaO2 menor de 40 mmHg se considera una hipoxemia grave.
1.1.1.5.2 Valores normales Hb02 en sangre: la saturación de la hemoglobina es la resultante del proceso de hematosis que depende de la P02:
- Arterial: 97 % — 100 %
- Capilar: 97 % — 100 %
- Venosa: 62 % --- 84 %
Cuando los valores de la Hb02 están por debajo de 97 % se dice que existe hipo saturación de la hemoglobina, que será moderada si está por debajo de 85 % y severa cuando es menor de 75 %.
1.2 El pH normal del líquido extracelular se debe a que todos los líquidos del organismo son ligeramente alcalinos, el pH de la sangre arterial es de 7,4 y la sangre venosa tiene un pH de 7,3.
- El estudio del equilibrio ácido básico, se basa fundamentalmente en el análisis de la hemogasometría arterial o del capilar arterializado y del nomograma. La hemogasometría venosa no resulta de utilidad en el análisis del estado ácido básico del paciente, por lo que no debe emplearse con este fin.
- Los límites extremos de pH, valores incompatibles con la vida se encuentran en cifras inferiores a 6,80 y superiores a 7,80. La excepción a esta regla está dada por la acidosis de la cetoacidosis diabética.
- Los límites permisibles de pH, son los valores superiores a 7,30 e inferiores a 7,50, en los que casi nunca se necesitará de su corrección en caso de constituir trastornos agudos (Cuadros 1 y 2 ).
Cuadro 1. Valores hemogasométricos normales
| Mediciones | Unidades | Arterial | Venoso | |
| pH | - | 7,35 - 7,45 | 7,28 - 7,35 | |
| PCO2 | mmHg | 35 - 45 | 45 - 53 | |
| TCO2 | mmol/L | 22 - 29 | 24 - 31 | |
| SB | mEq/L | 21 - 25 | 21 - 25 | |
| EB | mEq/L | ± 2,5 | ± 2,5 | |
| PO2 | mmHg | 95 - 100 | 28 - 40 | |
| SaO2 | % | 97 - 100 | 62 - 84 | |
Cuadro 2. Valores hemogasométricos «permisibles»
| Mediciones | Unidades | Arterial | Venoso | |||||
| pH |
| 7,30 - 7,50 | 7,25 - 7,40 | |||||
| PCO2 | mmHg | 30 - 50 | 40 - 60 | |||||
| TCO2 | mmol/L | 22 - 29 | 24 - 31 | |||||
| SB | mEq/L | 21 - 27 | 21 - 27 | |||||
| EB | mEq/L | ± 5 | ± 5 | |||||
| PO2 | mmHg | 70 - 100 | 29 - 40 | |||||
| SaO2 | % | 90 - 100 | 35 - 60 | |||||
2. Secuencia para la interpretación de una gasometría en los desequilibrios ácido-básicos
2.1 Ver si el pH habla de "emia" o de "osis", significando "emia", que el valor de pH en sangre es anormal (fuera del rango de 7,35-7,45), pues hay muchas acidosis y alcalosis sin acidemia ni alcalemia, o sea con pH en sangre en rango normal. La acidemia o alcalemia siempre es aguda, descompensada, de obligado tratamiento, mientras que las acidosis o alcalosis son crónicas, más o menos compensadas. Así, la acidosis respiratoria crónica ( PCO2 arterial > 50 mm Hg y pH arterial > 7,30 ) es compensada por definición y en su presencia hay que normalizar el pH, no la PCO2.
2.2 Después del pH, mirar la PCO2 para valorar si la ventilación es adecuada.
2.3 Después mirar la cifra de bicarbonato actual (HCO3-) para valorar si la compensación es adecuada, calculando el pH predicho y otros valores.
3. Mecanismos de compensación
Los mecanismos de compensación ácido-básico son de tres tipos:
- Tamponamiento físico-químico plasmático: es la defensa inicial siendo el bicarbonato el tampón principal.
- Ajustes ventilatorios : también muy rápidos en el tiempo.
- Cambios en la acidificación renal : más lento, tarda días .
3.1 Así, un aumento primario por causas respiratorias de la PCO2 de 10 mmHg, ocasiona siempre un descenso del pH de 0,05 unidades y un aumento del bicarbonato de 1 mmol/L si el trastorno es agudo y de 4 mmol/L si es crónico.
3.2 Una disminución primaria del bicarbonato de 10 mmol/L, debe disminuir secundariamente la PCO2 en 10 mmHg, mientras que por cada 10 mmol/L de aumento de bicarbonato, la PCO2 compensa en 6-7 mmHg, con un límite de hasta 60 mmHg. Como la relación PCO2/pH es de 10/0,05 = 200 en acidosis respiratorias y de 10/0,1 = 100 en alcalosis respiratorias, el cálculo del pH predicho o teórico, compensador de la variación de PCO2 se simplifica con la aplicación de las siguientes fórmulas :
Cálculo del pH predicho ó teórico compensador de la variación de PCO2 :
pH predicho = 7,40 - { (PCO2 - 40) / 200 } en casos de acidosis.
pH predicho = 7,40 + [ ( 40 – PCO2) / 200 } en caso se alcalosis.
Si el pH predicho, coincide con el pH medido, la alteración es respiratoria; si no coincide pero va en la misma dirección, el desequilibrio ácido-base puede ser de causa doble, mixto, o combinado o hay compensaciones; cuando el pH medido y el predicho por la variación de PCO2 van en direcciones opuestas, el desequilibrio es metabólico.
3.3 Hay una serie de reglas o fórmulas de fácil memorización, como es la Regla de los ochos, para calcular el bicarbonato esperado a partir del pH y de la PCO2. Así, a un pH de 7,6, le corresponde un bicarbonato de 8/8 de la PCO2; a pH de 7,5, el bicarbonato debe ser 6/8 de la PCO2; a pH 7,4, el bicarbonato es 5/8; a 7,3 será 4/8, y a pH de 7,2, el bicarbonato debe ser en trastornos simples, 3/8 de la PCO2.
Ej.: Si pH = 7,4 y PCO2 = 35; el HCO3- = 35 x 5/ 8 = 21,8 mEq/l.
3.4 Por tratarse de un sistema de dos salidas, respiratoria y renal, y varias entradas de bicarbonato (formación en riñón, hígado y tubo digestivo), existen múltiples compensaciones en los trastornos ácido-básicos metabólicos y respiratorios y entre estos y los niveles de potasio séricos. Las compensaciones inadecuadas representan un factor de gravedad adicional del trastorno ácido-básico, por lo que siempre deben estar presentes en la evaluación de estas alteraciones. Las principales compensaciones son la siguientes :
- En la acidosis metabólicas : Por cada mMol / l de descenso del HCO3- debe haber un descenso de 1 mmHg de pCO2.
- En la alcalosis metabólica : Por cada mMol / l de aumento de HCO3- debe haber un aumento de pCO2 de 0,7 mmHg.
Diferencias de la pCO2 con respecto a las previsibles indican la posibilidad de un trastorno mixto (respiratorio y metabólico).
3.5 Compensaciones del potasio
3.5.1 Por cada 0,1 unidades que aumenta o disminuye el pH plasmático (pH p) , el K+ p debe cambiar 0,6 mMoles / l aproximadamente, en sentido inverso al del cambio del pH ( si el pH sube el K+ baja ; si el pH baja el K+ sube ) .
3.5.2 El hallazgo de valores normales de potasio en presencia de acidosis indicaría la existencia de una hipopotasemia que podría pasar inadvertida si no se valoran las adaptaciones.
3.6 En pacientes con compensación respiratoria de una acidosis metabólica debemos inquietarnos ante dos situaciones :
3.6.1 Presencia de valores extremadamente bajos (menos de 15 mmHg) de pCO2 pone de manifiesto que la capacidad compensadora está alcanzando su límite, tras lo cual puede venir un grado letal de acidosis.
3.6.2 Falta de un descenso compensador adecuado de la pCO2 indica la presencia de un problema respiratorio sobreañadido que puede resultar peligroso si la acidosis metabólica se acentúa.
ACIDOSIS Y ALCALOSIS METABÓLICAS
La Acidosis se define como aquel proceso fisiopatológico que tiende a añadir ácido o eliminar álcali de los líquidos corporales, mientras que la Alcalosis es cualquier disturbio que tiende a excretar ácido o aportar bases.
4. ACIDOSIS METABÓLICA (ACM)
En ella se produce un descenso de la concentración de HCO3- de forma primaria. En la ACM no compensada, gasométricamente se observa descenso sérico del pH y del HCO3- con un valor de PCO2 dentro de límites normales, no obstante dado que la respuesta compensadora del pulmón sucede en escasos minutos el patrón gasométrico más frecuentemente encontrado es reducción del pH, HCO3- y PCO2 sanguínea.
4.1 Etiología.
La ACM puede estar producida por una mayor producción o aporte exógeno de ácidos no volátiles, por una disminución de su excreción renal o por una pérdida excesiva gastrointestinal o renal de HCO3- (Cuadro 3).
|
Cuadro 3. Disturbios que conllevan a la acidosis metabólica
|
4.1.1 El principio de electroneutralidad de los líquidos corporales establece que:
- La suma de la carga positiva de los cationes Na+ y K+ y la negativa de los aniones Cl- y HCO3- y de aquellos no medibles de forma rutinaria, debe ser equivalente.
- A estos últimos aniones, los no medibles rutinariamente, se les conoce como anión gap o hiato aniónico ( valores normales 12 +/- 5) y está constituido en su gran mayoría (50 %) por proteínas ( albúmina principalmente) ; sulfatos y fosfatos derivados del metabolismo hístico ; lactato y cetoácidos que provienen de la combustión incompleta de carbohidratos y ácidos grasos.
- Su cálculo ﴾ anión gap = Na+ - ( Cl- + HCO3-) ﴿ puede ayudar a diferenciar el mecanismo patogénico responsable de la ACM y poder clasificarlas (Cuadro 4).
4.2 Clasificación de las ACM
Cuadro 4. Causas de acidosis metabólica

4.2.1 Con anión gap aumentado.
- Requieren un diagnóstico precoz puesto que la hemodiálisis puede ser vital.
- Los hallazgos clínicos y la existencia de una acidosis metabólica con anion gap aumentado junto con gap osmolar elevado nos deben hacer sospechar el diagnóstico.
- El gap osmolar es la diferencia entre la Presión osmótica medida por el laboratorio y la calculada, la que no debe ser mayor de 10mOsm/L, se obtiene aplicando la siguiente fórmula :
glucosa BUN
P osmótica calculada (mOsm/Kg.) = 2 x Na + -------- + ---------
18 3
estas últimas expresadas en mg%. También se puede aplicar (2 x Na) + (Glucosa/18) + (Urea/6).
- Cuando el gap osmolar es mayor a esta cifra indica la presencia de alguna sustancia osmóticamente activa no habitual en el plasma ( etanol, cetonas, lactato, manitol, etilenglicol, metanol) .
- Se originan, en términos generales, de un incremento de la producción o aporte de ácidos. En un paciente con anión gap aumentado debemos pensar, resumiendo al máximo, en la existencia de una cetoacidosis diabética y/o una acidosis láctica hasta que no se demuestre lo contrario.
4.2.1.1 Acidosis láctica: Es la causa más común de acidosis de los pacientes en UCI. La mayoría de los autores la definen como acidosis metabólica con un nivel de ácido láctico por encima de 5 mmol/l. Dividiéndolas en dos tipos: hipóxica (tipo A) y no hipóxica (tipo B) (Cuadro 4). El lactato es un producto normal de la glicólisis anaerobia. La acidosis D-láctico, generalmente implica una producción exógena e introducción en el paciente, puesto que los humanos no podemos producir la isoforma D-láctico. Se han descrito en síndromes de intestino corto por sobrecrecimiento bacteriano, y también en los líquidos de hemodiálisis y diálisis peritoneal, así como en el Ringer lactato que contiene esta forma racémica. El D-lactato es neurotóxico y cardiotóxico.
4.2.1.2 Cetoacidosis: Ocurre por sobreproducción hepática de ácido-acético y beta-hidroxibutírico debido a la disminución en la utilización de glucosa por una deficiencia absoluta o relativa de insulina . También puede darse en los alcohólicos desnutridos que no han bebido en los últimos días con vómitos, en donde la alcoholemia es nula o muy baja, así como glucemia normal o baja, en dónde el acúmulo de cuerpos cetónicos se debe a la liberación de ácidos grasos libres desde el tejido adiposo por una lipolisis activa como consecuencia de la disminución de los niveles de insulina con aumento del cortisol y de la hormona del crecimiento . Puede existir acidosis láctica concomitante.
4.2.1.3 Tratamiento
- Bloquear la fuente de producción de ácidos.
- La reposición de bicarbonato debe ser sólo la necesaria para evitar riesgos. Administrar bicarbonato hasta aumentar el bicarbonato sérico a 10-12 mEq/L. ( ámpulas de 20 ml de bicarbonato de sodio al 4 y 8% con 9.5 y 19 mEq del producto, respectivamente ) .
- Se recomienda administrar la mitad de lo calculado inicialmente y continuar con la corrección con futuras gasometrías, si la causa de dicha acidosis continúa sin resolverse.
- El bicarbonato infundido se limita en principio al espacio intravascular, produciendo un gran aumento en la concentración de bicarbonato plasmático, tardando 15 minutos en equilibrarse con el líquido extracelular total y de 2 a 4 horas con los tampones intracelulares y óseos. Por este motivo si realizamos el control analítico poco después de la administración de bicarbonato podemos sobrestimar sus efectos.
- Los riesgos potenciales de la administración de bicarbonato son la hipernatremia, la hipercapnia, la acidosis intracelular y del LCR, la sobrecarga de volumen, tetania, alcalosis postratamiento con hipopotasemia extrema.
4.2.1.3.1 Cálculo de la reposición del bicarbonato:
- En acidosis no extremas, CO3H- entre 6-10 mEq/l , multiplicar el déficit de bicarbonato﴾Bicarbonato diana – (CO3H-) p ﴿ x 0.5 del peso corporal en Kg. En grados menores de acidosis sustituir el valor 0.5 de la ecuación por 0,2 , 0,3 ó 0,4 .
- En acidosis extremas, CO3H- ≤ 5 mEq/l sustituir el valor 0,5 por 0,8 . En estos casos debe considerarse que toda la capacidad tampón, tanto intracelular como extracelular está agotada, por lo que la reposición ha de ser masiva.
- Conjuntamente se corregirá la hiperpotasemia con la administración combinada de glucosa, insulina y CO3H-.
- La administración de bicarbonato está especialmente indicada en casos de respuesta hiperventilatoria insuficiente, en los que coexista fallo renal y en presencia de intoxicaciones o generadores de ácidos externos.
- Otros métodos de corrección de la acidosis incluye la hemodiálisis, la aspiración de contenido gástrico y administración de pentagastrina, la ventilación mecánica y la expansión del volumen circulante eficaz en pacientes deficientemente prefundidos.
4.2.2 Con anión gap normal.
- Las causas se enumeran en el Cuadro 4. El descenso de bicarbonato plasmático es reemplazado por un aumento del nivel de cloro plasmático para mantener la electroneutralidad.
- En la ACM hiperclorémica o con anión gap normal el mecanismo primario es el descenso de la concentración plasmática de HCO3- que se acompaña de una elevación proporcional del Cl- plasmático. Puede deberse a causas extrarenales ( pérdidas gastrointestinales) o renales.
4.2.2.1 Tratamiento
- El tratamiento con bicarbonato es menos restrictivo que en las ACM con anión gap aumentado.
- Se utiliza sólo si pH < 20 y con el objetivo de subirlo hasta esa cifra.
- En ocasiones con el tratamiento etiológico basta para corregir la acidosis totalmente, pudiendo se perjudicial el uso del bicarbonato al poder desencadenar una alcalosis metabólica.
- Al calcular el bicarbonato a administrar multiplicar el déficit de bicarbonato por 0,5 del peso corporal en Kg y de ello administrar solamente la mitad en 24 h, volviéndolo entonces a calcular de nuevo y corregir parcialmente , evitando la corrección total rápida debido a que la hiperventilación secundaria a la acidosis puede persistir unas horas después de la corrección de la misma produciendo una alcalosis respiratoria.
4.2.3 Con anión gap disminuido
- Proporciona un indicio de la presencia de otros trastornos.
- La brecha aniónica estará reducida si la concentración de Na cae pero no se modifican las de Cl- y CO3H- o, cuando está aumentada la concentración de otro catión en suero, en tanto la osmolaridad sérica permanece normal, como en el mieloma múltiple de la variedad de inmunoglobulina G (IG) si sus proteínas son catiónicas.
- Los síndromes de hiperviscosidad y la intoxicación por bromuros pueden dar brecha aniónica disminuida.
- La intoxicación con litio , la hipermagnesemia y la hipercalcemia aumentan las concentraciones de cationes, no Na, lo bastante para reducir la brecha aniónica.
- También estará disminuida si la concentración de Na permanece normal y aumentan las de cloruro y de bicarbonato.
4.3 El tratamiento de las causas específicas de las acidosis deben de considerarse en los apartados correspondientes.
4.4 Existen otros métodos para el cálculo de los mEq de bicarbonato de sodio a administrar según las indicaciones expuestas, en casos de ACM en general :
Fórmula de Astrup-Mellemgard: mEq = E B x peso en Kg X 0,3
- Del total de lo calculado se acostumbra administrar la 1/2 ó 4/9 EV lentamente con el objetivo de llevar el pH hasta 7.20- 7.30 .
- Si este se encuentra por debajo de 7 se emplea la dosis total calculada.
- En ambos casos se debe realizar una nueva hemogasometría a los 30 minutos para valorar los resultados .
- También se utiliza , de forma práctica, ámpulas de 20 ml de bicarbonato de sodio al 8% en número igual al de la cifra de EB.
- Si no se dispone de ionograma pero se tiene el diagnóstico de ACM severa se pueden administrar : 7 ml de bicarbonato de sodio al 4% lo que incrementa la reserva alcalina en 10 mEq.
5 ALCALOSIS METABÓLICA (ALM)
Llamamos ALM al trastorno del equilibrio ácido-base en el que encontrarnos un pH arterial > 7,45 y un HCO3- plasmático>25 mmol/l como alteración primaria y un aumento de la PCO2, por hipo ventilación secundaria compensatoria (la PCO2, aumenta 0.7 mmHg por cada mmol/l que aumenta el HCO3).
- La concentración de cloro disminuye para compensar la elevación de bicarbonato.
- El anion gap aumenta en proporción a la severidad de la alcalosis (HCO3- > 40 mEq/l) , en el 50 % debido al lactato y en el resto a la concentración de proteínas séricas que además se vuelven más aniónicas a causa de la alcalemia .
- Casi siempre se observa también una hipokaliemia la que no se debe a pérdidas digestivas de potasio sino al aumento de su eliminación urinaria.
5.1 Etiología y cuadro clínico
5.1.1 Las dos causas más frecuentes de alcalosis metabólica son:
- tratamiento con diuréticos .
- pérdidas de secreciones gástricas (Cuadro 5).
Cuadro 5.Causas más comunes de alcalosis metabólica

5.1.1.1 Se clasifican de acuerdo a su respuesta al tratamiento:
- Cloruros sensibles: Pacientes que responden al cloruro y que tienen concentraciones urinarias de cloruro < de 10 mEq/l.
Se ve en pacientes con pérdidas excesivas de ácidos (vómitos, aspiraciones gástricas mantenidas), exceso de diuréticos, administración excesiva de bicarbonatos y uso de antiácidos por vía enteral.
- Cloruros resistentes : Pacientes resistentes al cloruro con cifras de cloruro urinario > 20 mEq/l.
Se ve en pacientes con hiperaldosteronismo que provoca recambio de H+ y Na en los túbulos por bicarbonato, en trastornos renales que aumentan la renina conduciendo a un hiperaldosteronismo secundario.
5.1.2 La mayoría de los pacientes con alcalosis metabólica no tienen manifestaciones clínicas. Los síntomas que se pueden encontrar en la ALM no son específicos. Habitualmente son secundarios a la depleción de volumen o a la hipopotasemia. Cuando el Ca está normal bajo, la ALM puede desencadenar tetania. Pueden verse síntomas a nivel multisistémico:
1. SNC: disminución del umbral epileptógeno, confusión y delirio (normalmente con pH > 7,55).
2. Neuromuscular: debilidad. espasmos, tetania.
3. Cardiovascular: facilita la producción de arritmias, disminuye la eficacia de los antiarrítmicos y favorece la toxicidad por digoxina.
4. Pulmonar: inhibe los quimiorreceptores del centro respiratorio facilitando la hipo ventilación alveolar y desplaza hacia la izquierda la curva de disociación de la oxihemoglobina.
5. Metabólico: Disminuye el Ca con aumento de su unión a proteínas plasmáticas pudiendo desencadenar tetania. Aumenta la producción de lactato y el anión gap.
5.2 Tratamiento
- La ALM no precisa tratamiento específico la mayor parte de las veces.
- Debe corregirse la causa subyacente y la depleción de volumen de K.
- Si existe una fuente exógena de álcali (bicarbonato, citrato, lactato, acetato) lo primero es suspender la fuente que puede estar exacerbando dicha alcalosis.
5.2.1 ALM salino sensible
- El remplazamiento de cloro en forma de ClNa (NaCL al 0,9%), ClK, o ambos, es apropiado para el manejo de las alcalosis con cloro urinario bajo y estados de contracción de volumen (pérdidas de ClH por vómitos o aspiración gástrica).
- La cantidad de Cl a infundir puede calcularse, 0,2 x Kg de peso x (CI deseado - CI medido), a intensidades suficientes para corregir la taquicardia y la hipotensión.
- La dosis inicial no debe sobrepasar los 3 mmol / Kg.
- Los pacientes con succión naso gástrica o vómitos pueden beneficiarse de anti-H2 o inhibidores de H,K-ATPasa (omeprazol) que disminuyan la secreción ácida gástrica, además de corregir el déficit de cloro existente.
- Cuando existe una alcalosis metabólica severa, con sintomatología neurológica o lo bastante grave para producir hipo ventilación importante (PaCO2 > 60 mmHg) se debe administrar ClH endovenoso para disminuir la concentración plasmática de bicarbonato.
- El ClH se da como una solución isotónica al plasma 0,1 a 0,15 N disolviendo 100-150 ml de esta solución en 850-900 ml D5% a pasar en 12 h .
- Si tenemos en cuenta que cada ml de solución de ClH al 0,1 N tiene 1 mmol de H+ y Cl- podemos calcular la cantidad de mmol que necesita el paciente para reducir la concentración de bicarbonato plasmático :

Esta solución aunque isotónica tiene un pH muy bajo y es muy irritante, hay que administrarlo a goteo lento por vía central, haciendo controles de gasometrías a intervalos cortos (30 min - 1 o 2 h) .
- También se utiliza el cloruro de amonio (ámpulas de 20 ml con 83,5 mEq de cloro y de amonio, respectivamente) a dosis de 0,3 X EB x Kg de peso, se administra la ½ de la dosis en 300-500ml de dextrosa 5% en agua, a goteo lento, vigilando estrechamente la tensión arterial.
- El tratamiento de la alcalosis metabólica en pacientes edematosos es más complejo puesto que el cloro urinario está reducido dado que la perfusión renal está disminuida, por tanto la administración de soluciones que contengan cloro no aumentará la excreción de bicarbonato, ya que el volumen de sangre arterial efectivo reducido no se corregirá con este tratamiento.
- Aquí la administración de inhibidores de la anhidrasa carbónica, acetazolamida (250 mg una o dos veces al día oral o iv), puede ser útil para la movilización de líquidos mientras disminuye la reabsorción de bicarbonato en el túbulo proximal.
- Cuando el potasio plasmático es bajo, el uso de diuréticos ahorradores de K como amilorida o espironolactona deben considerarse.
- La hemodiálisis o hemofiltración con baño bajo en acetato, bajo en bicarbonato o alto en Cl, puede ser útil ocasionalmente en pacientes con alcalosis metabólica, sobrecarga de volumen e insuficiencia renal.
- Se ha utilizado sales acidificantes como el clorhidrato de lisina y de arginina (riesgo mayor de hipocaliemia) que en su metabolismo dan ClH como producto final ( contraindicadas si afección hepática).
5.2.2 ALM salino resistente
- En los pacientes con Cloro urinario mayor de 15 mEq/l y un volumen de líquido extracelular normal o expandido, es bastante improbable que respondan a soluciones que contengan cloro. En estos casos lo principal es corregir específicamente la causa.
- En los pacientes edematosos que desarrollan ALM por tratamiento diurético y en los hipermineralocorticismos es fundamental la corrección de la hipopotasemia que mantiene la ALM.
- Deben utilizarse los diuréticos ahorradores de K además de corregir la causa subyacente.
- En el síndrome de Bartter el tratamiento más efectivo son los inhibidores de las prostaglandinas (Indometacina 150 - 200 mg/día).
6. ACIDOSIS RESPIRATORIA (ACR)
La acidosis respiratoria es un trastorno clínico, de evolución aguda o crónica, caracterizado por pH arterial bajo provocado por una elevación de Ia concentración de iones H +, debido a la elevación primaria de la PCO2 y aumento variable en la concentración plasmática de HC03-, como resultado de múltiples factores etiológicos responsables de la falla respiratoria .
6.1 Etiología
- El sujeto normal produce 220 mmol / Kg. /día de CO2, que deben eliminarse a diario del organismo a través de la ventilación pulmonar. El ritmo de excreción de CO2 es directamente proporcional a la ventilación alveolar, por lo que cuando esta disminuye, se provoca una retención de CO2 en el organismo, como mecanismo compensador se produce la reabsorción renal de HCO3-, mecanismo que no funciona a plena capacidad hasta 24 o 36 h después de iniciado el trastorno.
6.1.1 Algunos de los factores responsables de esta falla respiratoria serían:
- Por trastornos mecánicos del aparato respiratorio, tales como: fracturas costales seriadas, fractura del esternón, elevación del diafragma (obesidad, oclusión intestinal, etcétera) ; deformaciones torácicas ( cifoescoliosis, cirugía torácica mutilante, y otros); estrechamiento del árbol bronquial (estenosis traqueal, cuerpo extraño, etcétera); neumotórax, relajantes musculares y otros.
- Por afecciones del parénquima pulmonar, tales como: colapso pulmonar postoperatorio, aspiración bronquial, edema pulmonar, neumonía, status asmático, fibrosis pulmonar.
- Trastornos del centro respiratorio, tales como: trauma craneoencefálico, medicamentos depresores del propio centro, accidentes vasculoencefálicos, edema cerebral.
- Por causas periféricas, tales como: lesión neuromuscular (miastenia, síndrome de Guillain-Barré, etcétera); parálisis periódica familiar; distrofia muscular progresiva; hipopotasemia marcada.
6.2 Cuadro clínico
- Los pacientes con hipercapnia aguda toleran menos el aumento de la PaCO2 que los que tienen hipercapnia crónica, debido a la menor compensación de la primera.
- S e puede afirmar que no existe una estrecha correlación entre las manifestaciones clínicas y el nivel de la PC02.
- Si éste es mayor de 80 mm de Hg. aparecen: contracciones musculares, temblor en aleteo y arritmias cardíacas, hipertensión arterial, estupor.
- Si se origina narcosis por la presencia de CO2 se presentan: cefalea, irritabilidad neuromuscular, desorientación, estupor, coma, aumento de la presión intracraneal, edema papilar, hipertensión arterial por vasoconstricción, bradicardia.
6.2.1 Cuadro hemogasométrico
- pH: arterial y capilar menor de 7,35; venoso menor de 7,28.
- PCO2: arterial y capilar mayor de 45 mm de Hg ; venoso mayor de 53 mmHg.
- BS: arterial, capilar y venoso normal o elevada según la compensación metabólica. En casos que exista acidosis mixta, estaría disminuido.
- EB: arterial, capilar y venoso normal o elevado, según la compensación metabólica. En caso que haya acidosis mixta, estaría disminuido.
- P02: normal o baja, según exista o no permanencia de trastornos de ventilación, difusión, transportación o utilización del 02.
- HBO2: normal o baja, según existan o no trastornos de la P02.
6.2.1.1 El análisis del estado del factor compensador (HCO3-) se realiza mediante la fórmula:
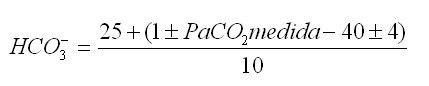
en los trastornos agudos, y :

en los trastornos estables (más de 24 h de evolución).
- El límite de compensación es alrededor de 30 y 45 mEq/L (mmol/L) para los trastornos agudos y estables, respectivamente.
- Si este límite es sobrepasado, se debe sospechar una alcalosis metabólica asociada; mientras que si no es alcanzado, debe pensarse en una acidosis metabólica asociada o en un trastorno de corto tiempo de evolución.
6.2.2 Cuadro electrolítico
- Na: elevado.
- Cl: disminuido.
- K: elevado.
6.2.3 Otras investigaciones
- Según la enfermedad de base o causa etiológica: radiografías del tórax y del cráneo, análisis del LCR..
- En estos pacientes se debe considerar la diferencia alvéolo-arterial de oxígeno, calculada mediante la siguiente fórmula si el enfermo respira aire ambiental sin suplemento de oxígeno:
P(A-a)O2 = 150 - (PaCO2 . 0,8) - PaO2
y que permite la clasificación que se muestra en el Cuadro 6.
Cuadro 6. Acidosis respiratoria. Clasificación según la diferencia alvéolo-arterial de oxígeno
| P(A-a)O2 Normal | P(A-a)O2 Elevada |
| Trastornos del SNC: | Enfermedad pulmonar: |
|
|
| Trastornos del SNP:
| Enf. pulmonar y de la pared:
|
| Trastornos de la pared torácica:
Trastornos de los músculos respiratorios:
Obstrucción de la vía aérea superior:
Mal funcionamiento de los ventiladores mecánicos. |
|
* Síndrome de Ondina.
** Tétanos, órgano fosforados.
6.3 Tratamiento
- Su principal objetivo es superar la hipo ventilación alveolar existente para conseguir la disminución de la PCO2 y revertir el factor desencadenante o la causa etiológica.
- En los estados patológicos agudos se utilizará sin retraso la ventilación artificial (invasiva o no) si se observa un aumento progresivo de la PaCO2 o manifestaciones del sistema nervioso por hipercapnia.
- En los enfermos insuficientes respiratorios crónicos agudizados (EPOC), la conducta es más conservadora, pues éstos la toleran mejor.
- La administración de HCO3- está indicada solamente cuando el pH sea menor de 7,00 y no se disponga de ventilación mecánica.
- Su empleo en enfermos con edema agudo pulmonar es muy riesgoso, ya que aumentan substancialmente el grado de congestión pulmonar y de insuficiencia respiratoria.
- En la acidosis respiratoria crónica la compensación renal es tan eficiente que nunca es necesario tratar el pH; la terapia debe estar dirigida a mejorar la ventilación alveolar, disminuir la pCO2 y elevar la PO2.
- Recordar que si la pCO2 es corregida muy bruscamente, el paciente puede desarrollar alcalosis extracelular y del SNC.
7. ALCALOSIS RESPIRATORIA (ALR)
La alcalosis respiratoria es un trastorno clínico provocado por disminución de la concentración de iones H+ y caracterizado por pH arterial elevado, PC02 baja y reducción variable en el HCO3 plasmático como consecuencia de múltiples factores etiológicos.
7.1 Etiología.
- Si la ventilación alveolar se incrementa mas allá de los límites requeridos para expeler la carga diaria de CO2, descenderá la PCO2 y aumentará el pH sistémico. Al disminuir la PCO2 disminuyen el H2CO3 y el HCO3-, lo que constituye la respuesta compensadora. Esta compensación metabólica está mediada por la excreción renal de HCO3-, mecanismo que no inicia su funcionamiento hasta 6 h después de iniciado el trastorno.
- Los principales estímulos a la ventilación, ya sean metabólicos o respiratorios son: la hipoxemia y la acidosis. Son una excepción a este comportamiento aquellos padecimientos donde la hipoxemia es el resultado de hipo ventilación alveolar y está asociada con hipercapnia (enfermedad intersticial pulmonar y habitar a grandes altitudes).
7.1.1 Algunos de los factores responsables de estas fallas respiratoria serían :
- Polipnea sin lesión orgánica: histeria, transparto, hiperventilación artificial (manual o mecánica), hiperventilación por ejercicio, aire enrarecido de 02.
- Polipnea originada por lesión orgánica o de otro tipo : traumatismos craneoencefálicos, edema cerebral, encefalitis, aumento del volumen espiratorio (AVE) de tipo transitorio, trombo embolismo graso, peritonitis, fases iniciales de la insuficiencia pulmonar progresiva (IPP) .
7.2 Cuadro clínico
- Manifestaciones de disfunción cerebral (dificultad para hablar, parestesias motoras quo pueden ser permanente por disminución de Ia circulación cerebral).
- Tetania, convulsiones (en especial si hay antecedentes epilépticos), hormigueo de los dedos, espasmo carpo-podálico.
- Arritmias cardiacas, taquipnea, etcétera.
7.2.1 Cuadro hemogasométrico
- pH: arterial y capilar mayor de 7,45 ; venoso mayor de 7,35.
- PCO2 arterial y capilár menor de 35 mm de Hg, ; venoso menor de 45 mmHg
- BS: arterial, capilar y venoso normal o disminuido, según la compensación metabólica existente. En caso de alcalosis mixta estaría elevado.
- EB: arterial, capilar y venoso normal o disminuido, según la compensación metabólica existente. En case de alcalosis mixta estaría elevado.
- P02 normal o bajo, si el aire del ambiente es pobre en 02, o si la causa inicial de hiperventilación es hipoxemia inicial.
- HBO2: normal o en relación con alteraciones de la PO2.
7.2.1.1 El análisis del estado del factor compensador (HCO3-) se realiza mediante la fórmula:

para los trastornos agudos, y
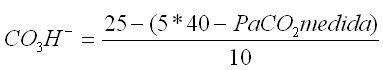
para los trastornos estables.
- Los límites máximos de compensación son de 18 mEq/L (mmol/L) de HCO3- para los trastornos agudos y de 12 a 15 mEq/L (mmol/L) para los estables.
- Debe sospecharse una acidosis metabólica sobreañadida si se obtienen valores de HCO3- menores que los límites máximos de compensación o una alcalosis metabólica sobreañadida o un trastorno de corto tiempo de evolución.
7.2.2 Cuadro electrolítico
- Na : bajo.
- Cl : elevado.
- K : disminuido.
7.2.3 Otras investigaciones según el tipo de lesión orgánica que se sospeche
- Punción lumbar (PL), radiografía del tórax, etcétera.
- El cálculo de la P(A-a)O2 por el mismo método que se expuso en el tema precedente, permite la clasificación que se muestra en el Cuadro 7.
Cuadro 7. Alcalosis respiratoria. Clasificación según la diferencia alvéolo-arterial de oxígeno
| P (A-a)O2 normal | P(A-a)O2 aumentada |
| 1. Trastornos del SNC. | 1. Sepsis por gramnegativos. |
| 2. Hormonas y medicamentos: | 2. Endotoxemia. |
| Salicilatos. | 3. Insuficiencia hepática |
| Catecolaminas. | 4. Enfermedad pulmonar intersticial. |
| Sobredosis de analépticos o tiroides. | 5. Edema pulmonar. |
| Progesterona | 6. Trombo embolismo pulmonar. |
| Gestación | 7. Asma. |
| 3. Altitud | 8. Neumonía |
| 4. Anemia grave |
|
| 5. Endotoxemia |
|
| 6. Psicógena |
|
| 7. Exposición al calor |
|
| 8. Ventilación mecánica |
|
7.3 Tratamiento
- Por lo general el grado de alcalemia producido por esta afección no es peligroso, pero cuando el pH está por encima de 7,60, la PaCO2 por debajo de 20 mmHg, o existen arritmias o manifestaciones graves de hipocapnia del sistema nervioso, se debe comenzar el tratamiento específico.
- Procurar que el paciente retenga C02.
- Respirar en una bolsa de papel o nylon (se coloca al paciente un cartucho de nylon que cubra su cabeza lo más herméticamente posible y se le suministra oxígeno, previa abertura de pequeños agujeros que impidan la sobre distensión excesiva del cartucho, esto provoca un aumento del espacio muerto, disminuye la ventilación alveolar y aumenta la PaCO2). Existen dispositivos tales como la "cámara cefálica" y las máscaras de re-respiración, que sustituyen el cartucho mencionado.
- La administración de CO2 no está indicada, pues perpetúa la hiperventilación, al igual que puede ocurrir con los dispositivos anteriormente señalados.
- Utilización de ansiolíticos, apoyo emocional y cuando la alcalosis respiratoria sea marcada, puede valorarse la utilización de pequeñas cantidades de morfina.
- Administrar 02, si la hiperventilación es por hipoxia.
- Cuando exista compromiso de la irrigación cerebral se aconseja: relajación y sedación para aplicar soporte ventilatorio, controlado a bajas frecuencias.
- Cuando existan manifestaciones clínicas graves o el cuadro se acompañe de hipoxemia severa, se debe ventilar el paciente con modalidad controlada, volumen corriente (tidal) de 3 a 6 ml/Kg. de peso y frecuencia respiratoria de 10 a 12/min.
- Se utilizará la FiO2 (fracción inspiratoria de oxígeno) necesaria para corregir la hipoxemia y se controlarán los resultados por medio de Hemogasometrias.
- Si por alguna razón no son convenientes los bajos volúmenes corrientes (volet costal) o no se soluciona el disturbio en 3 h con las medidas mencionadas, se puede aumentar el espacio muerto mecánico colocando una manguera de 8 a 10 cm. de largo y de 1 o 2 cm. de diámetro entre el tubo endotraqueal y la "Y" del ventilador.
- Corregir la hipoxemia.
- Tratamiento de la causa de base.
- Se realizan controles hemogasométricos seriados cada 30 min. y de no obtener resultados satisfactorios en 2 o 3 h, se debe intubar y ventilar al enfermo.
8 TRASTORNOS ACIDOBÁSICOS MIXTOS (Cuadro 8)
Se deben a la coexistencia simultánea de dos o más alteraciones ácido básicas simples y se les considera erróneamente muchas veces como respuestas compensatorias.
8.1 Etiología :
8.1.1 Acidosis respiratoria + acidosis metabólica.
a. Paro cardiorrespiratorio. b. Edema pulmonar grave. c. EPOC e hipoxemia. d. Intoxicaciones exógenas graves. e. Acidosis metabólica con hipocaliemia grave (<2 mEq/L).
8.1.2 Acidosis respiratoria + alcalosis metabólica.
a. Neumopatías obstructivas crónicas en pacientes con aspiración gástrica, vómitos o tratamiento con diuréticos.
8.1.3 Alcalosis respiratoria + alcalosis metabólica.
a. Insuficiencia hepática con aspiración gástrica/vómitos o terapéutica con diuréticos. b. Pacientes ventilados, con aspiración gástrica, tratamiento diurético o ambos. c. EPOC hiperventilado.
8.1.4 Alcalosis respiratoria + acidosis metabólica.
a. Shock séptico. b. Trombo embolismo pulmonar en bajo gasto. c. Insuficiencia renal con sepsis grave. d.Intoxicación por salicilatos. e. Cirrosis hepática.
8.1.5 Acidosis metabólica + alcalosis metabólica.
a. Insuficiencia renal crónica y vómitos. b. Vómitos y diarreas incoercibles. c. Hipovolemia con vómitos o utilización de diuréticos.
8.1.6 Acidosis metabólica mixta
a. Acidosis metabólica hiperclorémica + acidosis metabólica con brecha aniónica aumentada.
- Diarrea o acidosis renal tubular + acidosis láctica.
- Cetoacidosis diabética en resolución.
- Diarrea + acidosis con brecha aniónica aumentada.
b. Acidosis metabólica hiperclorémica mixta.
- Hiperalimentación y diarrea.
- Bloqueador de anhidrasa carbónica + enfermedad renal o digestiva.
c. Acidosis metabólica con brecha aniónica aumentada mixta.
- Cetoacidosis + acidosis láctica.
- Intoxicación por metanol o salicilatos + acidosis láctica.
- Uremia + acidosis con brecha aniónica aumentada.
Cuadro 8. Patrones aniónicos en trastornos ácido-básicos mixtos

8.2 Diagnóstico
- Análisis clínico detallado del paciente.
- Aplicación de las fórmulas de límites de compensación señaladas en cada uno de los trastornos simples: cálculo de los límites de compensación según el trastorno ácido básico que se considere presente.
- Ionograma con los datos del Cl- , Bicarbonato (reserva alcalina), Na+, K+ y cálculo de la brecha aniónica.
- Hemogasometría arterial. .
- Cálculo de los delta (D) de Cl-, brecha aniónica y bicarbonato.
8.2.1 Los elementos que permiten sospechar y diagnosticar el trastorno mixto son:
- La existencia de causas primarias para más de un trastorno simple.
- Que los límites de compensación sobrepasen o no alcancen los mostrados en el Cuadro 9.
Cuadro 9. Límites de compensación de los trastornos ácido-básicos simples
| Trastorno primario | Elemento compensador | Valor límite del elemento compensador |
| Alcalosis metabólica | PaCO2 | 55 - 60 mmHg |
| Acidosis metabólica | PaCO2 | 25 mmHg |
| Acidosis respiratoria |
|
|
|
| HCO3- 30 mmol/L |
| Alcalosis respiratoria |
|
|
| HCO3- | 18 mmol/L |
- Que el valor del aumento de la brecha aniónica sea mayor que la disminución del HCO3- (cada mEq/L de ácido añadido debe disminuir en la misma cantidad el HCO3-.)
Equivale a: D BA > D HCO3-.
(Brecha aniónica - 12) > (26 - HCO3- medido)
8.3 Tratamiento.
- Normalizar el pH, de ahí que los trastornos mixtos, acidosis respiratoria y metabólica o alcalosis respiratoria y metabólica, sean los más graves, pues desvían el pH de forma importante hacia la acidez o la alcalinidad.
- evitar que el tratamiento de un disturbio agrave al otro.
- Tratar ambos simultáneamente siendo más enérgico con el que provoque manifestaciones clínicas más graves o predomine, según valor del pH.
- Se utilizan los mismos principios terapéuticos de los trastornos simples, con un seguimiento gasométrico más frecuente para valorar las modificaciones que la corrección de un disturbio le ocasiona al otro.
Se han descrito asociaciones triples, raras y de difícil diagnóstico. Usualmente se realiza el diagnóstico de un trastorno metabólico (acidosis/alcalosis) y al calcular la PaCO2 se aprecia uno respiratorio sobreañadido. Si a esto se adiciona que el delta del Cl- o de la brecha aniónica resulta distinto al del bicarbonato, entonces se diagnostica un trastorno triple. Para facilitar su interpretación se ha recurrido al diseño de programas de computación.
***
1Profesor Titular de Cirugía, Profesor Consultante, Facultad de Ciencias Médicas «Salvador Allende». Especialista de II Grado en Cirugía General. Miembro del Grupo Nacional de Cirugía.















