Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión impresa ISSN 0034-7493versión On-line ISSN 1561-2945
Rev Cubana Cir v.45 n.2 Ciudad de la Habana abr.-jun. 2006
Anestesia para colecistectomía laparoscópica. Nuestra experiencia
Dr. Raúl García Rojas,1 Dra. Marilét Muradás Augier,2 Dra. Marta S. López Rodríguez3 y Dra. Yanet Pérez Delgado4
RESUMENLa cirugía de mínimo acceso se acompaña de variados cambios fisiopatológicos, por lo que requiere una adecuada monitorización y una atención anestésicas con características especiales. Realizamos un estudio prospectivo analítico con el objetivo de determinar el comportamiento transoperatorio, hemodinámico y respiratorio en este tipo de cirugía, determinar la correlación existente entre la presión arterial de dióxido de carbono (PaCO2) y el dióxido de carbono teleespiratorio (ETCO2) en los pacientes con y sin patologías cardiorrespiratorias previas, así como la morbilidad y la mortalidad asociadas al procedimiento. Observamos un aumento significativo de la presión pico en la vía aérea (f = 32,53; p = 0,0) y de la PaCO2 a los 5 min y a los 30 min después del neumoperitoneo. Existió una fuerte correlación lineal entre la PaCO2 y el ETCO2 en los pacientes sanos, pero no así en los enfermos. La tensión arterial diastólica experimentó un aumento significativo del 12 % y la frecuencia cardíaca una disminución de 7,1 %. Las náuseas y vómitos posoperatorios fueron las complicaciones más frecuentes (10 %). La colecistectomía laparoscópica, en nuestra experiencia, se acompañó de excelente estabilidad cardiorrespiratoria y una reducida morbilidad.
Palabras clave: Colecistectomía laparoscópica, variaciones hemodinámicas y respiratorias, morbilidad y mortalidad.
La cirugía de mínimo acceso (CMA) se ha difundido en los últimos años tras el advenimiento de las técnicas laparoscópicas, que no solo se limitan en la actualidad a procedimientos ginecológicos sino que se han extendido al campo de la cirugía general, ortopédica y urológica.1
La primera colecistectomía laparoscópica (CL) realizada en seres en humanos fue documentada por el francés Phillipe Mouret en 1987, aunque se reporta que en 1985 el alemán Erick Muhe realizó ésta técnica, cuyos resultados publicó en la Presse Medicale, años más tarde (1989). Este hecho conmovió a la comunidad científica internacional y constituyó el punto de partida para la explosión ulterior de la CMA que es una realidad hoy.1
En Cuba se introduce la CMA en 1990, cuando se realiza por primera vez en el hospital «Hermanos Ameijeiras» y luego se difunde progresivamente por todo el país. En 1996 se comienza a aplicar en nuestra institución.
Este tipo de cirugía ofrece numerosas ventajas. Por el hecho de ser menos invasiva, garantiza que el dolor y la disfunción pulmonar postoperatorios sean mínimos (al reducir el empleo de analgésicos en éste período), lo cual permite al paciente deambular tempranamente y con ello, una rápida recuperación y una estadía hospitalaria corta. Sin embargo se acompaña de variados cambios fisiopatológicos en el período transoperatorio, los cuales requieren una monitorización adecuada y un tratamiento anestésico con características especiales.2,3
Las alteraciones fisiopatológicas son fundamentalmente cardiorrespiratorias y son secundarias a los cambios de la posición en que se coloca al paciente, al aumento de la presión intraabdominal (PIA) y a la absorción hacia el torrente circulatorio del CO2 insuflado intraperitonealmente.4
Con relación a los cambios de posición podemos decir que la posición de Trendelenburg empleada inicialmente causa modificaciones cardiovasculares como el aumento del retorno venoso (RV), de la presión venosa central (PVC), de la presión arterial pulmonar (PAP) y del gasto cardíaco (GC). Sin embargo, no se observa inestabilidad hemodinámica en el paciente pues secundariamente por efecto barorreflejo se produce una vasodilatación sistémica y bradicardia. A estos cambios se suman los del aparato respiratorio, consistentes en la disminución de la capacidad residual funcional (CRF), del volumen pulmonar total y de la distensibilidad pulmonar.4,5
Después de instaurado el neumoperitoneo (NP) se adopta la posición de Murphy con lateralización hacia la izquierda y se observan nuevos cambios, contrarios a los que se presentan con la anterior posición. Por consiguiente, estas posiciones deberán adoptarse con extrema gentileza, sobre todo en pacientes susceptibles como es el caso de los que presentan patologías cardiorrespiratorias, los pacientes geriátricos, obesos y los niños menores de 5 años.4,6
Por su parte el aumento de la PIA es responsable de la disminución del RV y del GC, del aumento de la resistencia vascular sistémica (RVS) y renal (RVR), de la tensión arterial sistólica (TAS) y la presión arteria pulmonar (PAP) (debido a la compresión de los troncos arteriales del abdomen provocada por la hiperpresión abdominal), además de producir un aumento del espacio muerto fisiológico a nivel respiratorio, como consecuencia del desplazamiento cefálico de los hemidiafragmas. Esto a su vez ocasiona la disminución de la distensibilidad pulmonar, de los volúmenes pulmonares y de la CRF, así como el aumento de las presiones en las vías aéreas. Estas alteraciones tendrán mayor relevancia mientras mayor sea el aumento de la PIA, por lo que no es conveniente que supere los 14 mmHg y que la velocidad con que se realice la insuflación del gas intraabdominal esté entre 1 L/min y 3 L/min.4,7,8
El CO2 utilizado para establecer el NP tiene como principales desventajas el causar irritación peritoneal e hipercapnea. Esta última puede producirse porque el gas se difunde y se absorbe fácilmente a través de la superficie peritoneal.4,9,10,11
Teniendo en cuenta las ventajas que ofrece este tipo de cirugía y el reto que constituye para el anestesiólogo enfrentarse a las variadas alteraciones fisiopatológicas que puede presentar el paciente durante esta, nos sentimos motivados para realizar el presente trabajo.
Fueron nuestros objetivos describir el comportamiento transoperatorio de las variables hemodinámicas (frecuencia cardíaca [FC], TAS, tensión arterial diastólica [TAD] y saturación de oxígeno de la hemoglobina- SaO2) y de las respiratorias (presión pico en la vía aérea [P1], dióxido carbono teleespiratorio [ETCO2], presión arterial de dióxido de carbono [PaCO2]) monitorizadas, determinar la correlación existente entre la PaCO2 y el ETCO2 en los pacientes con patologías cardiorrespiratorias y sin ellas, así como señalar la morbilidad y la mortalidad asociadas.
MÉTODOS
Realizamos un estudio prospectivo analítico en el Hospital «Joaquín Albarrán», durante el período comprendido entre septiembre de 1997 y enero de 2000, para lo cual seleccionamos una muestra simple, aleatoria, de 80 pacientes tratados mediante colecistectomía laparoscópica. El universo de pacientes superó el 25 % de las cifras históricas anuales en la institución.
Los pacientes fueron elegidos de acuerdo a los criterios de inclusión siguientes:
- Estado físico I y II, según criterios de el ASA (American Society of Anesthesiologists).
- Rango de edad entre 15 y 70 años y se consideraron geriátricos a los pacientes mayores de 60 años.
- Inexistencia de contraindicaciones para este tipo de cirugía.4
La mañana de la intervención quirúrgica, en la sala de preoperatorio, se llevó a cabo la verificación de los signos vitales de los pacientes, a quienes se les canalizó una vena periférica para hidratación con dextrosa 5 % a razón de 2 mL (kg · h) de ayuno, además se les administró como premedicación anestésica inmediata midazolán en 0,05 mg/kg y atropina en 0,01 mg/kg. Después de la premedicación se evaluaron nuevamente los parámetros hemodinámicas y se consideraron los valores obtenidos como las cifras basales.
Una vez en el quirófano y tras la monitorización, se comenzó la inducción de la anestesia con fentanilo (5 µg/kg), tiopental sódico (2,5 % - 5 mg/kg), bromuro de pancuronio al 10 % de la dosis calculada en 0,1 mg/kg y succinilcolina en 1,5 mg/kg. El mantenimiento de la anestesia se obtuvo con una mezcla de oxígeno-N2O (FiO2-0,4), fentanilo en infusión (0,05-0,1 µg(kg ·m) y bromuro de pancuronio al 25 % de la dosis inicial cada 45 min. La hidratación transoperatoria se realizó con cloruro de sodio al 0,9 % - 5 mL (kg · h).
Durante el transoperatorio se continuó la monitorización de las variables estudiadas en función del tiempo, para lo cual se determinó la secuencia siguiente:
- T1: Los primeros 5 min después de la intubación y se tomaron estos valores como cifras basales, con excepción de la TAS, TAD y FC cuyos valores basales fueron considerados en el preoperatorio.
- T2: Inmediatamente después de concluida la instauración del NP y con el paciente en posición de Trendelemburg.
- T3: A los 10 min de establecido el NP, posición de Murphy.
- T4: A los 30 min de establecido el NP, posición de Murphy.
- T5: A los 5 min de terminado el NP, posición horizontal.
Las gasometrías arteriales fueron realizadas en los tiempos 1, 4 y 5. Se describieron las complicaciones anestésicas.
Los resultados obtenidos fueron analizados estadísticamente en el sistema operativo Windows, con los paquetes de programas de Statistic. Con estos se determinaron técnicas descriptivas que incluyeron medidas tales como: proporciones, media, desviación estándar, mínimo, máximo y tendencia lineal para todas las variables estudiadas. También se realizó análisis de regresión y correlación.
Estos resultados fueron representados en tablas y gráficos elaborados en Excel y para la confección del texto se utilizó el procesador Word.
RESULTADOS
Las características demográficas del grupo estudiado, así como la presencia de enfermedades asociadas quedan reflejadas en las tablas 1 y 2, respectivamente.
Tabla 1. Datos generales y demográficos
| Variables | Resultados |
| Edad | 49,93 ± 15,0 |
| Peso (kg) | 64,91 ± 10,15 |
| Sexo | Femenino: 71 |
| Estado físico según criterios de la ASA | I: 42 pacientes |
Tabla 2. Enfermedades y factores de riesgo
| Antecedentes patológicos personales | N.o | % |
| Hipertensión arterial (HTA) | 16 | 20 |
| HTA y cardiopatía isquémica | 3 | 3,75 |
| HTA y asma bronquial | 4 | 5 |
| HTA y obesidad | 1 | 1,25 |
| HTA y diabetes mellitus | 1 | 1,25 |
| Asma bronquial | 6 | 7,50 |
| Obesidad | 7 | 8,75 |
| Total | 38 | 47,5 |
| Factores de Riesgo | ||
| Hábito de Fumar | 20 | 25 |
Fuente: Protocolo de recolección de datos.
El comportamiento de las variables hemodinámicas y respiratorias fue analizado estadísticamente mediante el análisis de varianza, para lo cual fueron propuestas dos hipótesis: H0, las medias son iguales y H1, al menos una de las medias es diferente.
Aceptamos H0 en el análisis del ETCO2 y no se encontraron variaciones de esta variable en ninguno de los tiempos registrados (f = 0,75; p = 0,55). Por su parte la P1 se comportó de manera diferente al rechazarse la hipótesis H0 (f = 32,53; p = 0,0). Su mayor aumento, 4,81 cmH2O por encima de las cifras basales, se observó en el segundo tiempo. La tabla 3 muestra dichos resultados.
Tabla 3. Comportamiento de los parámetros respiratorios
| Secuencia | P1 (cmH2O) | ETCO2 (Kpa) | |
| T1 | Media | 15,67 | 34,13 |
| DE | 4,85 | 0,57 | |
| T2 | Media | 20,48 | 35,35 |
| DE | 4,48 | 0,51 | |
| T3 | Media | 21,86 | 35,20 |
| DE | 4,11 | 0,56 | |
| T4 | Media | 21,95 | 35,04 |
| DE | 4,23 | 0,59 | |
| T5 | Media | 18,25 | 34,66 |
| DE | 3,08 | 0,65 | |
DE: Desviación estándar; T1: 5 min después de la inducción; T2: inmediatamente después del NP, posición de Trendelenburg; T3 y T4:10 y 30 min después del NP, posición de Murphy; T5: 5 min después de liberado el NP.
Fuente: Protocolo de recolección de datos.
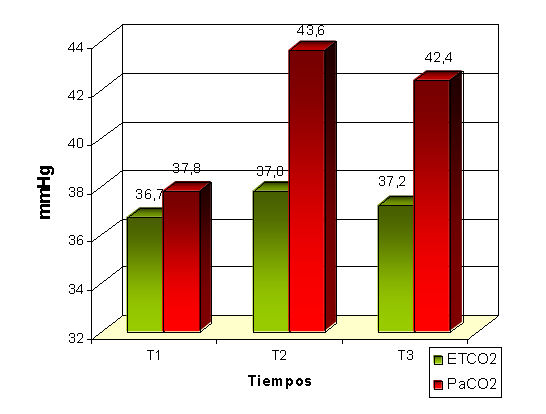
La PaCO2 no presentó variaciones significativas en los pacientes sin patologías cardiorrespiratorias, sin embargo en los pacientes que sí las presentaban esta variable alcanzó un valor considerablemente mayor: 30 min después del NP (43,63 mmHg) en relación con las cifras basales (38,16 mmHg) y se mantuvo elevada incluso después de la desinsuflación del abdomen (f = 25,34; p = 0,01).
El grado de correlación entre la PaCO2 y el ETCO2 fue analizado estadísticamente mediante el método de regresión. En las figuras 1 y 2 observamos que existió una fuerte dependencia lineal entre estas variables en los pacientes sanos (T1: R2 = 0,91; T4: R2 = 0,86; T5: R2 = 0,92) a diferencia de los pacientes con patologías cardiorrespiratorias, donde esta relación fue mucho más débil después de instaurado el NP (T1: R2 = 0,98; T4: R2 = 0,57; T5: R2 = 0,64), pues a pesar de que siempre que aumentó la PaCO2 también lo hizo el ETCO2 y la diferencia superó los 5 mmHg.
Figura 1. ETCO2/PaCO2. Pacientes sanos.
Fuente: Protocolo de recolección de datos.
Figura 2. ETCO2/PaCO2. Pacientes enfermos.
Fuente: Protocolo de recolección de datos.
Los resultados con relación al comportamiento hemodinámico se representan en la tabla 4 donde, como podemos observar, no encontramos variaciones significativas en los valores de la TAS (f = 2,22; p = 0,06) y de la SaO2 (f = 0,43; p = 0,78), en ninguno de los tiempos evaluados. La TAD si mostró un incremento significativo en los momentos 3 y 4; al finalizar la cirugía y liberarse el NP, las cifras descendieron y superaron solo en 2,5 % la basal. De manera similar la FC experimentó una disminución significativa a partir de los 30 min del NP (f = 4,42; p = 0,0).
Tabla 4. Comportamiento de los parámetros hemodinámicos
| Secuencia | FC (L/min) | TAS (mmHg) | TAD (mmHg) | SaO2(%) | |
| PO | Media | 85,27 | 131,03 | 82,09 | --- |
| DE | 19,54 | 21,22 | 11,45 | --- | |
| T1 | Media | 82,68 | 132,00 | 82,75 | 99,51 |
| DE | 13,87 | 21,13 | 11,38 | 0,95 | |
| T2 | Media | 83,45 | 132,87 | 85,87 | 99,65 |
| DE | 13,87 | 25,73 | 14,49 | 0,71 | |
| T3 | Media | 83,28 | 140,25 | 92,62 | 99,57 |
| DE | 11,92 | 19,77 | 10,52 | 0,72 | |
| T4 | Media | 78,76 | 135,87 | 89,62 | 99,53 |
| DE | 12,25 | 18,25 | 11,68 | 0,71 | |
| T5 | Media | 76,82 | 134,25 | 84,87 | 99,61 |
| DE | 12,13 | 16,73 | 10,18 | 0,62 | |
PO: Preoperatorio; T1: 5 min después de la inducción; T2: Inmediatamente después del NP, posición de Trendelenburg; T3 y T4: 10 y 30 min después del NP, posición de Murphy; T5: 5 min después de liberado el NP.
Fuente: Protocolo de recolección de datos.
Por último, en la tabla 5 podemos conocer la incidencia de complicaciones en la muestra estudiada. La hipertensión arterial fue la más frecuente durante el transoperatorio y se observó en el 6,25 % de los casos, mientras que las náuseas y los vómitos fueron las únicas encontradas en el 10 % de los casos, en el período postoperatorio.
Tabla 5. Incidencia de complicaciones
|
| N.o | % |
| Complicaciones transoperatorias | ||
| Hipertensión arterial | 5 | 6,25 |
| Broncoespasmo | 3 | 3,75 |
| Extrasístoles ventriculares | 2 | 2,50 |
| Total | 10 | 12,5 |
| Complicaciones postoperatorias | ||
| Náuseas y vómitos | 8 | 10 |
| Total | 8 | 10 |
Fuente: Protocolo de recolección de datos.
DISCUSIÓN
El comportamiento observado del ETCO2 se fundamenta en varios aspectos. Inicialmente puede disminuir como consecuencia de la hiperventilación que producen los parámetros respiratorios prefijados. Posteriormente, al instaurarse el NP y el CO2 absorberse a través de la superficie peritoneal, se incrementa y finalmente disminuye debido a la compresión vascular de la superficie peritoneal y se obtiene una meseta a los 20 min de establecido el NP.4 Estas variaciones en nuestros pacientes se mantuvieron dentro de límites fisiológicos, de manera similar a lo reportado por Girardis y cols.12
La literatura médica muestra diversos factores que favorecen el aumento apreciado de la PaCO2 después del NP. Estos incluyen la absorción del CO2 a través de la superficie peritoneal, el empeoramiento de la ventilación por factores mecánicos, la hipoperfusión tisular debido al aumento de la PIA, el desplazamiento del gas forzado por el NP hacia los vasos dañados durante la cirugía, así como las alteraciones de la ventilación-perfusión debidas a la PIA.13 En concordancia con nuestros hallazgos existen variadas investigaciones.4,12
Como demostramos a través de nuestros resultados, es de gran importancia la monitorización de ambos parámetros en los pacientes en estado cardiorrespiratorio desfavorable, pues mientras que en un sujeto normal la diferencia entre ellos no debe exceder los 2 mmHg, en los pacientes afectados esta diferencia suele superar los 6 mmHg y se hace difícil sospechar una hipercapnea arterial-acidosis mediante la observación del ETCO2.4 Diversos autores comunican resultados similares tras considerar que en estos pacientes los cambios fisiopatológicos cardiorrespiratorios producidos por el aumento de la PIA se suman a los ya existentes en ellos.4
Otra de las alteraciones observadas en los pacientes es el aumento de las presiones en las vías aéreas. En condiciones normales es necesaria una presión de 15 cmH2O para desplazar el diafragma durante la ventilación mecánica. Al instaurarse el NP la presión de insuflación pulmonar se debe aumentar para mantener una correcta ventilación. Si además el paciente es colocado en posición de Trendelemburg, la presión necesaria para vencer el peso del paquete visceral será aún mayor.14 De éste modo, algunos autores consideran que el NP provoca un incremento de 6 cmH2O y 3 cmH2O, de la P1 y la P2, respectivamente.15 Las modificaciones de éste parámetro observadas por Berg son similares a las encontradas en nuestra muestra.16
Los cambios hemodinámicos que se producen durante la colicistectomía laparoscópica también han sido objeto de investigación para muchos autores.4,17,18 Nuestros resultados concuerdan enteramente con las variaciones esperadas para dichas variables y que fueron descritas por Miller y cols.4
Coincidimos en el hecho de que los mayores cambios se produjeron en etapas iniciales del NP, período en el cual las variaciones hemodinámicos suelen ser más intensas.19 También concordamos con McLaughlin y cols., quienes notaron mayor elevación de la TAD con relación a la TAS.20 De igual forma existen estudios donde se comentan ligeros cambios de la FC, resultados que no difieren de los nuestros.12
Aunque variadas son las causas de hipoxemia transoperatoria durante la colicistectomía laparoscópica, recientes estudios a similitud nuestra señalan gran estabilidad en este parámetro.18,20 A diferencia nuestra, Turkistani sí observó depresión miocárdica significativa en algunos de sus pacientes, después del NP.21
Numerosos datos acerca de las complicaciones asociadas a la colicistectomía laparoscópica han sido acumulados en los últimos años.21-23 En nuestro trabajo las más frecuentes observadas fueron las náuseas y los vómitos postoperatorios, coincidiendo con la literatura. Afortunadamente, en la actualidad diversos autores señalan la utilidad de una amplia gama de medicamentos antiheméticos, que se han utilizado, con resultados satisfactorios, en la prevención y tratamiento de estas complicaciones.24-27
Por su parte, Danzing y cols. señalan como hallazgo más importante el hecho de no encontrar ninguna complicación en sus pacientes, portadores de cardiopatías orgánicas severas.23
Conclusiones
Nuestra investigación arrojó una adecuada estabilidad hemodinámica y respiratoria de la muestra estudiada. Demostramos la existencia de una fuerte correlación lineal entre la PaCO2 y el ETCO2 en los pacientes sanos, mientras que en los enfermos esta relación fue débil después de instaurado el NP y no se pudo predecir el comportamiento de la PaCO2 mediante la observación del ETCO2. De ahí la importancia de monitorizar ambos parámetros en estos pacientes. De igual forma señalamos una baja incidencia de complicaciones anestésicas que no impidieron la realización exitosa de la intervención.
Consideramos que la colicistectomía laparoscópica es un proceder muy ventajoso, siempre que se emplee una monitorización correcta y se tomen medidas específicas para evitar las alteraciones fisiopatológicas que suelen acompañarla.
REFERENCIAS BIBLIOGRÁFICAS
1. Argudín CM. Anestesia en cirugía laparoscópica. En: González SM. Manual de Cirugía por acceso mínimo en el niño. La Habana: Mir; 1996. pp. 73-79.
2. Villegas GM. Técnicas Anestésicas en Cirugía Laparoscópica Ambulatoria. Rev Mex Anestesiol. 1995; 18(2): 12-16.
3. Nesek-Adam V, Mrsic V, Smiljanic A.. Specific anesthetic management in laparoscopic surgery. Lijec Vjesn. 2004; 126 (1-2): 22-5.
4. Joris JL. Anesthetic management of laparoscopy. En: Miller RD. Anesthesia. 4a ed. New York: Churchill Livingstone Inc.; 1994. pp. 2011-30.
5. Jones RM, Fletcher DR, Mac Lellan DG. Laparoscopic cholecystectomy: initial experience. Aust NZJ Surg. 1991; 61: 261-6.
6. Hein HA, Joshi GP, Ramsay MA, Fox LG, Gawey BJ, Hellman CL, et al. Hemodynamic changes during laparoscopic cholecystectomy in patients with severe cardiac disease. J Clin Anesth. 1997; 9(4): 261-5.
7. Gandara MV, de Vega DS, Escriu N, Olmedilla C, Pérez-Mencia MT, Zueras R, et al. Respiratory changes during laparoscopic cholecystectomy. A comparative study of three techniques. Rev Esp Anestesiol Reanim. 1997; 44(5): 177-81.
8. Basgul E, Bahadir B, Celiker V, Karagoz AH, Hamaloglu E, Aypar U. Effects of low and high intra-abdominal pressure on immune response in laparoscopic cholecystectomy. Saudi Med J. 2004; 25(12): 1888-91.
9. Andersson LE, Jogestrand T, Thorne A, Sollevi A, Odeberg-Wernerman S. Acta Anaesthesiol Scand. 2005; 49(3): 360-5.
10. Meierhenrich R, Gauss A, Vandenesch P, Georgieff M, Poch B, Schutz W. The Effects of Intraabdominally Insufflated Carbon Dioxide on Hepatic Blood. Anesth Analg. 2005; 100(2): 340-7.
11. Andersson LE, Baath M, Thorne A, Aspelin P, Odeberg-Wernerman S. Effect of Carbon Dioxide Pneumoperitoneum on Development of Atelectasis during Anesthesia. Anesthesiology. 2005; 102(2): 293-9.
12. Girardis M, Broi UD, Antonutto G, Passetto A. The effect of laparoscopic cholecystectomy on cardiovascular function and pulmonary gas exchange. Anesth Analg. 1996; 83(1): 134-40.
13. Gandara V, de Vega DS, Escriu N, Zorrilla IG. Acid-base balance alterations in laparoscopic cholecystectomy. Surg Endosc. 1997; 11(7): 707-10.
14. Mc Mahon AJ, Baxter JN, Kenny G, O’Dwyer PJ. Ventilatory and blood gas changes during laparoscopic and open cholecystectomy. Br J Surg. 1993; 80(10): 1252-4.
15. Bardoczky GI, Engelman E, Levarlet M, Simon P. Ventilatory effects of pneumoperitoneum monitored with continuous spirometry. Anaesthesia. 1993; 48(4):309-11.
16. Berg K, Wilhelm W, Grundmann U, Ladenburger A, Feifel G, Mertzlufft F. Laparoscopic cholecystectomy-effect of position changes and CO2 pneumoperitoneum on hemodynamic, respiratory and endocrinologic parameters. Zentralbl Chir. 1997; 122(5): 395-404.
17. Mahajarkan SK. Propranolol is effective in decreasing stress response due to airway manipulation and CO2 pneumoperitoneum in patients undergoing laparoscopic cholecystectomy. Kathmandu Univ Med J (KUMJ). 2005; 3(10): 102-6.
18. Graziola E, Elena G, Gobbo M, Mendez F, Colucci D, Puig N. Stress, hemodynamic and immunological responses to inhaled and intravenous anesthetic techniques for video-assisted laparoscopic cholecystectomy. Rev Esp Anestesiol Reanim. 2005; 52(4): 208-16.
19. Critchley LA, Critchley JA, Gin T. Haemodynamic changes in patients undergoing laparoscopic cholecystectomy: measurement by transthoracic electrical bioimpedance. Br J Anaesth 1993; 70(6): 681-3.
20. Mc Laughlin JG, Scheeres DE, Dean RJ, Bonnell BW. The adverse hemodynamic effects of laparoscopic cholecystectomy. Surg Endosc 1995; 9(2): 121-4.
21. Turkistani AA. Cardiodynamic monitoring during laparoscopic cholecystectomy. Middle East Anesthesiol. 2005; 18(2): 435-9.
22. Imai H, Nakatami N, Matsuda S, Murakawa K, Tashiro C. Sudden difficulty in ventilation due to massive subcutaneous emphysema during laparoscopic cholecystectomy. Masui. 2005; 54(6): 658-61.
23. Danzig V, Krska Z, Demes R, Danzigova Z, Linhart A, Kittnar O. Hemodynamic response to laparoscopic cholecystectomy: impacts of increased afterload and ischemic dysfunction of the left ventricle. Physiol Res. 2005; 54(4): 377-85.
24. Fujii Y. The utility of antiemetics in the prevention and treatment of postoperative nausea and vomiting in patients scheduled for laparoscopic cholecystectomy. Curr Pharm Des. 2005; 11(24): 3173-83.
25. Hausel J, Nygren J, Thorell A, Lagerkranser M, Ljungqvist O. Randomized trial of the effects of oral preoperative carbohydrates on postoperative nausea and vomiting after laparoscopic cholecystectomy. Br J Surg 2006; 93(1): 120.
26. Glaser C, Sitzwohl C, Wallner T, Lerche A, Marhofer P, Schindler I. Dixyrazine for the prevention of postoperative nausea and vomiting after laparoscopic cholecystectomy. Acta Anaesthesiol Scand. 2004; 48(10):1287-91.
27. Fujii Y, Tanaka H, Kawasaki T. Effects of granisetron in the treatment of nausea and vomiting alter laparoscopic cholecystectomy: a dose-ranging study. Clin Ther. 2004; 26(7): 1055-60.
Recibido: 18 de mayo de 2006. Aprobado: 19 de junio de 2006.
Dr. Raúl García Rojas. Avenida 26 y Boyeros, Nuevo Vedado.
Correo electrónico: mmuradas@infomed.sld.cu
1 Especialista de I Grado en Anestesiología y Reanimación. Aspirante a Investigador.
2 Especialista de I Grado en Anestesiología y Reanimación. Aspirante a Investigador.
3 Especialista de II Grado en Anestesiología y Reanimación. Profesora Auxiliar.
4 Especialista de II Grado en Anestesiología y Reanimación. Aspirante a investigador.