Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir vol.55 no.1 Ciudad de la Habana ene.-mar. 2016
ARTÍCULO ORIGINAL
Perfusión testicular en la hernioplastia de Lichtenstein
Testicular perfusion in Lichtenstein hernioplasty
Eduardo José Molina Fernández, Orlando de la Paz Mora, Yoel Tamayo Gandol, Álvaro Liván Bencomo García, Fernando Aladro
Hospital Universitario "Comandante Manuel Fajardo". La Habana, Cuba.
RESUMEN
Introducción: la hernioplastia de Lichtenstein es un proceder de buena aceptación con bajas tasas de recidiva. No existe consenso sobre el impacto que produce el contacto directo de la malla y la fibrosis que esta induce, sobre los elementos del cordón inguinal y su influencia en la perfusión testicular.
Objetivo: evaluar el efecto del contacto directo de la malla sobre la perfusión testicular en la hernioplastia de Lichtenstein.
Método: se realizó un estudio observacional, descriptivo, longitudinal y prospectivo en 43 pacientes intervenidos en el Hospital Universitario “Comandante Manuel Fajardo” de La Habana, de noviembre de 2010 a junio de 2015, a los que se les realizó hernioplastia de Lichtenstein. En cada paciente se estudió la perfusión testicular utilizando los índices de flujo sanguíneo de la arteria testicular.
Resultados: no se encontraron alteraciones de la perfusión testicular asociado al uso de la prótesis de polipropileno en la hernioplastia de Lichtenstein.
Conclusión: la colocación de la malla de polipropileno según la técnica de Lichtenstein no produce alteración de la perfusión testicular según nuestros resultados.
Palabras clave: hernioplastia; malla; testículo; cordón espermático; perfusión testicular.
ABSTRACT
Introduction: Lichtenstein hernyoplasty is a well-accepted procedure with low rates of recurrence. However, there is no consensus on the impact produced by direct mesh contact and the induced fibrosis, or on the elements of the inguinal cord and its influence on testicular perfusion.
Objective: to evaluate the effect of direct mesh contact on testicular perfusion in the Lichtenstein hernyoplasty.
Methods: an observational, descriptive, longitudinal and prospective study was carried out with 43 patients who underwent Lichtenstein hernyoplasty and were treated at Comandante Manuel Fajardo University Hospital of Havana, from November 2010 to June 2015. Testicular perfusion was studied in each patient using the blood flow rates of testicular artery.
Results: no testicular perfusion abnormalities were found to be associated with the use of polypropylene mesh in Lichtenstein hernioplasty.
Conclusion: according to our results, the use of a polypropylene mesh by Lichtenstein technique does not impair testicular perfusion.
Keywords: hernioplasty; mesh; testicle; spermatic cord; testicular perfusion.
INTRODUCCIÓN
Las hernias de la pared abdominal, entre ellas las hernias inguinales, constituyen hoy en todo el mundo uno de los principales motivos de consulta en los servicios de Cirugía General.1 Esta entidad apareció desde el origen mismo del hombre en su paso a la bipedestación, facilitada por la migración de los testículos durante la vida embrionaria, los que para alcanzar su situación definitiva en los escrotos, desorganizan las diferentes capas de la pared abdominal.
En la actualidad, la cirugía herniaria está fuertemente influida por la contante evolución tecnológica, especialmente por aquella relacionada con las cada vez más difundidas y diversas bioprótesis que logran tasas de recidivas casi nulas.2
Desde la aparición de la técnica de Lichtenstein para la reparación de las hernias inguinales, sus excelentes resultados en la reducción de las tasas de recidiva, poca complejidad técnica y escasas complicaciones han hecho de ella un proceder ampliamente utilizado en todo el mundo.3 Este proceder preconiza el uso de una lámina de polipropileno, colocada directamente sobre la pared posterior del conducto inguinal, la cual queda en contacto directo con los elementos del cordón espermático, llegando incluso a rodearlo completamente a nivel del anillo inguinal profundo. Estos elementos en la mayoría de los casos son despojados de sus fascias cobertoras durante la disección y tratamiento del saco herniario, quedando completamente expuestos al bioimplate y su posterior proceso de integración.
La fibrosis que induce la prótesis en su mecanismo de colonización constituye el freno del mecanismo herniario, sin embargo dicha fibroplastia se produce de forma anárquica a través del implante en dependencia del material del que este compuesto, su peso y porosidad entre otras características.4-6 Esta fibrogénesis no puede ser controlada a detalle por los cirujanos una vez colocada la malla, por lo que no existe consenso aun sobre el impacto que en los elementos del cordón espermático y la perfusión testicular pudiera producir.7
Algunos autores niegan que exista repercusión negativa sobre estos elementos,8-10 sin embargo, se han llegado a reportar alteraciones significativas tales como orquitis, isquemia, atrofia testicular y hasta trastornos consecuentes en la espermatogénesis.11-15 Teniendo en cuenta la divergencia de criterios existentes sobre el tema y la también extensa y aceptada utilización de esta técnica en nuestro país, realizamos un estudio que nos permitió conocer el comportamiento de la perfusión testicular en los pacientes a los cuales se les realiza una hernioplastia de Lichtenstein con malla de polipropileno.
MÉTODOS
Se realizó un estudio observacional descriptivo, longitudinal, prospectivo, desde febrero de 2011 hasta febrero de 2015, en pacientes operados de hernia inguinal unilateral por el grupo de hernia y pared abdominal del servicio de cirugía general del Hospital Universitario “Comandante Manuel Fajardo”, del municipio Plaza de la Revolución, La Habana, Cuba. Se seleccionó un universo de 43 pacientes.
Criterios de inclusión:
• Pacientes con hernia inguinal primaria unilateral.
• Pacientes que estuviesen de acuerdo, previo consentimiento informado, a formar parte de la investigación.
• Pacientes con flujometría testicular preoperatoria normal.
Criterios de exclusión:
•Trauma testicular en los últimos 6 meses.
• Lesión evidente del transoperatorio sobre elementos del cordón.
•Pacientes que abandonen el proyecto.
La bioprótesis que se utilizó en todos los casos fue la suministrada oficialmente a nuestro centro por el Minsap, compuesta al 100 % por polipropileno, con poros de más de 75 µm, monofilamentada y de bajo peso específico (85 g/m).
Los pacientes fueron captados de forma secuencial durante las consultas externas e intervenidos quirúrgicamente de forma electiva. Se les realizó ultrasonografía escrotal en la escala de grises y Doppler con flujometría en el preoperatorio y el posoperatorio, a los 2 meses, 6 meses y 1 año, respectivamente. Se estudiaron los siguientes parámetros:
— Volumen testicular (VT).
— Índice de Resistencia (IR).
— Velocidad del pico sistólico (VPS).
— Velocidad al final de la diástole (VFD).
El testículo homolateral fue medido en tres dimensiones para calcular su volumen. El volumen testicular (VT) se calculó según la fórmula VT= diámetro anteroposterior x transverso x longitudinal x 0,523. La VPS y la VFD fueron calculadas por el equipo de forma independiente y expresado en centímetros por segundos (cm/seg) usando un ángulo de corrección a través del curso de la arteria. El IR se calculó según la siguiente fórmula: IR= (VPS – VFD) / VPS × 100. Estos parámetros fueron evaluados y comparados en el pre y postoperatorio.
Los datos recogidos fueron procesados mediante el software estadístico SPSS en su versión 11.0, en una computadora Pentium IV, con el sistema operativo Windows XP, con las herramientas ofimáticas del Microsoft Office. La representación de los resultados se realizó en forma de textos y tablas diseñados para tal efecto. La estadística utilizada fue descriptiva, los resultados fueron expresados en valores absolutos, relativos y medidas de tendencia central. Para la comparación de los resultados se realizó una búsqueda bibliográfica mediante buscadores de información, entre estos: Scielo, EBSCO, Hinari y PubMed.
RESULTADOS
Como se evidencia en la tabla 1, se produjo un ligero aumento del volumen testicular entre el segundo y el sexto mes en referencia con el preoperatorio (17,45 mL; 16,44 mL / 17,07mL; 16,44 mL), pero se alcanzan valores casi idénticos a los 12 meses en comparación con los del preoperatorio (16,88 mL; 16,44 mL) aunque con una mayor desviación estándar (DE: ± 4,22516: ± 2,92130).
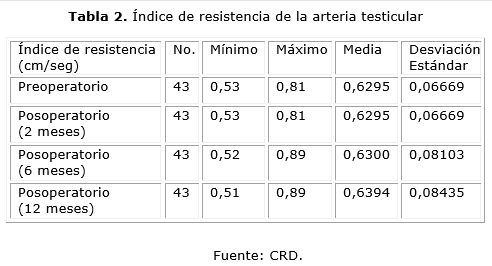
En la tabla 2 se muestran las cifras del índice de resistencia de la arteria testicular. En el preoperatorio se obtuvo una media de 0,6295 (DE ± 0,06669) sin sufrir casi variación en el posoperatorio donde se encontraron valores de 0,6300 como media a los 6 meses (DE ± 0,08103), con cifras en los cortes evaluados alrededor de esta fecha sin movimientos significativos en sus valores.
DISCUSIÓN
La hernioplastia de Lichtenstein es uno de los procedimientos quirúrgicos más utilizados en la corrección de los defectos herniarios de la ingle. La utilización de las bioprótesis de polipropileno en contacto directo con los elementos del cordón espermático y su posible repercusión sobre la perfusión testicular no está del todo dilucidado, y es motivo de profundos análisis y múltiples investigaciones en la actualidad.
Esta investigación aborda dichas cuestiones mediante el estudio y la comparación en el pre y postoperatorio de este proceder, complementada con revisión bibliográfica que permitió arribar a conclusiones específicas.
Como muestra la tabla 1, se evidenció un ligero aumento del volumen testicular entre el segundo y sexto mes en referencia con el preoperatorio, que disminuye hacia los 12 meses alcanzando valores casi idénticos a los del preoperatorio. Con esta evidencia consideramos que una vez concluido el período de fibrosis y contracción de la prótesis no se produjo repercusión importante sobre el volumen testicular.
Resultados similares fueron presentados por Brisinda y otros,16 en un estudio similar, llevado a cabo en 24 pacientes a los cuales se les realizó hernioplastia de Lichtenstein con seguimiento por US Doppler al mes, 3 y 9 meses del postoperatorio, no encontrando diferencias estadísticamente significativas en el volumen testicular. Lima Neto y otros, de forma similar niegan en sus resultados que la prótesis de PP afecte el volumen testicular.17
Igualmente coinciden con nuestros resultados Scullu, y otros,18 así como, Taylor, y otros,10 quienes no solo evaluaron la fibrosis producida sobre el cordón, sino también la contracción del implante, sin encontrar alteraciones en el volumen testicular.
Contrario a nuestros resultados encontramos reportes en la literatura que abogan por una relación entre el aumento del volumen testicular y los fenómenos obstructivos a nivel del cordón espermático. La revista Radiology (2012) publicó un estudio que avala este argumento; donde Jing Du y otros,19 comparan el volumen testicular en pacientes con azoospermia obstructiva (media: 16,0 ml; rango, 8,4–27,5 mL) y pacientes con azoospermia no obstructiva (media: 8,6 ml; rango, 0,9–21,0 mL; P < 0,001), encontrando un aumento significativo del volumen testicular en el primer grupo.
En nuestra serie no se encontró disminución del volumen testicular, lo cual también es considerada por otros autores como un importante marcador de atrofia testicular. Sobre lo cual Wantz describió que la atrofia testicular secundaria a orquitis isquémica puede ocurrir tanto en pacientes intervenidos con o sin prótesis.13
Consideramos que el volumen testicular podría verse aumentado en los días posteriores a la cirugía producto de la manipulación del cordón y los tironeamientos sobre el testículo. Estudios experimentales han demostrado que el solo hecho de manipular el cordón espermático podría producir daños histológicos y volumétricos en el testículo.20 Este aumento de volumen producido directamente por el acto operatorio podría guardar relación con el tipo de hernia y las dificultades técnicas que se presenten durante la reparación. Cabe asumir que grandes hernias inguinoescrotales podrían producir en los primeros días del postoperatorio un aumentos del volumen testicular, que persiste o no en dependencia del edema consecuente y la reacción inducida por la prótesis. Este aumento debe ir desapareciendo con el tiempo exceptuando los casos en que se produzca una verdadera afectación de su vasculatura, disminuyendo no solo su irrigación arterial sino también el retorno venoso y linfático.
Igualmente consideramos que en la etiopatogenia de la atrofia secundaria a orquitis isquémica deben participar otros factores adicionales al uso del implante, ya que por mucho que este afecte la irrigación, una alteración unilateral por sí misma no debería causar tal daño. La afirmación anterior está respaldada por la propia irrigación de este órgano, el cual recibe un 40 % de sangre arterial proveniente del testículo contralateral, los vasos del escroto, y las ramas perineales de la pudenda inferior, las cuales no se ven afectada en ningún caso por el uso de bioprótesis.17
En lo referente al estudio de la perfusión testicular y el posible efecto que sobre esta podría tener el bioimplante, debemos decir que se estudió tomado en cuenta que la principal irrigación de este órgano está dada por la arteria testicular, la cual junto con el resto de los elementos del cordón queda expuesta a la fibrosis inducida por el PP. En esta investigación se observó el comportamiento en el pre y postoperatorio del índice de resistencia (IR) de dicha arteria. Se utilizó este parámetro ya que se acepta que el aumento del IR es un importante indicador de oclusión arterial21 y que las alteraciones del flujo testicular tienen una influencia directa en el volumen y función de este órgano, e incluso ha sido relacionado por otros autores con alteraciones en la fertilidad.22
Como presentamos en la tabla 2 no se encontraron movimientos significativos en los valores del IR en los cortes evaluados, por lo que consideramos que el uso del implante en nuestros casos no produjo alteraciones en el flujo arterial del testículo.
Coinciden con nuestros resultados lo hallado por Nuri Ostman y otros, quienes en un estudio prospectivo randomizado, estudiaron el flujo arterial durante el preoperatorio y a los 3 meses del postoperatorio de una hernioplastia inguinal con malla de PP, utilizando el IR como referencia. Este estudio encontró IR 0,65 (DE: ± 0,017) en el preoperatorio sin alteraciones relevantes en el post (0,66 DE: ± 0,014) no encontrando diferencias significativas.8
Igualmente Brisinda, y otros, en un estudio prospectivo en 24 pacientes a los cuales se les realizó el proceder de Lichtenstein con seguimiento por US Doppler al mes, 3 y 9 meses del postoperatorio no encontraron diferencias estadísticamente significativas en el flujo testicular. 16
Los resultados de Ramadan, y otros, igualmente coinciden con los nuestros, ellos tampoco encontraron alteraciones de estos parámetros medidos igualmente mediante US Doppler, agregando además que compararon el lado contralateral a la cirugía como grupo control, sin encontrar tampoco alteraciones entro uno y otro grupo.23
Por último, Beddy y otros, en su investigación sobre el papel de la reparación herniaria como protección de la función testicular realizada tanto en pacientes con hernioplastias abiertas como endoscópicas informó que no existe repercusión directa entre la técnica utilizada y su repercusión sobre el testículo.24
Resultados similares reportaron en la revista Hernia (2012), Stula y otros, así como, Lima Neto y otros, quienes no encontraron repercusión clínica significativa en la perfusión del testículo.25,17
El reporte más actualizado encontrado sobre este tema y que tiene semejanza con nuestros resultados, es el reporte de Bulus y otros, publicado en febrero de 2013, quienes afirman que la técnica de Lichtenstein no produce ningún efecto negativo sobre la perfusión testicular.26
Aydede, y otros , en el análisis de sus resultados, similares a los nuestros, consideran que el aumento transitorio del IR durante el postoperatorio inmediato con una normalización a los 6 meses, puede estar debido al trauma del acto operatorio y al edema consecuente que luego se produce.27 Nosotros concordamos con esta teoría y consideramos además que el mantenimiento de los valores normales puede deberse al nivel de estenosis que debería provocar el implante para modificar el flujo de la arteria testicular. Ya que aunque se conoce ampliamente el porcentaje de contracción de la prótesis una vez colocada y la fibrosis que induce sobre los elementos del cordón, es necesario una estenosis mayor al 70 % del diámetro de dicha arteria para modificar los valores del IR, lo cual no consideramos se produzca solo por el efecto del bioimplante.
Este efecto ha sido estudiado en modelos animales que entran en desacuerdo con nuestros resultados, como ejemplo de esto tenemos el estudio realizado por Peiper, y otros, en conejos quienes mostraron disminución en la perfusión testicular secundario al uso de prótesis.28 Sin embargo, también se ha reportado que este podría aumentar.18
Todo lo antes dicho se ve limitado para su más profundo análisis por la existencia de muy pocos trabajos que evalúen estos aspectos, consideramos se hace necesario el diseño de estudios más extensos y con grupos de comparación.
CONCLUSIONES
No se encontraron alteraciones de la perfusión testicular asociado al uso de la prótesis de polipropileno en la hernioplastia de Lichtenstein, considerándola una técnica segura y eficaz en la reparación de las hernias inguinales.
REFERENCIAS BIBLIOGRÁFICAS
1. Matthews RD, Neumayer L. Inguinal hernia in the 21st century: an evidence-based review. Curr Probl Surg. 2011;45:261–312.
2. Kocijan R, Sandberg S, Chan YW, Hollinsky C. Anatomical changes after inguinal hernia treatment: a reason for chronic pain and recurrence hernia? Surg Endosc 2010;24:395–9.
3. Schumpelick V, Ramshaw B, Junge K. Hernia repair: the search for ideal mesh. Hernia. 2010;14:81–7.
4. Torcivia A, Vons C, Barrat C, Dufour F, Champault G. Influence of mesh type on the quality of early outcomes after inguinal hernia repair in ambulatory setting controlled study: Glucamesh vs Polypropylene. Lan Arch Surg. 2011;396:173–8.
5. Efthimiou M, Symeonidis D, Koukoulis G, Tepetes K, Zacharoulis D, Tzovaras G. Open inguinal hernia repair with the use of a polyglycolic acid-trimethylene carbonate absorbable mesh: a pilot study. Hernia. 2011;5:181–4.
6. Negro P, Gossetti F, Dassatti MR, Andreuccetti J, D’Amore L. Bioabsorbable Gore BIO-A plug and patch hernia repair in young adults. Hernia. 2012;16:121–2.
7. Brown CN, Finch JG. Which mesh for hernia repair? Ann R Coll Surg Engl.2010;92:272-8.
8. Dilek ON, Yucel A, Akbulut G, Degirmenci B. Are there adverse effects of herniorrhaphy techniques on testicular perfusion? Evaluation by color Doppler ultrasonography. Urol Int. 2005;75:167–9.
9. El-Awady S. E. Beneficial effect of inguinal hernioplasty on testicular perfusion and sexual function. Hernia. 2009;13(3):251-8.
10. Taylor SG, Hair A, Baxter GM, Dwyer PJ. Does contraction of mesh following tension free hernioplasty effect testicular or femoral vessel blood flow? Hernia. 2001;5:13-15.
11. Silber SJ. Microsurgical TESE and the distribution of spermatogenesis in non-obstructive azoospermia. Hum Reprod. 2010;15(11):2278–84.
12. Matthews RD, Neumayer L. Inguinal hernia in the 21st century: an evidence-based review. Curr Probl Surg. 2011;45:261–312.
13. Wantz GE. Testicular atrophy and chronic residual neuralgia as risks of inguinal hernioplasty. Surg Clin North Am. 1993;73:571–81.
14. Hallén M Westerdahl J Nordin P Gunnarsson U Sandblom G Mesh hernia repair and male infertility: a retrospective register study. Surgery. 2012;151(1):94-8.
15. Di Vita G, Milano S, Frazzetta M. Tension-free hernia repair is associated with an increase in inflammatory response markers against the mesh. Am J Surg. 2010;180:203-7.
16. Brisinda G, Cina A, Nigro C, Cadeddu F, Brandara F, Marniga G, et al. Duplex ultrasound evaluation of testicular perfusion after tension-free inguinal hernia repair: results of a prospective study. Hepatogastroenterology. 2008;55(84):974-8.
17. Lima Neto EV, Goldenberg A, Lucas MJ. Prospective study on the effects of a polypropylene prosthesis on testicular volume and arterial flow in patients undergoing surgical correction for inguinal hernia. Act Cir Bras. 2007;22:266-71.
18. Scullu I, Filiz AI, Sen B, Ozdemir Y, Yucel E, Sinan H, et al. The effects of inguinal hernia repair on testicular function in young adults: a prospective randomized study. Hernia 2010;14:165–9.
19. Jing D, Li FH, Guo YF, Yang LM, Zheng JF, Chen B, et al. Differential Diagnosis of Azoospermia and Etiologic Classification of Obstructive Azoospermia: Role of Scrotal and Transrectal US. Radiology. 2012;263(3):41.
20. Lee SL, Jeffrey J, DuBois, Rishi M. Testicular Damage after surgical groin exploration for elective herniorrhaphy. J Pediatr Surg. 2000;35(2):327-30.
21. Lefort C, Thoumas D, Badachi Y, Gobet F, Pfister C, Dacher JN. Ischemic orchiditis: review of 5 cases diagnosed by color Doppler ultrasonography. J Radiol. 2001;82(7):839–42.
22. Pinggera GM, Mitterberger M, Bartsch G, Strasser H, Gradl J, Aigner F, et al. Assessment of the intratesticular resistive index by colour Doppler ultrasonography measurements as a predictor of spermatogenesis. BJU Int. 2008;101:722-6.
23. Ramadan SU, Gokharman D, Tuncbilek I, et al. Does the presence of a mesh have an effect on the testicular blood flow after surgical repair of indirect inguinal hernia? J Clin Ultrasound. 2009;37:78–81.
24. Beddy P, Ridgway PF, Geoghegan T, et al. Inguinal hernia repair protects testicular function: a prospective study of open and laparoscopic herniorraphy. J Am Coll Surg. 2011;203:17–23.
25. Stula I, Druzijanic N, Srsen D, Capkun V, Perko Z. Influence of inguinal hernia mesh repair on testicular flow and sperm autoimmunity. Hernia. 2012;16:417–24.
26. Bulus H, Dogan M, Tas A, Agladıoglu K, Coskun A. The effects of Lichtenstein tension-free mesh hernia repair on testicular arterial perfusion and sexual functions. Wien Klin Wochenschr. 2013;125(4):96-9.
27. Ayede H, Erhan Y, Sakarya A, Kara E, Ilkgul O, Can M. Effect of mesh and its location on testicular flow and spermatogenesis in patients with groin hernia. Act Chir Belg. 2013;103:607-10.
28. Peiper C, June K, Klinge U, Strehlau E, Ottingr A, Schumpelick V. Is there a risk of infertility after inguinal mesh repair? Experimental studies in the pig and the rabbit. Hernia. 2006;10:7-12.
Recibido: 6 de agosto de 2015.
Aceptado: 12 de noviembre de 2015.
Orlando de la Paz Mora . Hospital Universitario "Comandante Manuel Fajardo". La Habana, Cuba.
Correo electrónico: orlandopm@infomed.sld.cu