Introducción
El cáncer de pulmón (CP) se ha incrementado en las últimas décadas debido al aumento del consumo del tabaco.1 En 2018, en ambos sexos, la incidencia alcanzó 2 100 000 nuevos diagnósticos con 1 800 000 millones de mortalidad.2 En Cuba, en el 2017 fue la tercera localización en frecuencia, para cáncer. En el año 2019 fue la principal causa de mortalidad en hombres y mujeres con tasas de 61,6 y 38,1 por 100 000 habitantes.3 El sistema TNM y la clasificación histológica permiten informar la enfermedad N2 y las estaciones afectadas.4) Los tipos de linfoadenectomía mediastinal son:5
Muestreo o muestreo al azar: Resecar algunos ganglios del mediastino al azar, los cuales sean palpables o visibles.
Muestreo sistemático (SS): Se resecan ganglios (no todos) en los diferentes grupos relacionados con la anatomía del tumor.
Disección de nódulos linfáticos mediastinales (MLND) completa: Incluye todos los grupos ganglionares ipsolaterales o del lado pulmonar afectado.
MLND extendida: Reseca los ganglios cervicales y mediastínicos bilateral.
Disección sistemática de nódulos linfáticos lóbulo específico: Reseca todos los nódulos linfáticos basado en la localización anatómica del tumor.
Disección sistemática nodular: Combinación de disección de nódulos linfáticos intrapulmonares, hiliares y mediastínicos, esta última con SS.5
La extensión óptima de la resección ganglionar está por determinar. Un metaanálisis concluyó que la disección ganglionar sistemática frente al muestreo ganglionar se asocia a una mejor supervivencia,6 de existir una estadificación precisa,7 lo que muestra diferencias en las complicaciones con las distintas técnicas.8 Se plantea que la disección selectiva tiene menor morbilidad.7,9) En algunos estudios la evaluación ganglionar en mediastino y región broncopulmonar no se realiza de forma sistemática,8,10 lo que varía la cantidad de ganglios a resecar.11,12,13) Se realizó esta investigación con el objetivo de determinar los resultados de supervivencia en los enfermos con lesiones resecables por cáncer de pulmón con linfadenectomía completa o linfadenectomía por muestreo.
Métodos
Estudio prospectivo tipo serie de casos realizado en el Hospital Provincial General Camilo Cienfuegos de Sancti Spíritus entre 1996-2019, incluyó 118 pacientes con cáncer de pulmón de células no pequeñas con lesiones resecables en estadios I, II y IIIA, con función respiratoria y cardiovascular adecuada, 73 con una linfadenectomía por muestro (Grupo A) y 45 con linfadenectomía completa (Grupo B). El período de seguimiento en el grupo A fue 15 años (1996-2010) y en grupo B, 10 años (2011-2019).
Se utilizó la clasificación TNM seis vigente hasta el 2010. En el grupo A se utilizó un subgrupo de 21 enfermos para analizar los ganglios resecados, en el resto no se cuantificó en el informe de patología. En el grupo B, con linfadenectomía completa, se informó en los 45 enfermos. En la edad se utilizó la media y la desviación estándar. Para identificar la asociación entre el tamaño del tumor, ganglios resecados y positividad se emplearon tablas de contingencia. Se calculó el riesgo relativo (RR) y su intervalo de confianza (IC) del 95 %. Se utilizó el estadígrafo de Kaplan Meier con la supervivencia media y su intervalo de confianza al 95 %. Se aplicó la prueba de significación de Tarone (p< 0,05).
Resultados
La edad media en el grupo A fue de 59,01 con desviación estándar de 10,48 y en el grupo B fue 59,11 con desviación estándar de 9,46. Predominaron las edades cerca o mayor de 60 años: en el grupo A los hombres fueron 51 (69,86 %) y las mujeres 22 (30,13 %), mientras que en el B, 31 (68,8 %) fueron hombres y mujeres 14 (31,1 %). La variedad histológica más frecuente en el A fue el carcinoma epidermoide con 34 pacientes (46,57 %) y en el B el adenocarcinoma, con 24 (53,3 %).
La región anatómica más afectada en el grupo A fue el lóbulo superior en 46 (63,01 %) enfermos, seguido por el lóbulo medio con 10 (13,69 %), 15 (20,54 %) en lóbulo inferior y 2 (2,73 %) en el hilio pulmonar. En el B, en 28 (62,2 %) la lesión fue en lóbulo superior, 2 (4,4 %) en lóbulo medio, 10 (22,2 %) en lóbulo inferior y 5 (11,1 %) en hilio pulmonar.
Según la clasificación TNM, en el grupo A, 7 (9,58 %) estaban en el estadio IA, 1 (1,36 %) en IIA, 23 (31,50 %) en IB, 25 (34,24 %) en IIB, 14 (19,17 %) en IIIA, 1 (1,36 %) en IIIB y 2 (2,73 %) en estadio IV. En el grupo B, 5 (11,1 %) estaban en IA, 3 (6,6 %) en IIA, 11 (24,4 %) en IB, 12 (26,6 %) en IIB, y 14 en IIIA (31,3 %). La técnica más realizada fue la lobectomía, en el grupo A 41 (49,39 %) seguida por la neumonectomía 22 (26,50 %), la bilobectomía 9 (10,84 %) y una resección atípica, mientras que en el grupo B se realizaron 34 (75,5 %) lobectomías, 2 (4,4 %) bilobectomías y 9 (20 %) neumonectomías.
De los 118 pacientes, 97 (82,2 %) tenían tumores mayores de 3 cm de diámetro y 21 (17,7 %) de hasta tres cm. En el grupo A se resecaron ganglios en 55 pacientes, 49 (89,1 %) tenían tumores mayores de 3 cm y seis (10,9 %) menores de 3 cm, no se resecaron ganglios en 18 pacientes, 13 (72,2 %) con tumores mayores de tres cm y 5 (27,8 %) con tumores menores de 3 cm. En el grupo B fueron resecados los ganglios en los 45 enfermos, en 35 (77,7 %) presentaban tumores mayores de 3 cm y 10 (22,2 %) con tumores menores de 3 cm (tabla 1).
Tabla 1 Ganglios resecados según el tamaño del tumor en ambos grupos
| Ganglios resecados | Grupos | Mayor de 3 cm | Menor de 3 cm | Total | |||||
|---|---|---|---|---|---|---|---|---|---|
| no | % | no | % | no | % | ||||
| Sí | A | 49 | 89,1 | 6 | 10,9 | 55 | 100 | ||
| B | 35 | 77,7 | 10 | 22,2 | 45 | 100 | |||
| No | A | 13 | 72,2 | 5 | 27,8 | 18 | 100 | ||
| Total | 97 | 82,2 | 21 | 17,7 | 118 | 100 | |||
En el grupo A se resecaron ganglios en 55 pacientes, 22 (40 %) fueron positivos de malignidad y 33 (60 %) negativos. En el grupo B, de los 46 pacientes, 28 (62,2 %) fueron positivos y 17 (37,7 %) negativos. El riesgo relativo (RR) fue 1,55 y el intervalo de confianza (IC), de 95 % entre 1,04-2,31 (tabla 2).
Tabla 2 Pacientes con ganglios resecados positivos en ambos grupos
| Positivo |
Grupo A (n = 55) |
Grupo B (n = 45) |
RR | IC 95 % |
|---|---|---|---|---|
| Sí | 22 (40) | 28 (62,2) | 1,55 | 1,04-2,31 |
| No | 33 (60) | 17 (37,8) |
En el grupo A en 20 (95,2 %) casos se resecaron menos de seis ganglios y en 1 (4,7 %) más de seis. En el grupo B, se resecaron más de 6 ganglios en todos los casos, 21 veces superior a la frecuencia del grupo A. El riesgo relativo (RR) fue de 21 y el intervalo de confianza (IC) de 95 % fue entre 3,01-142,21 (tabla 3).
Tabla 3 Ganglios resecados por paciente para ambos grupos
| Ganglios resecados |
Grupo A (n = 73) |
Grupo B (n = 45) |
RR | IC 95 % |
| > 6 | 1 (4,7) | 45 (100) | 21 | 3,01-142,21 |
| < = 6 | 20 (95,2) |
En el grupo A se resecaron en mediastino en 34 (46,5 %) pacientes y en hilio y pulmón 46 (63 %). En el B, en el 100 % se resecaron ganglios en mediastino y en 43 (95,5 %) en hilio y pulmón; en este grupo la media fue 10 y en mediastino fue de 8 ganglios. El RR calculado para mediastino fue de 2,14 IC 95 % de 1,67- 2,74. En hilio y pulmón el RR de 1,51 IC 95 % de 1,25-1,82.
Las complicaciones postoperatorias no se describieron por pacientes, en algunos casos se presentó más de una. En el grupo A, las más frecuentes fueron la atelectasia, la arritmia y la neumopatía inflamatoria, lo que causó el fallecimiento de seis enfermos. En el B, las más frecuentes fueron la arritmia y la neumopatía inflamatoria, lo que provocó la muerte de un enfermo por trastornos de la contractilidad cardíaca (tabla 4).
Tabla 4 Complicaciones posoperatorias y pacientes fallecidos
| Complicaciones posoperatorias | Número | Fallecidos | ||
|---|---|---|---|---|
| A | B | A | B | |
| Atelectasia | 4 | 1 | 1 | ( |
| Arritmias | 3 | 3 | 0 | ( |
| Neumopatía inflamatoria | 2 | 2 | 1 | ( |
| Choque posoperatorio | 2 | ( | 1 | ( |
| Tromboembolismo pulmonar | 1 | ( | 1 | ( |
| Hemólisis postransfusión | 1 | ( | 1 | ( |
| Rotura traqueal por intubación | 1 | ( | 1 | - |
| Fístula bronquial | 1 | 1 | ( | ( |
| Empiema | 1 | ( | ( | ( |
| Absceso pulmonar | 1 | ( | ( | ( |
| Distrés respiratorio | 1 | ( | ( | ( |
| Edema agudo de pulmón | ( | 1 | ( | ( |
| Trastorno contractilidad cardíaca | ( | 1 | ( | 1 |
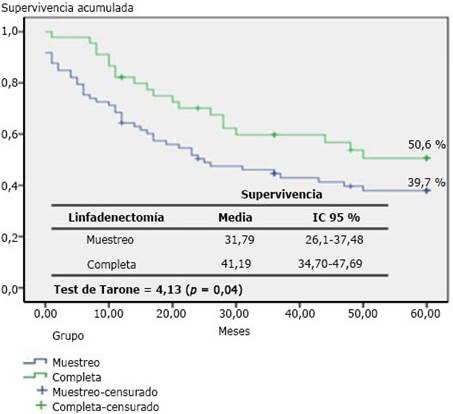
La curva de supervivencia a los cinco años mostró un 39,7 % en el grupo de muestreo y 50,6 % en la linfoadenectomía completa. La media en meses fue de 31,79 con IC 95 % de 26,1-37,48 para el muestreo y 41,19 con IC 95 % de 34,70-47,69 con la completa. El test Tarone (4,13-P: 0,04) informó una diferencia significativa entre las curvas de supervivencias (p< 0,05) (fig.).
Discusión
La lobectomía con linfadenectomía, informada en 1960 por Cahan14 como lobectomía radical, en la actualidad es el proceder estandarizado en el cáncer de pulmón. La óptima disección de ganglios linfáticos es controversial; resulta determinante la selección de la técnica y los grupos anatómicos.14
Los dos grupos de la serie presentaban similitud, con predominio de enfermos en edades avanzadas, similar a otros estudios.15,16 El sexo masculino fue el más afectado17) y algunos lo señalan como factor de riesgo de metástasis ganglionar locorregional e hiliar.18 El sexo femenino predominó en algunas publicaciones.15,16 El carcinoma epidermoide fue más frecuente en el grupo A con poca diferencia del adenocarcinoma, este último fue más frecuente en el B. La frecuencia de metástasis en nódulos linfáticos varía en el subtipo adenocarcinoma con diámetro menor o igual a 3 cm, siendo más alta en el micro papilar y el sólido.19) La región anatómica más afectada son los lóbulos superiores.18 Los inferiores, el medio y el hilio son factores de riesgo clínico-patológico de invasión ganglionar.8,17
Los estadios l y ll predominaron en ambos grupos, 77,7 % en el A y 66,6 % en el B. El estadio l se presentó en el 41,9 y 68,8 % en los grupos A y B. Según la Global Cancer Statisticts, entre el 40-50 % están en estadio l, mejorando la supervivencia, al tener menor invasión nodular.20 En el estadio lll A, la disección completa es más compleja, por tener mayor número de ganglios positivos; a partir de este estadio se clasifican ganglios positivos en mediastino (N2).
La técnica más utilizada es la lobectomía; en casos seleccionados se recomienda realizar neumonectomía y resección sublobar,21 Entre el 26-32 % presentan metástasis ganglionar en el momento del diagnóstico.22 En una tesis doctoral realizada en Barcelona23 se plantea que la palpación y exploración visual de los ganglios mediastínicos presentan una sensibilidad del 70 % y un valor predictivo positivo de 64 %, no abrir la pleura mediastínica conduce a resultados imprecisos con posibilidad de micrometástasis.10 Otro problema son las dificultades para realizar una clasificación TNM clínica, radiológica e invasiva adecuada.24
En la linfadenectomía por muestreo en ocasiones se decide la extirpación del ganglio por su tamaño, similar a la definición de ganglio invadido por TAC, que se considera normal hasta un centímetro; esta última tiene una sensibilidad y valor predictivo mejor que el muestreo. Según Velásquez,25 el diámetro normal de los nódulos en mediastino varía entre 2-3 cm, otros trabajos señalan que el tamaño del ganglio no predice la malignidad.26) En la linfadenectomía completa se extraen ganglios sin distinguir el tamaño.
El diámetro del tumor pulmonar es predictor de metástasis en nódulos linfáticos, la medida límite varía entre 2-3 cm.11,18,19 En nuestra serie en 13 pacientes del grupo A con tumores de más de 3 cm no se resecaron ganglios con el muestreo, algunos pudieron haber tenido malignidad. La mayoría de los nódulos linfáticos positivos se presentan en tumores mayores de 3 cm.27 Andrea Bille encontró que el 9 % de los operados en estadio I tuvieron enfermedad N2 oculta en mediastino.28 Bing Chen informó que un 16,6 % de pacientes operados en estadio I tenían metástasis ganglionar.
La positividad de ganglios con invasión tumoral en la serie fue más alta en la completa, el riesgo relativo calculado sugiere que la frecuencia de positividad de la linfoadenectomía completa fue 1,5 veces superior al muestreo. El número de ganglios resecados ha sido asociado con probabilidad de detectar metástasis ganglionar,29 mejor supervivencia global y supervivencia libre de enfermedad.14,30 La Sociedad Española de Neumología y Cirugía Torácica (SEPAR)11 señala que se deben extirpar como mínimo 6 ganglios, 3 del hilio y estaciones intrapulmonares y 3 del mediastino de tres estaciones incluyendo la 7, criterio similar a la Asociación Internacional para el Estudio del Cáncer de Pulmón (IASCL).12 Cackowski,13 considera apropiado resecar como mínimo 10 ganglios,31 y Ying-Sheng Wen30 plantea resecar 12.
Enkuo Zheng, con resecciones sublobares en tumores menores de 2 cm, informó un grupo extirpando entre 1-3 ganglios y otro grupo con 4 o más, con mejor supervivencia en el segundo grupo.32 Weldong Wang, en operados con diferentes tipos de linfoadenectomía en estadios I, resecó una mediana de 17 ganglios, y obtuvo mejor pronóstico con la linfadenectomía sistemática y bilateral.33 Rami-Porta14 considera que los ganglios resecados positivos deben ser contados y definida la estación.
Se ha comprobado en disección de cadáveres,25 alrededor de 30 nódulos linfáticos para cada lado del mediastino, con máximos de 67 para el lado derecho y 85 para el lado izquierdo. Se considera que 10 es la cantidad mínima de ganglios a resecar en una linfoadenectomía, incluyendo las estaciones cuatro (paratraqueal baja), diez (hiliar) y siete (subcarineal), mínimo de ocho ganglios del mediastino.
En la serie presentamos pocas complicaciones, ninguna relacionada con la técnica, similar a otros estudios7,8,9 Sahar-Mokhle34 informó complicaciones como sangrado, quilotórax, lesión del recurrente y escape bronquial.
El test Tarone encontró una diferencia significativa entre las curvas de supervivencias de ambas técnicas de linfadenectomías (p< 0,05), en Cirugía de Sabiston22 se muestra una de supervivencia a los 5 años, del 73 % para IA, 58 % IB, 46 % IIA, 36 % IIB, 24 % IIIA y 9 % IIIB, cifras similares a Schwartz.35
En varias series publicadas la supervivencia a los 5 años es del 40 % y en algunas un 55 %.36 Las cifras bajas de sobrevida en el muestreo están asociadas a la escasa cantidad de ganglios extraídos y a factores de riesgo por mayor cantidad de nódulos linfáticos afectados,14 el tamaño del tumor mayor de 3 cm y la variedad adenocarcinoma. El número de ganglios resecados está asociado con la detección de metástasis ganglionar29) y una mejor supervivencia libre de enfermedad.14,30
La mayoría de los autores prefieren la linfadenectomía ipsolateral completa (MLND), al resecar los ganglios de los grupos anatómicos con la grasa alrededor del lado del tumor pulmonar,10,15,17,18,19,34 en especial en pacientes con diagnóstico de N2.18 Esta técnica permite mayor extracción de ganglios de las estancias, sin dejar micrometástasis y el N2 ocultas.37) En técnicas de toracoscopía videoasistida (VATS) y robótica (RATS), se prefiere este proceder.15) El posible tumor residual (R), cuando no se realiza disección completa o locorregional, se clasifica como incierta (Run), que es la siguiente categoría a R0 (sin tumor residual);38 esto se plantea, aun con bordes de resección libres de tumor.
En estudios entre muestreo y linfadenectomía completa se informan mejores resultados de supervivencia en la segunda con diferencias discretas.7) Weindong Wang33 informó en el estadio I, un mejor pronóstico donde se extirpan más ganglios (disección sistemática y bilateral), otros trabajos señalan similares resultados.39 Liang Pan40 no encontró diferencias en supervivencia entre la lobectomía simple o acompañada de resección completa mediastinal en pacientes con estadio IA. En algunos trabajos no se aclara si el muestreo es aleatorio o sistemático,7 esto puede influir en los resultados de sobrevida.
Conclusiones
Los pacientes que fueron operados con linfadenectomía completa tuvieron una mayor supervivencia que los que fueron intervenidos mediante una linfadenectomía por muestreo. Con la linfadenectomía completa se logró resecar más cantidad de ganglios y se obtuvo un mayor número de ganglios positivos, sin complicaciones relacionadas con el proceder.