Introducción
El hemangiopericitoma (HPC) fue descrito por primera vez en 1942 por Stout y Murray, como un raro tumor mesenquimal y altamente vascular que se origina de los pericitos de Zimmermann, los cuales son células especializadas encontradas alrededor de la salida de los capilares sanguíneos y vénulas post capilares;1,2) por lo tanto, este tipo de tumor puede aparecer en cualquier parte del cuerpo. Representan del 2 % al 3 % de todos los sarcomas de tejidos blandos en humanos y ocurren principalmente en el sistema musculoesquelético. Aproximadamente entre el 15 % y el 30 % de todos los hemangiopericitomas se producen en la región de la cabeza y el cuello,3 por lo que supone un reto diagnóstico para el patólogo y el clínico.
En la literatura científica latinoamericana se han descrito pocos casos relacionados con el tema. La infrecuencia del HPC en el cuello lo convierte en un caso inusual, de ahí la importancia de describir el presente caso clínico quirúrgico de un hombre de 39 años, con el objetivo de presentar un caso de un hemangiopericitoma en el cuello, como un caso inusual, con potencial maligno desconocido, diagnóstico y tratamiento oportuno.
Presentación de caso
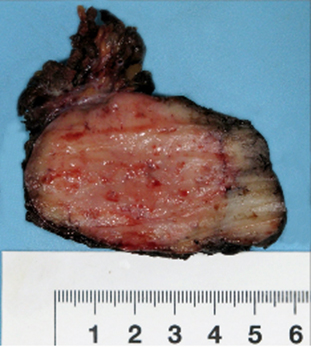
Paciente masculino de 39 años de edad, sin antecedentes de interés, quien desde hace 3 años y sin causa aparente, percibe la presencia de una lesión tumoral localizada a nivel V del cuello derecho, de crecimiento progresivo. Al examen físico se aprecia un tumor de bordes regulares, de consistencia duro-elástica de aproximadamente 6 cm x 7 cm x 6 cm, parcialmente móvil, no doloroso, sin adenomegalias. Se decidió realizar una biopsia incisional notando durante el procedimiento un incremento inusual en el sangrado del tejido incidido. El reporte de histopatología documentó un hemangiopericitoma (fig. 1), confirmado por inmunohistoquímica (fig. 2 A y 2 B).

Fig. 1 - Hematoxilina Eosina 400X: tumor vascularizado con densa proliferación de pericitos de núcleos ovoides con bordes indefinidos sin mitosis ni necrosis.
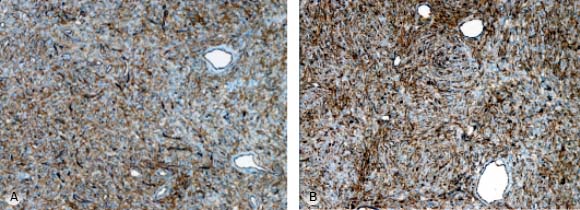
Fig. 2 - A) Inmunohistoquímica. CD34: Proliferación de pericitos alrededor de los vasos sanguíneos B) Inmunohistoquímica. F VIII: Patrón de crecimiento perivascular.
Posteriormente se realizó una angiotomografía cervical que muestra un tumor vascularizado de bordes regulares (fig. 3A y 4B).
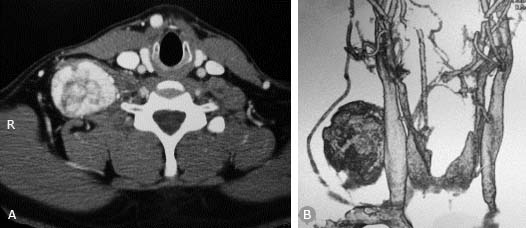
Fig. 3 - A) Angiotomografía cervical. En corte axial se muestra un tumor altamente vascularizado B) Reconstrucción en 3D: Se observa un tumor interescalénico con su probable origen en la arteria cervical profunda.
El paciente fue tratado mediante cervicotomía. Mediante esta cirugía se encontró, entre los niveles Va y Vb derechos, un tumor sólido encapsulado de aproximadamente 6 x 5 x 5 cm de bordes regulares, pero con tejido adherencial peritumoral y densamente vascularizado (fig. 4).
El tumor estaba ubicado bajo los nervios supraclaviculares intermedio y lateral, lo que comprimía parcialmente el plexo braquial y los músculos escalenos. Se realizó la resección tumoral completa, poniendo énfasis en el control de la hemostasia. No hubo complicaciones trans- ni posoperatorias.
El reporte histopatológico de la pieza quirúrgica documentó un hemangiopericitoma de 6 x 6 cm, con invasión de su cápsula y un ganglio linfático peritumoral con hiperplasia. El paciente recibió tratamiento adyuvante con radioterapia externa en dosis de 60 Gy (2 Gy/d), con morbilidad cutánea grado II. Actualmente el paciente no presenta evidencia de actividad tumoral 9 años después de iniciado su tratamiento.
Discusión
El hemangiopericitoma (HPC) es un tumor de tejidos blandos poco común, vascularizado, mesenquimal que se origina de los pericitos,2,4 que son células alargadas, con una lámina basal pericelular, pinocitosis plasmalémico y un número variable de microfilamentos.5,6) La función exacta de los pericitos es desconocida, pero se ha postulado que estas células tienen un poder contráctil y controlan el calibre de los vasos. Actualmente no se considera una entidad específica, sino más bien como un patrón de crecimiento, el cual es compartido por muchas neoplasias; sus características ultraestructurales y/o inmunohistoquímicas no son específicas.5,6,7
El término “hemangiopericitoma” fue determinado por Stout y Murray en 1942 basado en ciertas similitudes citológicas con los pericitos,1 descritos por primera vez en 1923 por el histólogo suizo Zimmermann como células especializadas encontradas en forma de espiral alrededor de la salida de los capilares sanguíneos y vénulas poscapilares y que se pensaba eran células musculares lisas modificadas.2,8,9,10,11
Existe una preponderancia femenina muy leve. Los HPC son más frecuentes en las personas de mediana edad que en los lactantes y los niños.12,13 Sin embargo, la incidencia máxima suele situarse entre la quinta y séptima décadas de la vida.4
Es un tumor raro que representa aproximadamente el 1 % de todas las neoplasias vasculares y el 15 % de los tumores de tejidos blandos; del 15 al 30 % de estas lesiones ocurren en la región de la cabeza y el cuello.4,12,14)
Stout y Murray describieron nueve casos de “tumores compuestos por vasos sanguíneos capilares, con una o más capas de células redondeadas dispuestas sobre ellos;1 sin embargo, no fue sino hasta 1949 cuando Stout reportó 25 casos adicionales que recibió amplio reconocimiento. Una de las observaciones de este reporte es que este tipo de tumor puede aparecer en cualquier parte del cuerpo y que su morfología no predice el comportamiento de estas lesiones.9
Patológicamente son tumores bien circunscritos, de color pardo, firmes, pueden ser lobulados o nodulares, se encuentran rodeados por una pseudocápsula y están firmemente adheridos a los músculos circundantes o a su fascia.15 En vista de que los pericitos se encuentran en los capilares y vénulas de prácticamente todos los tejidos, no es sorprendente que los HPC se hayan reportado en algunas áreas del cuerpo incluyendo hueso, SNC, vísceras y tejidos blandos.16 Con mayor frecuencia crece en las extremidades inferiores y el retro peritoneo, mientras que en el área de cabeza y cuello es el tercer sitio más común. En la serie de 106 pacientes reportada por Enzinger y Smith, el 35 % de tumores se localizaron en extremidades inferiores, 25 % en retroperitoneo pélvico, 16 % (17 pacientes) involucraron la región de cabeza y cuello, 14 % en tronco y 10 % en extremidades superiores.17 Por otro lado, Espat y otros, como resultado de su estudio, observaron que estos tumores pueden crecer con igual frecuencia en extremidades, pelvis, cabeza y cuello. La localización de estos tumores en su mayoría fue en axila y muslo, mientras que en el grupo de los tumores de cabeza y cuello se observó una mayor frecuencia en meninges y mejilla.18
Los estudios de inmunohistoquímica en numerosos hemangiopericitomas expresan positivamente CD34; sin embargo, usualmente la desmina y citoqueratina son negativas. Adicionalmente, la vimentina tipo III (proteína de filamento intermedio que es expresada en células mesenquimales) es el único marcador expresado consistentemente en estos tumores.18) En los estudios de inmunohistoquímica también se puede demostrar la expresión de actina muscular específica (HHF-35), actina de músculo liso y la tropomiosina, que se demuestra hasta en el 10-20 % de los hemangiopericitomas.19,20,21
La red vascular de estos tumores es ramificada y se puede observar gran variación en su calibre con una disposición en “asta de ciervo”. Frecuentemente los vasos están rodeados por una delgada cubierta de colágeno que se extiende hacia el intersticio. El HPC es un tumor altamente vascular y ocasionalmente causa un importante shunt arteriovenoso.22
Un problema de gran importancia para los patólogos es la inhabilidad para determinar una exacta evaluación del potencial biológico del tumor. Se ha reportado también que el pronóstico depende del tamaño, la localización y la actividad mitótica del tumor primario, es así como los tumores pequeños superficiales que se presentan en pacientes jóvenes tiene un comportamiento benigno en relación con los tumores localizados en tejidos blandos profundos del muslo, retroperitoneo, mesenterio y del mediastino que tienen una evolución más agresiva.9,23 Hasta el momento no existen criterios pronósticos aprobados en un consenso universal. Sin embargo, históricamente, se ha informado que los hemangiopericitomas tienen un pronóstico peor que el tumor fibroso solitario, con tasas de supervivencia del HPC a 5 y 10 años tan bajas como 59 y 47-70 %, respectivamente, 3, 15 y hasta 48 % de mortalidad específica de la enfermedad.24
Se desconoce la etiología de estos tumores; sin embargo, el trauma pasado, la hipertensión, el embarazo y el uso de corticoides se consideran factores predisponentes.4
La Organización Mundial de la Salud (OMS) lo reclasifica como un tumor fibroblástico/miofibroblástico, con una incidencia de menos del 20 % en cabeza y cuello.(11) Microscópicamente se pueden distinguir tumores benignos, borderline y malignos; Michael y otros realizó un estudio en 60 pacientes, en los cuales evaluó que aquellos tumores con 1 mitosis por campo (aumento de 10 HPF) y con ligera anaplasia celular o 1 mitosis por campo (aumento de 20 HPF) con moderada anaplasia celular pueden ser sugestivos de un tumor con un curso clínico maligno.18 En la actualidad no se puede predecir con certeza el comportamiento de un hemangiopericitoma, ya que su comportamiento clínico depende del examen histológico en donde se puede evidenciar la presencia de atipia celular, necrosis y/o actividad mitótica.14
Los criterios de malignidad propuestos por Enzinger y Smith en el HPC identifican las lesiones de alto grado como lesiones de gran tamaño (> 5 cm), con incrementado número de mitosis (≥ 4 MF/10 HPF), alta celularidad, presencia de células tumorales inmaduras y pleomórficas, focos de hemorragia y necrosis las que tienen curso altamente maligno.17 Enzinger y Weiss emplearon el término “bajo potencial maligno” para las lesiones con niveles bajos de actividad mitótica (1-3 MF/10 HPF), particularmente si tienen algún grado de atipia y celularidad. De los tumores borderline el 37,5 % presentaron metástasis, de los 32 tumores malignos el 78 % metastizaron, mientras que los tumores benignos ninguno dio metástasis. La recurrencia tumoral local implica mal pronóstico de vida ya que precede a las metástasis (11 de 17 pacientes) siendo los sitios más comunes a nivel pulmonar, hepático y tejido óseo.11
De acuerdo a la clasificación de tumores de tejidos blandos y hueso determinada por la OMS, el término hemangiopericitoma es usado para referirse a una variedad de tumores, los cuales tienen en común la presencia de un patrón vascular con delgadas ramificaciones y áreas celulares que semejan un tumor fibroso solitario. En los últimos 10 años, numerosas entidades han escapado a la definición de HPC, los cuales ahora son reconocidos como células o formas malignas de lo sarcomas de tejidos blandos.5)
Más del 15 % de las neoplasias de tejidos blandos muestran características histopatológicas y patrón de crecimiento similares al HPC, al menos focalmente. En el diagnóstico diferencial se deben tomar en cuenta los sarcomas más comunes como el histiocitoma fibroso maligno, sarcoma sinovial, liposarcoma y particularmente el tumor fibroso solitario que implica un particular problema debido a las características histopatológicas que comparten.25
Clínicamente se presenta como una masa con crecimiento indoloro. El comportamiento indolente de los HPC aumenta la necesidad de un diagnóstico precoz, que a menudo se basa en un examen patológico o en modalidades de imagen en menor medida.13 Los síntomas específicos se asocian con la localización del tumor, están relacionados a la presión que produce el tumor sobre las estructuras adyacentes.16 El dolor es un síntoma tardío, se presenta en el 96 % de los pacientes y se asocia a un importante crecimiento de la neoplasia. Por lo tanto, en la práctica clínica, el HPC frecuentemente se diagnostica por exclusión.
La clasificación de tumores de la OMS de 2016 propone adherirse a un esquema de tres niveles. Los tumores hipocelulares, colagenizados con baja actividad mitótica se designan como grado I, mientras que más tumores celulares se clasifican como II o III, según el recuento mitótico.13
Radiológicamente el tumor es usualmente bien circunscrito, con densidad de tejido blando, radiopaco, muy vascularizado, que resalta con las estructuras circundantes.18) La tomografía contrastada y la arteriografía no muestran características específicas para el diagnóstico de HPC; sin embargo, permiten ver una importante vascularidad del tumor, las lesiones se presentan densas, bien circunscritas debido al acumulo de medio de contraste en los delicados vasos capilares, mientras que la Resonancia Magnética Nuclear revela una masa sólida isodensa en T1.18) El HPC típicamente se muestra como materia gris isointensa a cortical tanto en T1WI como en T2WI16.13
El tratamiento de elección es la resección quirúrgica completa, si es posible, lo que constituye el mejor factor predictivo, ya que con una resección tumoral incompleta existe riesgo elevado de recurrencia local que puede ir desde 8 hasta 53 %.11 La resección quirúrgica se puede ver complicada por hemorragia debido a la marcada dilatación del lecho vascular en la vecindad de la neoplasia. Por lo tanto, la embolización preoperatoria puede ser un adyuvante para la disminuir la vascularidad y el tamaño del tumor y así reducir el sangrado intraoperatorio.
Espatet y otros en el año 2002 reportaron una tasa de sobrevida a 2 y 5 años del 93 % y 80 % respectivamente para el HPC clásico.18) Se pudo notar que todos los pacientes que tuvieron una resección quirúrgica completa estuvieron vivos dentro de los 5 años posteriores a la cirugía. Además, la sobrevida libre de enfermedad fue significativamente más alta, con tasas muy bajas de recurrencia local en tumores localizados en extremidades versus meníngeas y retroperitoneales.
El uso de radioterapia (RT) como tratamiento inicial no es adecuada, su papel como adyuvante es controversial pero se recomienda en los casos en donde la extirpación quirúrgica ha sido incompleta.13,26) La RT con efecto paliativo se recomienda en dosis mayores de 50 G y en tumores irresecables.
La quimioterapia puede ser útil para la reducción tumoral preoperatoria y puede tener efecto paliativo ante lesiones irresecables y/o ante la presencia de enfermedad metastásica.13 Entre las sustancias que con mayor frecuencia se emplean está el Methotrexate, Ciclofosfamida, Vincristina y Adriamicina.27 Es importante destacar que el uso de Adriamicina se asoció con la remisión de la enfermedad en aproximadamente el 50 % de los pacientes.28
Se han informado varias quimioterapias para HPC. Estos regímenes quimioterapéuticos se pueden dividir en tres grupos. Una es la quimioterapia tradicional con agentes citotóxicos para el sarcoma de tejidos blandos, como la Doxorrubicina, la Ifosfamida y los Taxanos. Otro es el uso de anticuerpos monoclonales como Bevacizumab o Temozolomida + Bevacizumab. El tercero son los inhibidores de la tirosina quinasa que incluyen Pazopanib, Sorafenib y Sunitinib. La terapia con Temozolomida + bevacizumab (TMZ+Bev) es segura, eficaz y puede continuarse a largo plazo; sin embargo, se debe establecer una estrategia de tratamiento optimizada para HPC.29
Curiosamente, la quimioterapia adyuvante o la radioterapia combinada con la cirugía no mejoraron los resultados en comparación con la cirugía. Se necesitan estudios multicéntricos en el futuro para evaluar la utilidad clínica de la quimioterapia y la radioterapia en el HPC.
Spitz y otros refieren que el HPC con características histopatológicas de bajo riesgo posee una baja mortalidad asociada, mientras que los tumores malignos tienen resultados más variables. En su reporte, aproximadamente la mitad de los pacientes tuvieron una curación total después de la resección quirúrgica, mientras que los restantes desarrollaron recurrencia local, metástasis o ambos.30
La vigilancia es importante en estos pacientes porque se han evidenciado metástasis en un 11 % de tumores malignos y 7 % en los tumores borderline en los 5 años posteriores al tratamiento. La recurrencia tumoral implica mal pronóstico de vida, ya que precede a la aparición de metástasis. El sitio más frecuente de metástasis son los pulmones seguido de huesos e hígado. Sin embargo, predecir la conducta clínica de este tumor después de la resección tumoral inicial y determinar el tratamiento adecuado para la enfermedad recurrente y los tumores metastásicos puede ser difícil.31
Conclusiones
El hemangiopericitoma es un tumor poco común de los tejidos blandos del cuello. Su potencial maligno es desconocido, ya que no existen en la actualidad factores histopatológicos que puedan predecir la historia natural del tumor. Sin embargo, aquellos tumores que tienen bajo grado de malignidad pueden ser controlados, en lo posible, de acuerdo a su localización y tamaño, mediante resección completa; mientras que los tumores de alto grado pueden recurrir y dar metástasis aún con la aplicación de tratamientos multidisciplinarios. El presente caso clínico demostró la importancia de tener en cuenta una sospecha diagnóstica de HPC al hacer el diagnóstico diferencial de sarcomas o linfomas principalmente. En nuestro paciente las características histopatológicas del tumor muestran invasión capsular lo que puede condicionar un incrementado riesgo para recurrencia local, por lo que se decidió tratamiento adyuvante con radioterapia. Sin embargo, el paciente se mantiene sin recurrencia tumoral local y a distancia después de 9 años de vigilancia, ya que no se pudo precisar la conducta tumoral debido a la falta de evidencia en determinar los factores pronósticos aceptados mundialmente.