Introducción
El cáncer colorrectal constituye un problema de salud a nivel mundial, ya que representa el tercer lugar en orden de frecuencia en el hombre y el segundo en la mujer, además de ser la tercera causa de muerte en ambos sexos y ser la afección maligna más frecuente del sistema digestivo.1
El tratamiento quirúrgico es, todavía en la actualidad, la principal opción terapéutica en el cáncer colorrectal, con intención curativa en 80 % de los casos. En pacientes con tumores avanzados (20 %) se suele recurrir también al tratamiento quirúrgico con fines paliativos, para mejorar la calidad de vida, enlentecer o detener la progresión de la enfermedad y mejorar los síntomas relacionados con el tumor y las metástasis.2
La Microcirugía Transanal Endoscópica, más conocida por sus siglas anglosajonas TEM (Transanal Endoscopic Microsurgery), es una técnica quirúrgica endoluminal, mínimamente invasiva desarrollada por Buess3 en la década de los 80 para la extirpación local de los tumores rectales. Inicialmente fue utilizada en el tratamiento de los adenomas del recto no resecables endoscópicamente; sin embargo, cuando se estableció que la metástasis en los ganglios linfáticos en los cánceres T1 con favorable histología era baja, la conducta de realizar la TEM para estos tumores fue aceptada. Es una técnica de escisión local que permite a los cirujanos llevar a cabo una resección total con gran precisión y se ha convertido en el tratamiento estándar de los grandes adenomas rectales y del cáncer de recto en etapas tempranas (T1N0).4,5,6,7
La utilización de la TEM como tratamiento del cáncer del recto en estadios más avanzados (T2N0, T3N0) es controversial; sin embargo, con el uso rutinario del tratamiento neoadyuvante es una opción atractiva que se ha comenzado a considerar y así lo demuestran varios estudios publicados.5,8,9,10,11,12,13,14
En Cuba, la TEM fue introducida en el año 2004 por el doctor Ricardo Torres Bermúdez en cooperación con el profesor Gerhard Buess en el Centro de Cirugía Endoscópica, actualmente Centro Nacional de Cirugía de Mínimo Acceso (CNCMA).
El objetivo de este estudio fue evaluar los resultados de la microcirugía transanal endoscópica para el tratamiento del cáncer del recto en el Centro Nacional de Cirugía de Mínimo Acceso.
Métodos
Se realizó un estudio retrospectivo de una base de datos prospectiva en el período comprendido entre abril de 2004 y diciembre 2022 en el CNCMA de La Habana, Cuba. Este es un centro de referencia nacional para la cirugía laparoscópica y la terapéutica endoscópica. Todos los procedimientos fueron realizados por el mismo equipo quirúrgico y de todos los pacientes se obtuvo su consentimiento informado antes de realizarse el proceder. El estudio fue aprobado por el comité de ética de la investigación de la institución y acorde con la Declaración de Helsinki.15
De un total de 285 pacientes (universo) que fueron sometidos a la técnica de TEM entre abril de 2004 y diciembre de 2022, se incluyeron en el estudio 150 pacientes (muestra) que cumplieron con los criterios de selección.
Los criterios de inclusión fueron los siguientes: pacientes con adenocarcinomas del recto cT1N0M0 de bajo riesgo, cT2N0M0 de bajo riesgo después de respuesta completa o parcial al tratamiento neoadyuvante y que rechazaron la cirugía radical, y cT3N0M0 de bajo riesgo luego de respuesta clínica completa al tratamiento neoadyuvante. Se consideró bajo riesgo a los adenocarcinomas bien y moderadamente diferenciados menores de 4 cm de diámetro, que ocuparan menos del 30 % de la circunferencia del recto y que estuvieran localizados en zona del recto extraperitoneal que permitiera resección total de las paredes del recto. Se incluyeron los pacientes clasificados ASA I, II y III (American Society of Anesthesiologists).
Los criterios de exclusión fueron: tumores que ocupaban toda la circunferencia del recto, adenocarcinomas cT1-2-3N0M0 alto riesgo (pobremente diferenciados e indiferenciados), cT3N0M0 con respuesta parcial o pobre respuesta al tratamiento neoadyuvante, pacientes con adenocarcinomas cT4N0M0, los pacientes con metástasis a distancia, los pacientes con tumores mayores de 4 cm localizados en zona del recto intraperitoneal y los pacientes clasificados ASA IV que fueron sometidos al procedimiento con intención paliativa.
Las variables estudiadas fueron: edad, sexo, indicación, tiempo quirúrgico, localización con relación al margen anal, tamaño tumoral, conversión, estancia hospitalaria, complicaciones posoperatorias, mortalidad, recidiva local, metástasis a distancia, supervivencia libre de enfermedad y supervivencia global. En el caso del tiempo quirúrgico, se consideró el lapso que medió entre la entrada del rectoscopio hasta la terminación de la sutura. La localización se definió como la distancia entre el margen anal y el borde inferior del tumor. Se consideraron como complicaciones, la rectorragia y la dehiscencia de sutura, solo en aquellos casos que requirieron reingreso o reintervención. En el caso de las complicaciones, se usó la clasificación de Clavien-Dindo (CI-D) y el índice de severidad de las complicaciones conocido como Comprehensive Complication Index (CCI).16,17,18
En la evaluación preoperatoria se tuvieron en cuenta los antecedentes del paciente, los síntomas, el examen físico con tacto rectal, rectoscopia rígida, colonoscopia con biopsia multifocal y ultrasonido endoscópico. En el caso de los adenocarcinomas cT3N0M0 recibieron tratamiento con radioterapia de ciclo largo (1,80-2,50 Gy por fracción, 5 fracciones por semana para un total de 45,00 Gy en 4-5 semanas) y quimioterapia con 5-FU, mientras que en el caso de los cT2N0M0 se utilizó el tratamiento neoadyuvante solo en los pacientes que rechazaron la cirugía radical. Todos los pacientes completaron dicho tratamiento neoadyuvante. La evaluación de la respuesta al tratamiento neoadyuvante se realizó a las 6 semanas de la última sesión de radioterapia mediante ultrasonido endoscópico con elastografía. En nuestro hospital no contamos con resonancia magnética.
Se estableció como respuesta clínica parcial en los casos donde el tumor disminuyó un 50 % o más en relación con el tamaño previo al tratamiento neoadyuvante. Se consideraron los siguientes criterios endoscópicos para respuesta clínica completa al tratamiento neoadyuvante: ausencia de lesión en el área previa donde se encontraba el tumor con la presencia de un área blanquecina cicatrizal, presencia de telangiectasias observadas en la mucosa rectal en el área que anteriormente albergaba el cáncer primario y la pérdida de flexibilidad de la pared rectal que alberga la cicatriz observada durante las insuflaciones manuales en la proctoscopia con ligera rigidez de la misma.19 En todos estos casos se realizó biopsia para estudio histológico. En el caso de la respuesta patológica completa se tuvo en cuenta la clasificación recomendada por la AJCC Cancer Staging Manual y la CAP Guidelines modificada por Ryan y otros.20
El procedimiento quirúrgico fue realizado en estos casos entre 8 y 12 semanas después de terminada la última sesión de radioterapia. En el preoperatorio, los pacientes fueron sometidos a preparación mecánica del colon que consistió en restricción dietética (dos días previos a la cirugía) y enemas (en la noche antes y en la mañana del proceder), sin preparados orales para no contaminar el campo operatorio con heces líquidas. Se administraron antibióticos profilácticos perioperatorios establecidos para cirugía colorrectal (cefalosporina y metronidazol).
Técnica quirúrgica
El protocolo de anestesia fue uniforme en todos los pacientes utilizando anestesia general endotraqueal.
Se utilizaron los equipos 3-D (TEM) (Richard Wolf GMBH, Knittlingen, Germany) y 2-D high-definition (TEO) (Karl Storz GMBH, Tütlingen, Germany), con sus respectivos brazos de fijación de los rectoscopios e instrumentales específicos. El diámetro de los rectoscopios es de 40 mm (límite óptimo para la dilatación anal) y los instrumentos son utilizados según los principios de la técnica quirúrgica descrita por Buess.21)
El paciente se colocó acorde a la localización del tumor en decúbito supino, prono, lateral derecho o lateral izquierdo. Se realizó la resección total de la pared del recto en todos los pacientes y el defecto se cerró en todos los casos con sutura continua de material monofilamento absorbible a largo plazo. La lesión fue resecada sin fragmentación y enviada íntegramente al patólogo extendida y fijada.
Posoperatorio
Los pacientes comenzaron a ingerir líquidos a las 6 h después de la cirugía y sólidos al comenzar a expulsar gases por el recto. El manejo del dolor se realizó según las pautas del protocolo establecido por la institución, y el catéter intravenoso fue retirado una vez que el paciente toleró la vía oral y no necesitó medicación por esa vía. Los pacientes fueron dados de alta del hospital cuando toleraron la vía oral, existió un control del dolor y se restablecieron las funciones intestinales. El seguimiento de los pacientes después de realizada la TEM fue de cada 3 meses el primer año, cada 6 meses el segundo año y luego anual por 5 años según lo pautado en las normas oncológicas internacionales. La evaluación consistió en el examen físico, rectoscopia rígida, colonoscopia, tomografía axial computarizada (TAC) y ultrasonido endoscópico. En caso de encontrar alguna anomalía en la zona de resección se tomó biopsia para estudio anatomopatológico.
La cirugía radical de rescate fue realizada en los pacientes con cT2 y cT3, en los cuales no hubo evidencia de regresión tumoral con la neoadyuvancia, los pacientes con respuesta completa que presentaron un ypT2 después de TEM, los pacientes con ypT3 después de TEM y en los pacientes con recidiva local durante el período de seguimiento. En todos los casos se realizó la escisión total del mesorrecto (ETM) por vía laparoscópica.
La información se recogió en las planillas de recolección de datos y en una base de datos confeccionadas para tal efecto. Todos los datos fueron recolectados de la base de datos y analizada con el paquete estadístico IBM SPSS (software versión 21 para Windows). Se emplearon medidas de resumen para datos cualitativos y cuantitativos (cifras absolutas, porciento, media) para lograr una mejor interpretación de los resultados. En la estimación de las supervivencias se utilizaron curvas construidas mediante el método de Kaplan Meier. Se realizó una revisión bibliográfica del tema en las bases de datos MEDLINE, EMBASE, BVS-BIREME y la biblioteca Cochrane con el objetivo de comparar nuestra técnica y sus resultados con los presentados en la literatura.
Resultados
Las indicaciones de microcirugía transanal endoscópica son presentadas en la tabla 1. La principal indicación de TEM fue el adenocarcinoma del recto cT1N0M0 con 57 pacientes (38 %).
Tabla 1 . Indicaciones de Microcirugía Transanal Endoscópica. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba. Abril 2004-diciembre 2022
|
|
% | |
|---|---|---|
| Adenocarcinoma del recto cT1 | 57 | 38 % |
|
Adenocarcinoma del recto cT2 (después de tratamiento neoadyuvante) |
39 | 26 % |
| Respuesta completa | 9 | 23,1 % |
| Respuesta parcial | 30 | 76,9 % |
| Adenocarcinoma del recto T3 (con respuesta completa al tratamiento neoadyuvante) | 54 | 36 % |
| ypT0 | 35 | 64,8 % |
| ypT1 | 7 | 13 % |
| ypT2 | 7 | 13 % |
| ypT3 | 5 | 9,2 % |
| Total | 150 | 100 % |
Fuente: Historias clínicas.
Se observó la mayor frecuencia en el sexo femenino con 90 (60 %) pacientes. La edad media fue de 63 años (rango 32-93), el tamaño tumoral 2,8 cm (rango 1-4), la distancia del tumor con respecto al margen anal de 7,8 cm (rango 4-15) y la posición más frecuente del tumor en la pared rectal fue en la posterior (55 %) seguido de la anterior (18 %). La media del tiempo quirúrgico que fue de 76 minutos (rango 25-240) y la estancia hospitalaria de 1 día (rango 12 horas-7 días). En el caso de los pacientes con más de un día de estancia hospitalaria siempre estuvieron asociados a la aparición de complicaciones.
La morbilidad fue de 6,7 % (10/150) y el 70 % de las complicaciones se observó en los pacientes que recibieron tratamiento neoadyuvante. Dentro de estas complicaciones posoperatorias se encuentran tres sangramientos, de los cuales dos solo requirieron ingreso y tratamiento médico, que estuvieron asociados a dehiscencias parciales de la sutura en zona extraperitoneal ocurrida al quinto día del posoperatorio en pacientes sometidos a radioquimioterapia neoadyuvante. El otro sangramiento rectal fue tratado con terapéutica endoscópica. De las dehiscencias de sutura, una fue en la zona intraperitoneal que se necesitó reintervención con colostomía tipo Hartmann y la otra en zona extraperitoneal que requirió reingreso y tratamiento médico. Los abscesos perirrectales drenaron espontáneamente necesitando solo reingreso y tratamiento médico sin llevarse a cabo tratamiento quirúrgico.
La fístula rectovaginal resolvió con colostomía derivativa y la estenosis con dilatación endoscópica (tabla 2). Ningún paciente requirió conversión a cirugía laparoscópica o cirugía abierta. Un paciente (0,7 %) murió a los 10 días del posoperatorio por complicaciones derivadas de una reintervención por dehiscencia de sutura a zona intraperitoneal. El índice de reintervención fue de 2,7 % (4/150) y los abordajes fueron dos laparoscópicos y dos endoscópicos.
En cuanto a la clasificación de las complicaciones según su severidad, 3 (2 %) pacientes presentaron serias complicaciones (Cl-D grado III) mientras que un paciente (0,7 %) murió al presentar dehiscencia de sutura intraperitoneal, falleciendo a los 10 días del postoperatorio, por insuficiencia cardiopulmonar (Cl-D grado V). Solo este paciente presentó más de una complicación por lo que es el único que se incluyó en la clasificación según grado de severidad CCI (tabla 2).
Tabla 2 . Morbilidad y mortalidad. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba. Abril 2004-diciembre 2022
| Dehiscencia de sutura y sangramiento rectal | 2 | CI-D grado II |
| Dehiscencia de sutura (zona extraperitoneal) | 2 | CI-D grado II |
| Absceso perirrectal | 2 | CI-D grado II |
| Sangramiento rectal | 1 | CI-D grado IIIa |
| Dehiscencia de sutura (zona intraperitoneal) | 1 | CI-D grado V |
| Fístula rectovaginal | 1 | CI-D grado IIIb |
| Estenosis | 1 | CI-D grado IIIa |
| Mortalidad (%) | 1 (0,7 %) | |
Fuente: Historias clínicas.
En cuanto a los resultados anatomopatológicos, en el caso de los adenocarcinomas T1, en 5 pacientes el resultado histológico posoperatorio fue adenocarcinoma T2. En el grupo de pacientes con adenocarcinoma T2 en 5 pacientes el resultado histológico fue adenocarcinoma T3. Teniendo en cuenta el total de pacientes con tumores cT3N0 tratados con neoadyuvancia, se obtuvo un 23,6 % de respuesta clínica completa. En los adenocarcinomas T3 del estudio, a pesar de que 54 pacientes presentaron respuesta clínica completa, en el 35,2 % de los pacientes se encontró tumor en la pieza quirúrgica (7 ypT1, 7 ypT2 y 5 ypT3). La respuesta patológica completa se presentó en el 64,8 % (35 ypT0). En general se realizaron 22 cirugías radicales de rescate posterior a TEM, 5, 5 y 12 en los grupos de adenocarcinoma T1, T2 y T3 respectivamente.
Después de una media de seguimiento de 101 meses (rango 4-216), 8 (6,1 %) pacientes presentaron recidiva local y 4 (3 %) metástasis a distancia. En lo que respecta a la recidiva local, 3 (8,2 %), 3 (7,1 %) y 1 (2,5 %) pacientes recidivaron en los grupos adenocarcinoma T1, T2 y T3 respectivamente.
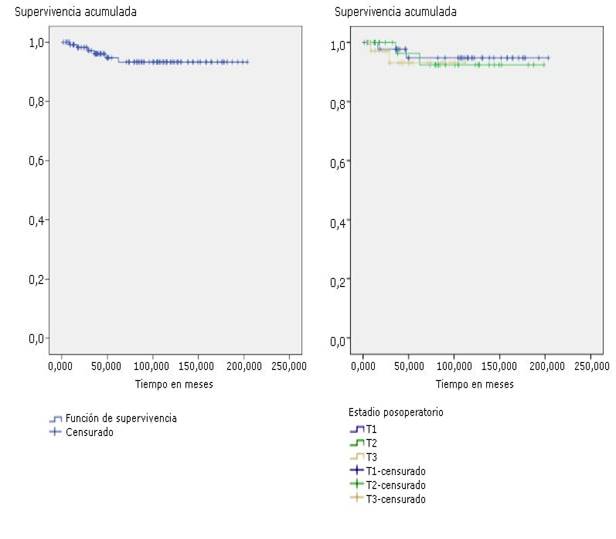
La supervivencia global a los 5 años de este estudio fue 97,5 % mientras que por estadios de 94,5 %, 93,8 % y 91,3 % en los adenocarcinomas T1, T2 y T3 respectivamente (fig. 1). En el caso de la supervivencia libre de enfermedad mostrada, los resultados fueron de 95,5 % a los 3 y 5 años. Por estadios se comportó de la siguiente manera: T1 de 95,5 %, T2 de 93,3 %, mientras que el T3 de 94,5 % a los 3 años y 5 años.
Discusión
La regla de oro en la cirugía oncológica de los tumores malignos del recto es conseguir primariamente el mayor control del cáncer y secundariamente preservar la función y la calidad de vida del paciente. La ETM representa el mejor tratamiento curativo, con muy bajos índices de recidiva local reportado después de tratamiento neoadyuvante.10 Sin embargo, tanto la resección anterior del recto (RAR) como la resección abdominoperineal (RAP) están asociadas con altos índices de disfunciones genitourinarias y sexuales (30-40 %), fugas anastomóticas (5-17 %) y trastornos funcionales intestinales a largo plazo.22,23) Hasta un 40 % de los pacientes presentan complicaciones de la herida perineal; las complicaciones relacionadas con la colostomía ocurren hasta en un 66 %, mientras que las asociadas con los cambios en los estilos de vida y la depresión suceden en un 30 %.10,24,25) Es por ello que en la actualidad, la resección local en casos muy seleccionados de pacientes con cáncer del recto es mundialmente aceptada.26,27,28
La elección de nuestro grupo de realizar las resecciones transanales endoscópicas sin prejuicio del tipo de equipamiento se sostiene en los resultados de un estudio aleatorizado y controlado entre el uso de equipos 3D-TEM (Richard Wolf GMBH, Knittlingen, Germany) y el sistema 2-D high-definition-TEO (Karl Storz GMBH,Tütlingen, Germany), en el que no se encontró diferencias significativas, en los resultados técnicos y clínicos de las resecciones endoscópicas transanales; sin embargo, el estudio sí encontró diferencias en el costo, siendo menor cuando es utilizando el equipamiento del TEO-Storz.29) La disposición de ambos equipos en nuestra unidad quirúrgica facilitó su uso alternativo por nuestro grupo de trabajo sin que los costos fueran un condicionante; sin embargo, sí consideramos más confortable la imagen estereoscópica que tiene el cirujano cuando se trabaja con el equipo TEM, Richard Wolf GMBH. En nuestra opinión estas desventajas del Sistema 2-D (TEO) se pueden suplir de alguna manera con las nuevas plataformas de trabajo que incluyen la tecnología 3D.
Para un adecuado tratamiento de los tumores malignos utilizando la TEM, estos deben estar localizados en la zona extraperitoneal del recto, que es hasta 20 cm por la pared posterior, 15 cm en las laterales y 12 cm en la pared anterior del margen anal, aunque esto puede variar según sexo y constitución física del paciente. En solo esa zona se puede realizar la técnica de resección total de la pared del recto. La resección total de la pared del recto por encima de esos márgenes implica el riesgo de apertura a la cavidad abdominal con la respectiva contaminación de esta y la pérdida del campo operatorio.5
Se plantea que la TEM presenta una morbilidad baja. Diversos autores reportan cifras entre 7,7-31,4 % en dependencia de la clasificación que se utilice para delimitar las complicaciones.17,30,31
Las complicaciones perioperatorias más frecuentes son la hemorragia y la perforación peritoneal. Esta última es más común en los tumores del recto superior, especialmente localizados en las paredes anterior y laterales, por lo que se consideran a estas localizaciones como contraindicación para la realización de esta técnica.5,7,17,30,31,32 Las posoperatorias incluyen: hemorragia (1-13 %), infección, absceso perirrectal, dehiscencia de sutura, fístula rectovaginal, estenosis rectal, incontinencia fecal temporal y retención urinaria.32 La complicación más frecuente de la TEM después de tratamiento neoadyuvante es la dehiscencia de sutura en la zona extraperitoneal.30,33,34
Marks y otros33 en un estudio retrospectivo en 43 pacientes con cáncer del recto tratado mediante TEM después de terapia neoadyuvante, tuvieron un 25,6 % de complicaciones relacionadas con la sutura del recto, mientras que Pérez y otros34 reportaron cifras de dehiscencia de la línea de sutura y de reingresos hospitalarios de un 60,9 % y 43,5 % respectivamente. Serra y otros,31 en un estudio que analizó la morbilidad después de TEM y los factores de riesgo de aparición de complicaciones posoperatorias, reportaron un índice de morbilidad clínicamente relevante de 5,6 % (Cl-D > grado II) y una mortalidad 0,3 %, muy similar a los resultados obtenidos en este estudio. Estos autores no consideran el evento de dehiscencia de sutura como una complicación; no obstante, plantean que sus consecuencias tales como el sangramiento rectal y la sepsis local deben ser monitoreadas. En el caso de nuestro estudio, a pesar de que se realizó solo en pacientes con cáncer y sometidos la gran mayoría de los pacientes a tratamiento neoadyuvante, el índice de complicaciones fue bajo.
La resección local de los cánceres del recto con intención curativa es todavía un tema en debate. La capacidad curativa de esta depende de la invasión linfática. El riesgo de posibles ganglios linfáticos metastásicos es de 0-12 % en los tumores T1, entre 12 y 28 % en los tumores T2 y de 36 a 79 % en los T3.34 El uso de la TEM en el cáncer de recto con intención curativa está limitado a pacientes con adenocarcinoma de recto T1 de bajo riesgo, definido como: pequeño (menor de 3 cm), bien o moderadamente diferenciado (G1 o G2 respectivamente), sin invasión vascular, linfática o perineural, localizados a menos de 8 cm del margen anal, que ocupe menos de un tercio de la circunferencia del recto.6,36,37,38 Se sugiere que no todos los tumores T1 pueden ser tratados de la misma manera, estableciendo una clasificación dentro de esta etapa según el grado de invasión de la submucosa. De esta forma, se clasifica T1sm1 a los tumores que invaden hasta el tercio superior de la submucosa; T1sm2 si invade hasta el tercio medio y T1sm3 aquellos que infiltran hasta el tercio inferior de esta capa de la pared intestinal. La incidencia de metástasis a ganglios linfáticos en los T1sm1 es muy baja (0-3 %), pero aumenta a 15 % en los T1sm2-3.6 En este estudio el índice de recidiva local para los T1N0 de manera general (sin subdividirlos en los sm1-2-3) fue de 6,1 %, lo que se corresponde con lo esperado en este tipo de pacientes con adenocarcinoma T1 de bajo riesgo.35,36,37,38 Esto enfatiza la importancia de una adecuada selección de los pacientes para la resección local del cáncer del recto.39,40
En varios estudios se plantea que la TEM es segura y efectiva para los pacientes con adenocarcinoma del recto T2N0 de bajo riesgo después de tratamiento neoadyuvante y en los T3N0 de bajo riesgo después de respuesta completa al tratamiento neoadyuvante. En el caso de los T2 se plantea que está indicada en la respuesta completa al tratamiento neoadyuvante y también en la respuesta parcial, pero en aquellos pacientes con comorbilidades y que rechacen una cirugía radical.5,8,10,11,12,13,14,21,39,41,42)
García-Aguilar43 presentó los resultados de American College of Surgeons Oncology Group (ACOSOG) de un ensayo clínico en fase II aplicando tratamiento neoadyuvante a pacientes con T2N0 obteniendo 44 % de respuesta completa y 64 % de respuesta parcial.
En 1998 Habr Gama y otros44 plantearon que los pacientes con respuesta clínica completa después del tratamiento neoadyuvante podían mantenerse en observación solamente. En ese estudio de 118 pacientes los resultados mostraron un 30,5 % de respuesta completa al tratamiento neoadyuvante y en un seguimiento de 36 meses, el 26,2 % de los pacientes no requirieron tratamiento quirúrgico y al 38,1 % se le pudo realizar cirugía conservadora de esfínteres una vez diagnosticado el cáncer del recto, pero reportan altos índices de recrecimiento tumoral durante el primer año de seguimiento. A este protocolo le siguió un ensayo clínico45) y en la actualidad existe una base de datos internacional llamada International Watch and Wait Database (IWWD).46 En opinión del colectivo de autores este protocolo exige un estricto cumplimiento del seguimiento de los pacientes y se necesita de uniformidad en los criterios de selección de los mismos que se ajusten por igual a todos los lugares donde se aplique. Además, en los resultados de nuestro estudio se puede observar que en los pacientes con adenocarcinoma T3 y respuesta clínica completa al tratamiento neoadyuvante, en 35,2 % se comprobó tumor en los resultados anatomopatológicos después de la TEM y de ellos el 22,2 % con adenocarcinomas ypT2-3. Si a estos pacientes se les hubiera aplicado el protocolo de observar solamente, hubieran presentado un 35,2 % de recrecimiento debido a la persistencia tumoral.
Los índices de recidiva local en los pacientes con respuesta clínica completa después del tratamiento neoadyuvante, están relacionados con la respuesta patológica completa, siendo en ypT0 (0-1 %) y en ypT1 (2 %), mientras ypT2 está asociado con un incremento de la misma 6-20 %.41
La TEM permite, al resecar la cicatriz postradioquimioterapia con un margen circunferencial de 1 cm, un adecuado estudio histológico para confirmar la respuesta patológica completa. Los índices de recidiva local después de la TEM son 6-15 %.41,47,48,49 Borschitz y otros41 incluyeron siete estudios y 237 pacientes, observando que en el grupo de respuesta patológica completa ypT0, la recidiva local fue de 0 % y la recidiva a distancia de 4 %, en los tumores ypT1, la recidiva local de 2 % y la recidiva a distancia de 7 %, en los tumores ypT2 ambas fueron de 7 %, mientras que en los tumores ypT3, la recidiva local fue de 21 % y la recidiva a distancia de 12 %. Smart y otros47 reportan cuatro recidivas locales todas en los tumores ypT2. Es por ello que en nuestra opinión, la TEM puede considerarse como una opción de tratamiento definitivo en pacientes con ypT0-1, mientras los pacientes con ypT2-3 deben ser tratados con cirugía radical de rescate. Es por ello que mantenemos como otros autores11,12,26,27,30,35,50,51,52,53 el uso de la TEM en estos pacientes y solo en casos muy seleccionados aplicamos el protocolo Watch and Wait.
Recientemente, Rullier y otros54 realizaron un estudio multicéntrico aleatorizado (GRECCAR 2) donde compararon le escisión local (EL) con la ETM en los pacientes con cáncer del recto bajo y respuesta al tratamiento neoadyuvante. Ellos concluyeron que no existió superioridad de la EL sobre la ETM porque en el grupo de la EL, 26 (35,1 %) pacientes tuvieron que ser sometidos a cirugía radical de rescate y 41 (56 %) pacientes tuvieron uno o más eventos de morbilidad, recurrencia o muerte. En nuestro estudio, de los pacientes que se sometieron a tratamiento neoadyuvante seguido de TEM, se le realizó cirugía radical al 18,6 % (17/91) de los pacientes y el 13,2 % (12/91) de ellos, presentaron uno o más eventos de morbilidad, recurrencia o muerte, lo que sí muestra superioridad del TEM en este caso.
Una de las desventajas que se le atribuye a la TEM en estos pacientes es que se asocia a un incremento de los índices de resección abdominoperineal, reintervención e incompleta escisión mesorrectal al realizarse cirugía radical de rescate posterior a la TEM.52,55,56 Sin embargo, diversos estudios plantean que los resultados oncológicos a largo plazo no se ven comprometidos en estos pacientes.57,58,59
La supervivencia global y libre de enfermedad de los diferentes estadios encontrada en este estudio es similar a la reportada por otros autores,26,28,52,60,61 quienes reportan cifras de supervivencia libre de recidiva local y de supervivencia libre de enfermedad de 96,9 % y 91 %, respectivamente, sin diferencias significativas en términos de supervivencia global y libre de enfermedad al compararse con el grupo de escisión total mesorrectal.28,52,60
En años recientes, la TEM vía natural orifice transluminal endoscopic surgery (NOTES) ha sido usada para ganar el acceso a la cavidad peritoneal y realizar procedimientos intraabdominales. En la actualidad la escisión total del mesorrecto transanal mediante la TEM/TEO es una realidad en el área clínica y está jugando un importante papel, al igual que la cirugía mínimamente invasiva transanal, como técnica de aplicación universal en el tratamiento del cáncer del recto.62,63,64,65,66,67,68
Conclusiones
Según estos resultados, la TEM es una técnica factible y segura en el tratamiento de los adenocarcinomas T1 de bajo riesgo, mientras que en los T2 y T3 después de respuesta al tratamiento neoadyuvante, nuestros resultados muestran que, en pacientes seleccionados, no existen diferencias significativas en términos de recidiva local, supervivencia libre de enfermedad ni supervivencia global, al compararla con la cirugía radical según lo reportado en la literatura. El cáncer del recto localmente avanzado tratado mediante organ-preserving intention después de tratamiento neoadyuvante, todavía es un tema de controversia. Nuestro estudio tuvo la finalidad de aportar nuevos conocimientos al tema utilizando una técnica estandarizada de TEM en los pacientes con cáncer del recto y evaluando sus resultados a largo plazo con una media de seguimiento de 101 meses. Nuestro mayor aporte se centra en los resultados del uso de TEM en los pacientes después de tratamiento neoadyuvante, específicamente los que presentan respuesta clínica completa, ya que estos pacientes habitualmente son incorporados a los protocolos de Watch and Wait sin demostrarse la respuesta patológica completa.
Las limitaciones del estudio son: estudio descriptivo observacional de una base de datos prospectiva en un solo hospital y con una muestra relativamente pequeña.