Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión impresa ISSN 0034-7507
Rev Cubana Estomatol vol.48 no.3 Ciudad de La Habana jul.-set. 2011
ARTÍCULOS ORIGINALES
Parámetros inflamatorios en saliva y sangre en niños y adolescentes sanos
Inflammatory parameters in saliva and blood from healthy children and adolescents
Ninoska Tahis Viera SiritI, Thais Teresita Morales RojasII, Alejandra Isabel Morón MedinaIII, Rita Mireya Navas PerozoIV, Adriana Beatriz Pedreañez SantanaV
I Doctora en Medicina. Profesora Titular. Facultad de Odontología. Universidad de Zulia, Venezuela.
II Doctora en Estomatología. Profesora Titular. Facultad de Odontología. Universidad de Zulia, Venezuela.
III Doctora en Estomatología. Asistente. Facultad de Odontología. Universidad de Zulia, Venezuela.
IV Máster en Administración del Sector Salud. Profesora Titular. Facultad de Odontología. Universidad de Zulia, Venezuela.
V Doctora en Medicina. Facultad de Medicina. Universidad de Zulia, Venezuela.
RESUMEN
En la actualidad se ha mostrado interés en el empleo de la saliva para ser utilizada como una alternativa de diagnóstico, predicción y progresión de diversas enfermedades con relación a otros fluidos corporales. Los objetivos trazados para la realización de este trabajo fueron: correlacionar las concentraciones en saliva y sangre de IL-1, IL-6, TNF-a, sustancias reactivas al ácido tiobarbitúrico y O2- de niños y adolescentes sistémicamente sanos. Se realizó un estudio de corte transversal en 23 niños y adolescentes sanos, entre 4 y 17 años de edad. Se les realizaron evaluaciones clínicas para determinar las condiciones bucales y estudios inmunológicos con el propósito de identificar los niveles de citosinas, a través del ensayo inmunoenzimático indirecto, el O2- por método citoquímico y las sustancias reactivas al ácido tiobarbitúrico, a través del ensayo colorimétrico. Hubo diferencia significativa entre las muestras de saliva y las de sangre periférica respecto a las citosinas y sustancias reactivas al ácido tiobarbitúrico estudiadas. Los resultados fueron: IL-1 en sangre= 1,646 ± 0,13 pg/mL y de IL-1 en saliva= 552,36 ± 75,7 pg/mL; IL-6 en sangre= 3,506 ± 1,85 pg/mL, e IL-6 en saliva= 26,89 ± 9,97 pg/mL. Al analizar el TNF-a en sangre fue de 12,91 ± 3,05 pg/mL y en saliva= 43,56 ± 6,44 pg/mL, las sustancias reactivas al ácido tiobarbitúrico en sangre= 9,46 ± 3,26 nmol/mL y en saliva= 1,26 ± 0,03 nmol/mL. No se observó correlación estadísticamente significativa entre las muestras de sangre y saliva para los valores de IL-1, IL-6 y sustancias reactivas al ácido tiobarbitúrico. En cuanto al TNF-a se evidenció una correlación significativa, rs= 0,78. No se evidenciaron células positivas para el O2- en las muestras estudiadas. Los resultados del análisis de correlación obtenido entre las muestras salivales y séricas, no aportaron evidencias suficientes para sugerir que la saliva pueda ser utilizada como fluido corporal que permita sustituir la determinación sérica de IL-1, IL-6 y sustancias reactivas al ácido tiobarbitúrico. En cuanto al TNF-a se evidenció una correlación significativa, lo cual podría plantear la posible sustitución de muestras séricas por salivales.
Palabras clave: IL-1, IL-6, TNF-a, sustancias reactivas al ácido tiobarbitúrico, O2-, saliva, sangre.
ABSTRACT
At present times, there is interest in the use of saliva as a diagnosis, prediction and progression alternative of different pathologies in relation to the body fluids. To correlate the concentrations of IL-1, IL-6, TNF-a, substances reactive to thiobarbituric acid (RSTBA) and O2- in the saliva and blood of systematically healthy children and adolescents. A cross-sectional study was performed in 23 healthy children and adolescents aged from 4 to 17 underwent to clinical tests to demonstrate the oral conditions and immunological to identify the cytokine levels and the RSTBAs by colorimetry trial. There was a significant difference in saliva samples compared to that of peripheral blood in study cytokines and RSTBAs: IL-1 (blood: 1.646 ± 0.13 pg/mL, saliva: 552.36 ± 75.7 pg/mL; IL-6 (blood: 3.506 ± 1.85 pg/mL, saliva: 26.89 ± 9.97 pg/mL: TNF-a (blood: 12.91 ± 3.05 pg/mL, saliva: 43.56 ± 6.44 pg/mL), RSTBA (blood: 9.46 ± 3.26 nmol/mL, saliva: 1.26 ± 0.03 nmol/mL). There was not a statistically significant difference among blood and saliva samples for IL-1, IL-6 and RSTBA values. As regards TNF-a it was demonstrated a significant correlation, rs= 0.78. There was not evidence of cells positive to O2 in study samples. Results of correlation analysis obtained among the saliva and serum samples not offer evidences that saliva may be used as body fluid allows substituting the serum determination of IL-1, IL-6 and RSTBA. In the case of the TNF-a, there was a significant correlation, which could to propose the possible substitution of serum samples for the salivary ones.
Key words: IL-1, IL-6, TNF-a, RSTBA, O2-, saliva, blood.
INTRODUCCIÓN
La saliva es una secreción compleja proveniente de las glándulas salivales mayores en el 93 % de su volumen y de las menores en el 7 % restante. Es estéril cuando emerge de las glándulas salivales, pero deja de serlo inmediatamente cuando se mezcla con el fluido crevicular, restos de alimentos, microorganismos, células descamadas de la mucosa bucal, entre otras.1 El 99 % de la saliva es agua, mientras que el 1 % restante está constituido por moléculas orgánicas e inorgánicas.2 Existen diversas vías por las que algunos elementos que no son constituyentes habituales de la saliva pueden llegar a ella, a través de rutas intracelulares y extracelulares. Las vías intracelulares más habituales son la difusión pasiva y el transporte activo, mientras que la ultrafiltración a través de las estrechas uniones celulares, es el mecanismo extracelular más conocido.
Algunas moléculas pueden llegar a la saliva desde el suero y atravesar las barreras de los capilares, los espacios intersticiales y las membranas de las células acinares y ductales, hasta llegar a la luz de los túbulos excretores. Asimismo los componentes del suero también pueden llegar a la saliva a través del fluido crevicular. Gracias a esta posibilidad, se abre una perspectiva para su aplicación en el diagnóstico de determinadas afecciones.3 Así pues, el uso de la saliva como alternativa para el diagnóstico o como elemento para monitorear la evolución de determinadas enfermedades o la dosificación de diversos medicamentos, es una vía prometedora. Esta incrementa su atractivo para el diagnóstico, debido a que la saliva es de fácil recolección.4
Las citosinas son proteínas solubles de bajo peso molecular mediadoras del crecimiento celular, de la inflamación, la inmunidad, la diferenciación y la reparación, entre otras funciones. Ante una invasión microbiana sirven para iniciar la respuesta inflamatoria y para definir la magnitud y naturaleza de la respuesta inmunitaria específica.5 Un subgrupo de estas citocinas lo constituyen las proinflamatorias como el factor de necrosis tumoral alfa (TNF-a), la interleucina 1 (IL-1) y la interleucina 6 (IL-6), que median y modulan la activación del sistema inmune y dirigen los cambios metabólicos que se producen como consecuencia de la inflamación. El estímulo inflamatorio inicial induce la formación de una cascada de citocinas, lo que conlleva a la liberación de especies reactivas del oxígeno y del nitrógeno como el anión superóxido (O2-), óxido nítrico, peróxido de hidrógeno y finalmente el malondialdehído, entre otras sustancias reactivas al ácido tiobarbitúrico (SRATB), como uno de los productos de la peroxidación lipídica derivado de la descomposición del ácido araquidónico.6
Estudios previos7,8 han demostrado que las células epiteliales de la mucosa bucal actúan como barrera física contra la invasión de microorganismos patógenos. A su vez, presentan receptores encargados del reconocimiento de algunos componentes bacterianos, que finalmente favorecen la síntesis de moléculas de adhesión tisular y la producción de citosinas, características del proceso inflamatorio. En diversas afecciones inflamatorias, tanto las células infiltrantes, como las células propias de la cavidad bucal, son capaces de sintetizar grandes cantidades de radicales libres, en respuesta a diversos estímulos.9 Todos estos hallazgos condujeron a la realización de este estudio con el propósito de correlacionar diversos parámetros inflamatorios como TNF-a, IL-1, IL-6, O2- y SRATB, en muestras de sangre y saliva en niños y adolescentes sistémicamente sanos, para determinar el posible papel de la saliva como fluido corporal más accesible para el diagnóstico de dichos parámetros. Los estudios se iniciaron a partir de niños sanos, ya que no existe en la literatura información sobre valores de referencia.
MÉTODO
La muestra de estudio estuvo conformada por 23 niños y adolescentes, que asistieron al Centro de Atención Integral del Niño y a la Clínica de la Facultad de Odontología de la Universidad de Zulia, Venezuela, con previa evaluación clínica realizada por el pediatra. En la muestra 13 individuos fueron del sexo masculino y 10 del femenino, con un promedio de edad de 12,69 con una desviación estándar de ± 3,32 y un rango de 5 a 17 años.
Como criterios de exclusión se tuvieron: la presencia de alguna enfermedad sistémica o su sospecha, la existencia de cavidades cariosas activas, de procesos periodontales severos (IG= grado 3) o de alguna otra lesión de la mucosa bucal. Este estudio fue aprobado por el Instituto de Investigaciones de la Facultad de Odontología "Luz". Cada uno de los padres o representantes de los sujetos que participaron en el estudio, firmaron un informe de consentimiento, luego de explicarles el propósito de este. Se realizó un estudio de corte transversal, en el cual se determinaron las concentraciones de TNF-a, IL-1, IL-6, O2- y SRATB, en las muestras de saliva y de sangre, en cada uno de los individuos incluidos en el estudio.
La evaluación clínica fue realizada por un odontólogo debidamente entrenado en la detección de signos y síntomas de tejido blando en la cavidad bucal. Para realizar el examen bucal se utilizó luz halógena y un espejo bucal plano. Inicialmente fueron evaluados los tejidos blandos, se empleó gasa para separar los labios, los carrillos y la lengua, con la finalidad de observar toda la mucosa bucal. Posteriormente, se evaluó el estado gingival y se utilizó el índice gingival de Loe y Silness,10 y el estado de higiene bucal mediante los criterios del índice de placa (IP) de Silness y Loe.11 En la dentición primaria, se evaluaron los órganos dentarios: 54, 64, 74, 84, 81 y 71. En la dentición permanente se evaluaron los órganos dentarios: 16, 26, 36, 46, 31 y 41. En casos de dentición mixta en el sector anterior, los dientes temporales ya exfoliados se sustituyeron por el permanente correspondiente y en el sector posterior, se evaluaron los primeros molares permanentes.
Se tomaron muestras de 6 mL de sangre periférica, a través de la punción de la vena basílica media, luego de la asepsia de la zona en cuestión. Se utilizó el sistema VacutainerÒ sin anticoagulante. Las muestras se mantuvieron a temperatura ambiente por una hora. Luego se centrifugaron a 300 g × 10 minutos a 4 ºC. Se aspiró la fracción sérica y se dividió en cuatro alícuotas a -20 ºC hasta ser utilizadas. Las muestras salivales fueron tomadas en las primeras horas de la mañana. Se recolectaron 2 cc de saliva total no estimulada en un envase estéril, la cual fue transportada en hielo hasta el laboratorio. Las muestras se centrifugaron a 15 000 rpm durante 15 minutos a 4 °C. El sobrenadante se trasvasó a otro tubo estéril y se almacenó a -20 ºC hasta ser utilizada.
Las citocinas salivales y séricas, fueron detectadas a través del ensayo inmunoenzimático indirecto, para lo cual se utilizó el kit comercial R&D systemsÒ para determinar cuantitativamente, los niveles de citocinas presentes en estas muestras. Este método se fundamenta en la detección del antígeno presente en la muestra, cuando el anticuerpo está unido en la fase sólida. Posteriormente se le adicionó un anticuerpo marcado con una enzima y finalmente su respectivo substrato. La concentración de las citocinas se obtuvo, a través de la actividad de la enzima frente al substrato y se reportaron en picogramos por mililitro (pg/mL).
La producción de anión superóxido, se determinó a nivel de leucocitos polimorfonucleares y mononucleares mediante el método citoquímico descrito previamente por Briggs y otros.12 Este se fundamenta en la oxidación de la diaminobencidina, a un polímero osmofílico e insoluble, para lo cual las células se expusieron a un medio que contenía un inhibidor de peroxidasa, diaminobencidina y Mn++. El superóxido presumiblemente oxida los iones Mn++ a Mn+++, que posteriormente tiene la capacidad de oxidar la diaminobencidina y se obtiene como resultado en la formación de depósitos electrodensos productos de la reacción. Finalmente, se observaron bajo el microscopio, Axioskop-Zeiss (de Alemania) y se reportaron como porcentaje de células positivas para el anión superóxido. Se realizó el ensayo del ácido tiobarbitúrico descrito por Ottawa y otros.13 Este método se fundamenta en la detección colorimétrica de los productos de la hidrólisis de hidroperóxidos lipídicos, como el malondialdehído (MDA), a través de la formación de un complejo de color rosado, con el ácido tiobarbitúrico a temperaturas cercanas a los 100 °C en medio ácido.
La comparación de los resultados obtenidos se realizó mediante el programa GraphPad Instat versión 3.05 y Graph Pad 4 para la representación gráfica de los datos. Las comparaciones entre los grupos se realizaron mediante la prueba t para muestras pareadas. Los resultados se presentaron como media, desviación estándar y la correlación de las variables se realizó a través de la prueba de coeficiente de correlación de Spearman. Se consideró un valor de p< 0,05 como estadísticamente significativo.
RESULTADOS
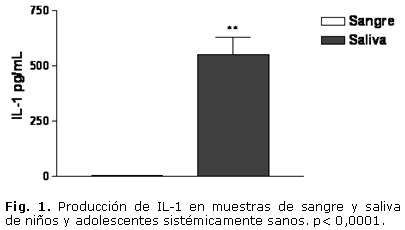
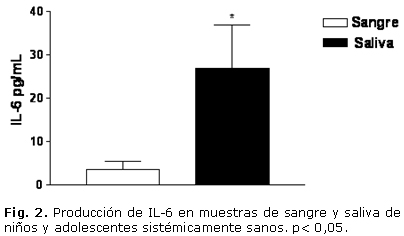
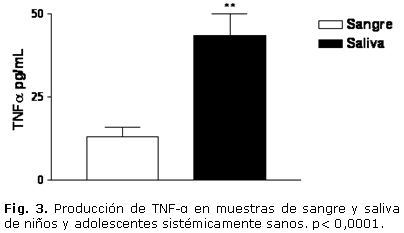
En cuanto a la evaluación clínica, el estado de salud gingival presentó la distribución porcentual siguiente: 9 individuos (39 %) con grado 0; 11 individuos (48 %) con grado 1 y un 13 % (3 infantes) con grado 2. Todos los sujetos presentaron algún grado de índice de placa. El grado 1 resultó ser el de mayor frecuencia. En las muestras estudiadas, todos los individuos presentaron niveles apreciables de TNF-a, IL-1, IL-6 y SRATB. En cuanto a los niveles de IL-1, IL-6 y TNF-a, se evidenció un incremento significativo en las muestras de saliva, al compararlas con las muestras de sangre. La IL-1 en sangre fue de 1,646 ± 0,13 pg/mL y en saliva de 552,36 ± 75,7 pg/mL. La IL-6 en sangre tuvo un valor de 3,506 ± 1,85 pg/mL, mientras que en saliva ascendió a 26,89 ± 9,97 pg/mL. En cuanto al TNF-a, en sangre fue de 12,91 ± 3,05 pg/mL y en la saliva fue de 43,56 ± 6,44 pg/mL (Figs. 1, 2 y 3). El análisis de la prueba t para muestras pareadas resultó con p< 0,05. El parámetro que mostró menor valor en sangre periférica fue la IL-1, mientras que el TNF-a fue el de mayor valor en ese fluido corporal.
Con relación al anión superóxido no se evidenciaron células positivas en las muestras estudiadas. En cuanto a la concentración de SRATB, se evidenció un incremento significativo en las muestras de sangre al compararlas con las de saliva. En sangre los niveles de SRATB fueron de 9,46 ± 3,2 nmol/mL, mientras que en la saliva fueron de 1,26 ± 0,03 nmol/mL, la prueba t para muestras pareadas resultó con p< 0,05 (Fig. 4). Al realizar los análisis estadísticos para evidenciar una posible asociación entre las muestras de sangre y saliva, se observó que no hubo una correlación estadísticamente significativa para IL-1, IL-6 y SRATB; rs= 0,17 (p= 0,44); rs= 0,02 (p= 0,92) y rs= 0,06 (p= 0,81). En cuanto al TNF-a se evidenció una correlación significativa rs= 0,78 (p< 0,05).
DISCUSIÓN
La saliva provee un medio ideal para la detección de marcadores proinflamatorios de la cavidad bucal de origen granulocítico y mucoso,14 por lo que en este estudio se evidenciaron niveles elevados de TNF-a, IL-1 e IL-6 en muestras salivales de sujetos sanos, tal como lo reportan SahebJamee y otros,15 quienes no evidenciaron diferencias estadísticamente significativas en los niveles de citosinas, entre el grupo control (pacientes sanos) y un grupo de pacientes con carcinoma de células escamosas. Estos hallazgos pudieran estar vinculados con diversos procesos como el recambio dentario y el estado de salud gingival, donde se evidenció la presencia de inflamación grado 1 y grado 2 en 14 de los sujetos evaluados.
En el estudio, todos los sujetos evaluados presentaron niveles de citosinas proinflamatorias en las muestras estudiadas. Esto coincidió con los hallazgos reportados por Chiappelli y otros,16 en donde se detectaron niveles de citocinas proinflamatorias en muestras de sangre y saliva de individuos normales. Esto se puede explicar, debido a que las citosinas son mediadores solubles que controlan muchas funciones fisiológicas como la inflamación, entre otros procesos biológicos. Por otra parte, no se observó en ambos estudios, correlación estadísticamente significativa, para las IL-1 e IL-6. Sin embargo, en cuanto al TNF-a, una correlación significativa fue evidenciada en los resultados de este trabajo, probablemente debido a que esta, es la que desencadena la cascada de producción de citocinas proinflamatorias, involucradas en diversos procesos inflamatorios.
Los niveles observados de IL-1 salival en las muestras evaluadas coinciden con lo reportado por Ulker y otros17 quienes estudiaron los niveles de IL-1, en muestras de saliva en pacientes con gingivitis; esta similitud de resultados, posiblemente se pudiese explicar por la presencia de IG grado 1 y 2, en los sujetos del presente estudio. Al evaluar los niveles de IL-6 en las muestras estudiadas, se evidenció que no hubo correlación significativa entre los fluidos corporales estudiados, los que coincidió con los hallazgos reportados por Minetto y otros,18 que reportaron la ausencia de relación significativa entre los niveles de IL-6 salival y sérica.
La saliva total contiene diversos agentes antimicrobianos, lisozimas, lactoferrina, Ig A y peroxidasa, entre otros. La peroxidasa cataliza la inhibición del crecimiento bacteriano y previene la acumulación del peróxido de hidrógeno, así las proteínas presentes en la saliva protegen de la acción del oxígeno y de especies reactivas del oxígeno. En este sentido, los resultados de este trabajo evidenciaron una disminución en la peroxidación de lípidos SRATB en las muestras de saliva, en comparación con las de sangre. Esto difiere de lo reportado por Salvolini y otros,19 quienes observaron incremento del MDA en saliva de adultos mayores. Esta poca producción de MDA en saliva en el presente estudio, pudiese estar relacionada con una disminución de los radicales libres, lo que coincide con la ausencia evidenciada de células productoras de anión superóxido en saliva y por ende, en la muestra objeto de estudio no se observaron daños tisulares.
El resultado obtenido del análisis de correlación entre las muestras salivales y séricas, no aportó suficientes evidencias para sugerir que la saliva pueda ser utilizada como fluido corporal que permita sustituir la determinación sérica de IL-1, IL-6 y SRATB. En cuanto al TNF-a, se apreció una correlación significativa, lo cual podría plantear la posible sustitución de muestras séricas por muestras salivales. Todos estos hallazgos sugieren la necesidad de realizar estudios futuros con mayores muestras poblacionales, que permitan corroborar la posibilidad de utilizar la saliva como fluido corporal, para determinar parámetros inflamatorios en el diagnóstico de diversas enfermedades, tanto sistémicas como del sistema estomatognático.
REFERENCIAS BIBLIOGRÁFICAS
1. Tenovuo J. Salivary parameters of relevance for assessing caries activity in individuals and populations. Community Dent Oral Epidemiol. 1997;25(1):82-6.
2. Hofman LF. Human saliva as a diagnostic specimen. J Nutr. 2001;131(5):1621-5.
3. Haeckel R, Hänecke P. The application of saliva, sweat and tear fluid for diagnostic purposes. Ann Biol Clin. 1993;51(10-11):903-10.
4. Chistodoulides N, Floriano PN, Acosta SA, Ballard KL, Weigum SE, Mohanty S, et al. Toward the development of a lab-on-a-chip dual-functions leukocyte and C-reactive protein analysis method for the assessment of inflammation and cardiac risk. Clin Chem. 2005;51(12):2391-5.
5. Oberholzer A, Oberholzer C, Moldawer LL. Cytokine signaling-regulation of the immune response in normal and critically ill states. Crit Care Med. 2000;28(4):3-12.
6. Pentón-Rol G, Cervantes-Llanos M, Martínez-Sánchez G, Cabrera-Gómez JA, Valenzuela-Silva CM, Ramírez-Nuñez O, et al. TNF-alpha and IL-10 downregulation and marked oxidative stress in neuromyelitis optica. J Inflamm. 200;6:18.
7. Sugawara S, Uehara A, Tamai R, Takada H. Innate immune responses in oral mucosa. J Endotoxin Res. 2002;8(6):465-8.
8. Madianos PN, Bobetsis YA, Kinane DF. Generation of inflammatory stimuli: how bacteria set up inflammatory responses in the gingiva. J Clin Periodontol. 2005;32(6):57-67.
9. Kawanishi S, Hiraku Y. Oxidative and nitrative DNA damage as biomarker for carcinogenesis with special reference to inflammation. Antioxid Redox Signal. 2006;8(5-6):1047-58.
10. Loe H, Silness J. Periodontal disease in pregnancy. Act Odont Scand. 1963;21:533-8.
11. Silness J, Loe H. Periodontal disease in pregnancy. Acta Odontol Scand. 1964;22:121-8.
12. Briggs RT, Robinson JM, Karnovsky ML, Karnovsky MJ. Superoxide production by polymorphonuclear leukocytes. Hystochemestry. 1986;84:371-8.
13. Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem. 1979;95:351-8.
14. Winkler O, Hadnagy W, Idel H. Cytokines detectable in saliva of children as appropriate markers of local immunity of the oral cavity an approach for the use in air pollution studies. Int J Hyg Environ Health. 2001;204(2-3):181-4.
15. SahebJamee M, Eslami M, AtarbashiMoghadam F, Sarafnejad A. Salivary concentration of TNF-alpha, IL1 alpha, IL6, and IL8 in oral squamous cell carcinoma. Med Oral Patol Oral Cir Bucal. 2008;13(5):292-5.
16. Chiappelli F, Iribarren FJ, Prolo P. Salivary biomarkers in psychobiological medicine. Bioinformation. 2006;1(8):331-4.
17. Ulker AE, Tulunoglu O, Ozmeric N, Can M, Demirtas S. The evaluation of cystatin C, IL-1beta, and TNF-alpha levels in total saliva and gingival crevicular fluid from 11-to 16-year-old children. J Periodontol. 2008;79(5):854-60.
18. Minetto M, Rainoldi A, Gazzoni M, Terzolo M, Borrione P, Termine A, et al. Differential responses of serum and salivary interleukin-6 to acute strenuous exercise. Eur J Appl Physiol. 2005;93(5-6):679-86.
19. Salvolini E, Martarelli D, Di Giorgio R, Mazzanti L, Procaccini M, Curatola G, et al. Age-related modifications in human unstimulated whole saliva: a biochemical study. Aging. 2000;12(6):445-8.
Recibido: 24 de abril de 2011.
Aprobado: 3 de mayo de 2011.
Dra. Ninoska Viera. Facultad de Odontología. Universidad de Zulia, Venezuela. Correo electrónico: ninoskaviera@gmail.com