Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión impresa ISSN 0034-7507
Rev Cubana Estomatol vol.48 no.4 Ciudad de La Habana oct.-dic. 2011
ARTÍCULOS ORIGINALES
Caracterización histopatológica de la leucoplasia bucal en La Habana durante 10 años
Histopathological characterization in the leukoplakia buccalis in Havana during 10 years
Zenia Batista Castro,I Irene Rodríguez Pérez,II Josefa Miranda Tarragó,III Enrique Rengifo Calzado,IV Teresita Rodríguez Obaya,V Mónica Elena Fernández JiménezI
I Especialista de I Grado en Histología. Doctora en Medicina. Profesora Auxiliar. Facultad de Ciencias Médicas "Victoria de Girón". Universidad de Ciencias Médicas de La Habana, Cuba.
II Doctora en Ciencias Médicas. Especialista de II Grado en Histología. Doctora en Estomatología. Profesora Titular. Profesora Consultante. Facultad de Ciencias Médicas "Victoria de Girón". Universidad de Ciencias Médicas de La Habana, Cuba.
III Máster en Salud Bucal Comunitaria. Especialista de II Grado en Oncología. Doctora en Estomatología. Profesora Titular. Profesora Consultante. Facultad de Estomatología. Universidad de Ciencias Médicas de La Habana, Cuba.
IV Doctor en Ciencias Médicas. Especialista de I Grado en Histología. Licenciado en Biología. Investigador Titular. Profesor Titular. Centro de Inmunología Molecular, La Habana, Cuba.
V Doctora en Ciencias Biológicas. Especialista de I Grado en Histología. Doctora en Medicina. Investigadora Titular. Asistente. Centro de Inmunología Molecular, La Habana, Cuba.
RESUMEN
La displasia epitelial es considerada el más fuerte predictor histológico de la futura transformación maligna de la leucoplasia bucal. El objetivo del presente trabajo fue determinar la presencia y severidad de la displasia epitelial y su asociación con las alteraciones histológicas de los tejidos epitelial y conectivo de la mucosa en la leucoplasia bucal. Se efectuó una investigación descriptiva y transversal de 83 biopsias procesadas mediante la técnica de inclusión en parafina y coloreadas con hematoxilina y eosina, de pacientes con diagnóstico de leucoplasia bucal entre los años 1991 y 2001, procedentes de la Facultad de Estomatología de la Universidad de Ciencias Médicas de La Habana, Cuba. Se encontró que 92,8 % de los pacientes con diagnóstico clínico de esta enfermedad tuvieron displasia epitelial, de estos y acorde a su grado de severidad, se encontró displasia epitelial ligera en 53,0 %, displasia epitelial moderada en 36,4 % y displasia epitelial severa en 10,4 %. La paraqueratosis se manifestó como sigue: asociada a la displasia epitelial ligera en 43,9 % de los pacientes, a la displasia epitelial moderada en 78,6 % y a la displasia epitelial severa en 100,0 %. La hiperplasia epitelial se presentó en 57,1 % de los casos y el infiltrado inflamatorio en 79,2 % de las muestras examinadas. Se concluyó que en la muestra de leucoplasia bucal estudiada existió un porcentaje elevado de displasia epitelial, con predominio de su grado ligero y una asociación entre el grado de severidad con los diversos patrones de queratinización y la intensidad del infiltrado inflamatorio, lo que se consideró importante al analizar su evolución ante un diagnóstico determinado y su pronóstico.
Palabras clave: displasia epitelial, leucoplasia bucal.
ABSTRACT
The epithelial dysplasia is considered the stronger predictor of a future malignant transformation of the leukoplakia buccalis. The aim of present paper was to determine the presence and severity of this type of dysplasia and its association with the histological alterations of epithelial and connective tissues of mucosa in the leukoplakia buccalis. A cross-sectional and descriptive research was conducted in 83 biopsies processed by technique of paraffin inclusion and stained with Hematoxylin and Eosin of patients diagnosed with this entity between 1991-2001 from the Stomatology Faculty of the Medical Sciences University of La Habana. The 92.8 % of patients with a clinical diagnosis of leukoplakia buccalis had slight epithelial dysplasia, from these and according to its grade of severity, there was found a slight epithelial dysplasia in the 53.0 %, moderate epithelial dysplasia in the 36.4 % and a severe epithelial dysplasia in 10.4 %. The parakeratosis was manifested in the 43.9 % associated with a slight epithelial dysplasia, 78.6 % with a moderate dysplasia and in the 100 % with the severe one. The epithelial dysplasia was present in the 57.1 % of cases and the inflammatory infiltrate in the 79.2 % of study samples. Authors conclude that in the study sample of leukoplakia buccalis there is a high percentage of epithelial dysplasia with predominance of its slight degree and a association between its severity degree with the different patterns of keratinization and the intensity of inflammatory infiltrate, something important in the analysis of its course in face a determined diagnosis y its prognosis.
Key words: epithelial dysplasia, leukoplakia buccalis.
INTRODUCCIÓN
La prevención del cáncer de cabeza y cuello requiere de diversas acciones, entre las cuales puede ser clave el estudio de las lesiones bucales potencialmente malignas que se encuentran por orden de frecuencia: la leucoplasia bucal (LB), la eritroplasia bucal y el paladar del fumador invertido.1,2 En el taller coordinado por el Centro de Colaboración para el Cáncer y Precáncer de la Cavidad Bucal de la Organización Mundial de la Salud (OMS), celebrado en Londres en el año 2005, se definió a la LB como una placa blanca de riesgo dudoso que excluye otras enfermedades o trastornos que no tienen riesgo para el cáncer.3-5
Desde el punto de vista clínico las leucoplasias se subdividen en homogéneas y no homogéneas,4,5 sin embargo, en Cuba la nomenclatura más utilizada es la de Santana Garay, que las clasificó en queratosis difusa, focal y leucoplasia, a la que posteriormente se le agregó la leucoplasia maculosa bucal (LMB), debido a que esta última variedad constituyó la lesión paradigmática de una dinámica agresiva, que de una simple queratosis difusa culminó en un carcinoma epidermoide bucal (CEB).6 Aproximadamente entre el 15,8 % al 48,0 % de los CEB se han asociado a lesiones leucoplásicas en el momento de su diagnóstico.7
Microscópicamente se observaron diferentes alteraciones histológicas como son: el desarrollo de un proceso de queratinización, que es su rasgo esencial pues le da su aspecto clínico blanco, los cambios en el grosor epitelial, las ulceraciones en el epitelio de la mucosa y la presencia de displasia epitelial, así como los cambios celulares en el tejido conjuntivo subyacente.6-8 La transformación maligna de la leucoplasia oscila según los estudios revisados,6,7 desde 0,13 % a 17,0 %, ya que depende de varios factores fundamentales, como la presencia y la severidad de la displasia epitelial y que califican su magnitud de acuerdo con los 12 grados recomendados por Smith y Pindborg.8
El término displasia significa literalmente crecimiento desordenado, debido a trastornos en el crecimiento normal, proliferación, maduración y organización de las células. Esta alteración ocurre sobre todo en los epitelios y se caracteriza por un conjunto de cambios que expresan la imagen visual de la pérdida de uniformidad y la orientación arquitectónica tisular.
Cerca de un 25 % de las lesiones leucoplásicas muestran evidencias de displasia epitelial o carcinoma in situ en el primer reconocimiento histopatológico. Sin embargo, en la actualidad pocas investigaciones han podido seguir la historia natural de las lesiones con cambios displásicos específicos. No obstante, se han encontrado factores que tienen un alto riesgo de cambios malignos como son: la leucoplasia concomitante con eritroplasia, la apariencia verrugosa proliferativa de la lesión, los sitios anatómicos con alto riesgo, la presencia de múltiples lesiones y la historia paradójica de no ser fumador.9
Existe una gran variabilidad en los reportes encontrados, dada por la valoración subjetiva de los diferentes examinadores en relación a su presencia, severidad y significado. Se plantea que el índice de transformación maligna en la displasia ligera, moderada y severa va desde un 3,0 %, 4,0 % y 43,0 % respectivamente.7,10 Sobre la base de la potencialidad de transformación maligna de la LB se efectuó esta investigación, con los objetivos de determinar la presencia y la severidad de la displasia epitelial en la LB y su asociación con las alteraciones histológicas de los tejidos epiteliales y conectivos de la mucosa.
MÉTODO
Se efectuó una investigación descriptiva y transversal a partir del análisis de los cortes de todas las biopsias conservadas en parafina, de pacientes con diagnóstico clínico e histopatológico de LB. Estos análisis fueron realizados en el Laboratorio de Anatomía Patológica de la Facultad de Estomatología, procedentes del proyecto de investigación: "Seguimiento clínico y caracterización histopatológica de las lesiones precancerosas bucales", de la Clínica de Patología Bucal del mismo centro entre los años 1991 a 2001.
A partir de los bloques de parafina de las biopsias, se realizaron cortes de 7 µm de grosor en un micrótomo vertical marca Spencer y se colorearon con hematoxilina y eosina.11
Se analizaron las siguientes alteraciones histopatológicas:
- Grado de displasia epitelial: se tuvo en cuenta los criterios que se establecieron por el grupo de estudio para las lesiones precancerosas de la OMS, establecidas por Smith y Pindborg en 1969.8,11-13 Se definió la displasia epitelial como un conjunto de alteraciones de las células epiteliales entre las que se encuentran: las deformaciones de los clavos interpapilares, la estratificación epitelial irregular, la hiperplasia de las células basales, la queratinización de células aisladas o grupos de células por debajo del estrato espinoso, la pérdida de la adherencia intercelular, la pérdida de polaridad de las células basales, la hipercromasia del núcleo y del nucleolo, el aumento de la relación núcleo-citoplasma, la anisocitosis y la anisonucleosis, el pleomorfismo de la célula y el núcleo, abundantes mitosis y figuras de mitosis anormales. Los cortes fueron evaluados y se les asignó una puntuación de acuerdo al grado de severidad según se expone a continuación: de 0 a 10 puntos no hubo displasia epitelial, de 11 a 25 puntos hubo displasia epitelial ligera, de 26 a 45 puntos hubo displasia epitelial moderada y de 45 puntos en adelante hubo displasia epitelial severa.
- Tipo de queratinización:
· Ortoqueratosis: cuando la capa más superficial se observó homogénea, eosinófila y sin núcleos y el estrato granuloso siempre está presente. Si la capa de queratina sobrepasó lo que normalmente se considera característico para esta área, se denominó hiperortoqueratosis.
· Paraqueratosis: cuando las células de las capas más superficiales del epitelio fueron más acidófilas y aplanadas con núcleos picnóticos; el estrato granuloso pudo o no estar presente. Si la capa de paraqueratina sobrepasó lo que normalmente se considera característico para esta área, se denominó hiperparaqueratosis. A veces fue posible observar de forma alterna áreas de ortoqueratosis y paraqueratosis.
- Grosor epitelial:
· Hiperplasia: cuando una parte o todo el epitelio presentó un aumento de grosor por incremento del número de células en la capa basal o en el estrato espinoso.
· Atrofia: cuando una parte o todo el epitelio presentó una disminución del número de células en la capa basal o en el estrato espinoso.
Las alteraciones en el tejido conjuntivo se analizaron según los criterios de Smith y Renstrup14 basados en las siguientes categorías:
- Ausente: si el aspecto del tejido conjuntivo fue normal.
- Ligera: si se observaron escasas células de la inflamación crónica.
- Moderada: cuando a pesar de existir una gran concentración celular todavía fue visible la matriz extracelular del tejido conjuntivo.
- Severa: si todo el tejido conjuntivo estuvo ocupado por células de la inflamación crónica.
Para las observaciones se utilizaron magnificaciones de 100 X, 400 X y 1 000 X en un microscopio óptico Karl Zeiss y se digitalizaron las imágenes en un microscopio Leyca acoplado a la computadora, programada con el sistema Atiplay. Se recogieron los resultados en una base de datos mediante el programa de Microsoft Excel. El análisis se realizó por medio del empleo de las estadísticas descriptivas con la realización de las tablas de contingencia de 2 entradas y el cálculo del estadígrafo X2 correspondiente. Se empleó el programa SPS versión 9.0. En la investigación se siguieron los principios de la ética médica y los resultados solo se usaron con fines investigativos.
RESULTADOS
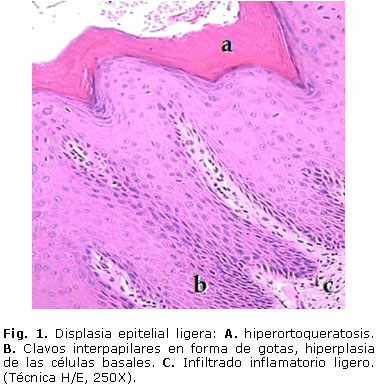
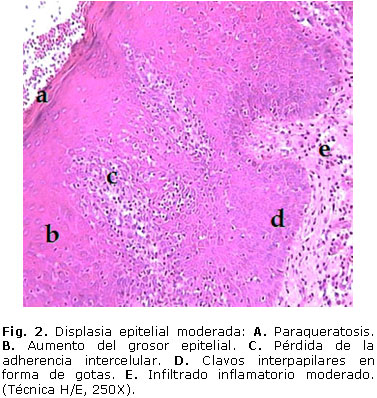
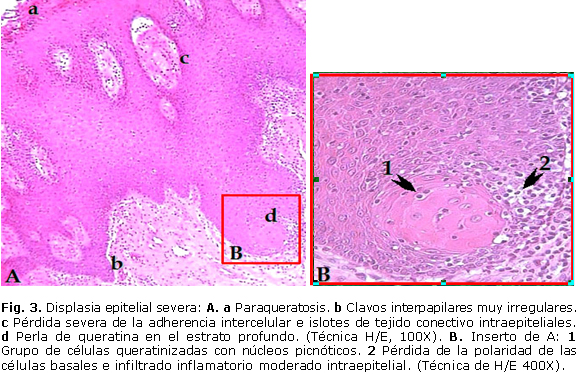
De los 83 pacientes con diagnóstico clínico de LB, se encontró que 77 (92,8 %) tuvieron displasia epitelial. De acuerdo al grado de severidad de la displasia epitelial, se observó displasia epitelial ligera en 53,0 % de las muestras, con cambios celulares en el tercio inferior del epitelio, en el que se observó fundamentalmente, hipercromatismo y pleomorfismo nuclear e hiperplasia de las células basales (Fig. 1). En frecuencia le siguió la displasia epitelial moderada con 36,4 %, en la que se observaron alteraciones celulares y arquitectónicas a nivel del tercio medio del epitelio, con un predominio de la anisocitosis y anisonucleosis, la acentuación de la densidad celular y la pérdida de la polaridad de las células basales (Fig. 2). La displasia epitelial severa se presentó en 10,4 % de los casos, con predominio de cambios celulares en el tercio superior del epitelio. Se observaron también cuerpos apoptóticos, acantolisis y queratinización prematura con presencia de perlas de queratina en la profundidad del epitelio (Fig. 3).
La paraqueratosis estuvo presente en 43,9 % de los pacientes con displasia epitelial ligera; en 78,6 % de los diagnosticados con displasia epitelial moderada, y en el 100 % de aquellos con displasia epitelial severa (tabla 1). Al realizar el análisis estadístico se encontró asociación significativa entre los 2 tipos de queratinización y el aumento progresivo en severidad de la displasia epitelial.
La hiperplasia epitelial se presentó en el 57,1 % de las muestras. No se encontraron diferencias significativas entre el grado de displasia epitelial y el grosor epitelial (X2 1,558; p> 0,05).
La presencia de infiltrado inflamatorio a expensas de linfocitos se mostró en mayor o menor grado en 79,2 % de las muestras examinadas, en 3,3 % de aquellas con displasia epitelial ligera, en 8,7 % de las diagnosticadas con displasia epitelial moderada y en 37,5 % de las que presentaban displasia epitelial severa. Se observó que el grado de infiltrado inflamatorio aumentó de manera significativa a medida que se incrementó el grado de severidad de la displasia epitelial, específicamente de ligera a moderada (p= 0,00012) y de ligera a severa (p= 0,000001); no ocurrió de la misma manera al pasar de moderada a severa (tabla 2).
DISCUSIÓN
La alta proporción encontrada de muestras con displasia epitelial (92,8 %), no coincidió con lo reportado por la mayoría de los autores,7,9,15 quienes refirieron cifras mucho menores, que oscilaron del 20 al 50 %. Es bien conocido que el porcentaje de lesiones leucoplásicas con displasia epitelial, varía según el tamaño muestral y los criterios de los diferentes autores.7,11,16,17
En el presente estudio, la elevada incidencia de esta alteración histopatológica estuvo relacionada con los criterios utilizados para la toma de la muestra, ya que solo se consideraron con criterios para biopsia aquellos pacientes con leucoplasias no homogéneas, que se caracterizaron por presentar una elevada asociación con la displasia epitelial y por tanto, tuvieron mayor probabilidad de sufrir malignización.6,11,18
Los pacientes con diagnóstico clínico de leucoplasias no homogéneas fueron seguidos en su evolución clínica, mediante el proyecto guía de esta investigación, que contempló los posibles cambios que pueden aparecer en las lesiones para la decisión de la toma de una biopsia. Sin embargo, en otras investigaciones se evidenció que el criterio utilizado para la toma de la muestra fue diferente y no dependió de la apariencia clínica de la leucoplasia, donde se les realizó biopsia a todos aquellos pacientes que después de 4 semanas de eliminado el factor de riesgo, se mantuvo la lesión, aun cuando se trató de una leucoplasia homogénea, forma clínica que se caracteriza por presentar un bajo por ciento de asociación con la displasia epitelial.6,9,19
En este estudio hubo concordancia con lo reportado por otros autores6,17-22 respecto a la observación de una mayor frecuencia de displasia epitelial ligera, y una menor frecuencia de displasia moderada y severa. Los diferentes grados de displasia epitelial se tradujeron en alteraciones en el patrón de proliferación, de diferenciación y de maduración celular y aumentaron progresivamente en el tiempo, a medida que se estableció un proceso de carcinogénesis epitelial.
Los carcinomas que se desarrollaron de estas alteraciones surgieron de 2 a 4 años después de iniciada la lesión, incluso algunos consideraron que este proceso puede durar décadas. El tiempo estimado para la progresión dependió de la severidad de la displasia epitelial. Se calculó aproximadamente 58 meses para la ligera, 38 meses para la moderada y 12 meses para la severa.14,19,20
Luego de tener en cuenta los factores antes expuestos, el predominio de displasia epitelial ligera encontrado en la investigación pudo deberse a que dentro de los programas de salud vigentes en Cuba, existe un Programa de Detección del Cáncer Bucal,23 que permite que gran número de los pacientes sean diagnosticados en las fases iniciales de la enfermedad. La relación significativa entre el grado de displasia epitelial y el patrón de queratinización, coincidió con lo planteado por otros investigadores.6,17,18,21,22
A medida que aumentó el grado de severidad de la displasia epitelial, las variaciones histológicas en el tipo de la queratinización, la ortoqueratosis, la ortoparaqueratosis y la paraqueratosis se tradujeron en un incremento del recambio celular de forma descontrolada, con una pérdida de la capacidad de diferenciación celular.10,11,15 El recambio celular en la mucosa bucal fue de 41 a 57 días, la actividad mitótica pudo verse afectada por el estrés, la inflamación y los procesos de transformación preneoplásicos y neoplásicos, como ocurre en la displasia epitelial.15,19
Es probable que los resultados estén en relación con lo planteado por diferentes investigadores,14,19,20 que tienen el criterio de que en la displasia ligera pudieran encontrarse subpoblaciones de células mutadas con un grado de proliferación ligeramente aumentado y de diferenciación celular similar al de los queratinocitos normales. Esto desencadenaría un proceso de queratinización completa, típico de la ortoqueratosis, y ya a nivel de las displasias moderadas y severas aumentaría este nivel de proliferación de células mutadas, caracterizadas por una indiferenciación celular más acentuada, lo que se traduce en el desarrollo de una capa superficial de células mucho más acidófilas y aplanadas, con núcleos picnóticos característico de la paraqueratosis.19,20
La mayor frecuencia de hiperplasia epitelial pudo estar relacionada con el aumento paulatino de la proliferación celular, que ocurrió desde el comienzo del proceso de carcinogénesis, aunque no se encontraron diferencias significativas entre estos 2 aspectos. En la literatura revisada no se encontraron estudios que relacionen los grados de displasia epitelial con el grosor epitelial.22
El grado de infiltrado inflamatorio estadísticamente significativo con respecto al grado de severidad de la displasia epitelial coincidió con lo referido por otros autores.6,15,19,20 La presencia del infiltrado en las lesiones displásicas es reportado como un indicador importante de la existencia de defensa inmunológica, posible y característica de esa zona,6,19,20 pues es conocido que las lesiones premalignas pueden provocar una "florida" reacción inflamatoria. Este sistema de respuesta inmunológica está dado por una reacción subepitelial e interepitelial en los focos de displasia epitelial, presumiblemente de células que presentan moléculas del complejo mayor de histocompatibilidad clase I.
Aproximadamente 90 % de los CEB son bien diferenciados, caracterizados por células neoplásicas que expresan moléculas de clase I, con un elevado potencial inmunogénico capaz de provocar una elevada respuesta inflamatoria.6,24 Es probable que el aumento de la intensidad del infiltrado inflamatorio, a medida que se incrementó el grado de severidad de la displasia epitelial encontrada en esta casuística, se debió al incremento progresivo de células mutadas que expresaron estas mismas moléculas.
Otros autores25,26 consideraron que la posibilidad de transformación maligna de la LB se ha relacionado con las respuestas inmunitarias asociadas al uso del tabaco, por lo que se puede pensar que tanto los agentes químicos como los microbianos, relacionados con la aparición de la LB, fueron capaces de inducir sus efectos a través de las alteraciones inmunológicas. Una amplia revisión por medios digitalizados27 sobre aspectos relacionados con la detección precoz del cáncer bucal, evidencia que en este tema se debe considerar como útil, tanto las técnicas de avanzada como aquellas más tradicionales para lograr en su conjunto, un mejor resultado.
Se concluyó en el estudio, que en la muestra de leucoplasia bucal estudiada existió una incidencia elevada de displasia epitelial con predominio del grado ligero. También existió asociación entre la presencia y el grado de severidad de la displasia epitelial, así como de los diversos patrones de queratinización y el incremento de la intensidad del infiltrado inflamatorio; lo que podría jugar un papel importante en el desarrollo, comportamiento y regulación de las condiciones preneoplásicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Slama BL. Potentially malignant disorders of the oral mucosa: terminology and classification. Rev Stomatol Chir Maxillofac. 2010;4:208-12.
2. Petersen PE. Strengthening the prevention of oral cancer: the who perspective. Community Dent Oral Epidemiol. 2005;33(6):297-9.
3. Miranda J, Fernández L, García G, Rodríguez I, Trujillo E. Pacientes remitidos por el Programa de Detección de Cáncer Bucal. Facultad de Estomatología de La Habana, 1999-2006. Rev Cubana Estomatol. 2010;47(4):381-91.
4. van der Waal I. Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncol. 2010;46(6):423-5.
5. Warnakulasuriya S, Johnson NW, Van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-80.
6. Santana JC. Prevención y diagnóstico del cáncer bucal. La Habana: ECIMED; 2002. p. 42-9.
7. Wang YF, Shang S, Zhou ZT, Tang GY. A retrospective analysis on the malignant transformation rate, time and risk factors of oral leukoplakia. Shanghai Kou Qiang Yi Xue. 2011;1:55-61.
8. Pindborg JJ, Reichart CJ. Who histological typing of cancer and precancer of the oral mucosa. New York: Springer; 1997.
9. Amagasa T, Yamashiro M, Uzawa N. Oral premalignant lesions: from a clinical perspective. Int J Clin Oncol. 2011;1:5-14.
10. Speight MP. Update on oral epithelial dysplasia and progression to cancer. Head Neck Pathol. 2007;1:616.
11. Rodiles H, Campañón JL, Laza C. Citohistopatología. Procedimientos básicos. La Habana: ECIMED; 2008.
12. Smith CJ, Pindborg JJ. Histological grading of oral epithelial atypia by the use of photographic standards. Dep of Oral Pathology. Copenhagen: Royal Dental College Ed; 1969.
13. Fernández ME, Rodríguez I, Miranda J, Batista Z. Displasia epitelial como característica histopatológica del liquen plano bucal. Rev Haban Cienc Med. [serie en internet]. 2009 [citado: 30 may 2011];8(4): [aprox. 1 p.]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1729519X2009000400003&lng=es
14. Smith CJ, Renstrup G. The cronic inflammatory cell reactions associated with oral leukoplakia. Meeting Investigation Oral Pre-cancer. Bombay, La India. 1970.
15. Reibel J. Prognosis of oral pre-malignant lesions: significance of clinical, histopathological and molecular biological characteristics. Crit Rev Oral Biol Med. 2003;14(1):47-62.
16. Álvarez VR, González FF, Vila GP, López RD, García GA, Rey GJ. Correlation between clinical and pathologic diagnosis in oral leukoplakia in 54 patients. Med Oral Patol Oral Cir Bucal. 2010;6:832-8.
17. Rodríguez I, Bánoóczy J. Oral leukoplakia: a histopathological study. Acta Morphologica Acad Sci Hung. 1982;30(3-4):289-98.
18. Pereira JS, Carvalho MV, Henriques AC, de Queiroz CT, Miguel MC, Freitas RA. Epidemiology and correlation of the clinicopathological features in oral epithelial dysplasia: analysis of 173 cases. Ann Diagn Pathol. 2011;2:98-102.
19. Warnakulasuriya S. Histological grading of oral epithelial dysplasia: revisited. J Pathol. 2001;194(3):294-7.
20. Wang Z, Feng X, Liu X, Jiang L, Zeng X, Ji N, et al. Involvement of potential pathways in malignant transformation from oral leukoplakia to oral squamous cell carcinoma revealed by proteomic analysis. BMC Genomics. 2009;10:383.
21. Otero I, Rodríguez I, Travieso M, González G, Hidalgo-Gato I. Estudio histopatológico del epitelio de la leucoplasia bucal. Rev de Ciencias Médicas de Pinar del Río. 2003;7(2):1561-3194.
22. Ríos M, Rodríguez I, Miranda J, Mandado S. Correlación entre la coilocitosis y la leucoplasia bucal. VIII Congreso Virtual Hispanoamericano de Patología, 2006. Disponible en: http://conganat.cs.urjc.es
23. Programa Nacional de Atención Estomatológica Integral a la Población. República de Cuba. Ministerio de Salud Pública. Área de Asistencia Médica y Social. Dirección Nacional de Estomatología, La Habana, Cuba. [serie en internet]. 2002 [citado: 20 abr 2007]. Disponible en: http://aps.sld.cu/bvs/materiales/programa/otros/estomatologia/programanacional.pdf
24. Hunter T, Pustzal L. Neoplasias. En: Cotran RS, Kumar MD, Path GR, Collins T. Robins: patología estructural y funcional. Boston: Mc Graw-Hill-Interamericana; 2007. p. 778-80.
25. Lehner T, Shillitos E. Aspectos inmunológicos del cáncer. En: Fundamentos científicos de la odontología. La Habana: Ed. Científico Técnica; 1983. p. 204.
26. Pillai R. Immunological abnormalities in oral precancer. Cancer Lett. 1991;57:1.
27. Albornoz C, Rivero O, Bastian L. Avances en el diagnóstico de las lesiones cancerizables y malignas del complejo bucal. AMC. [serie en internet]. 2010 [citado: 6 may 2011];14(5): [aprox. 1 p.]. Disponible en: http://scielo.sld.cu/scielo.php?pid=S1025-02552010000500019&script=sci_arttext
Recibido: 28 de agosto de 2011.
Aprobado: 6 de septiembre de 2011.
Dra. Zenia Batista Castro. Facultad de Estomatología. Universidad de Ciencias Médicas, La Habana, Cuba. Correo electrónico: zenia.batista@infomed.sld.cu