My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Estomatología
Print version ISSN 0034-7507
Rev Cubana Estomatol vol.51 no.2 Ciudad de La Habana Apr.-June 2014
PRESENTACIÓN DE CASO
Regeneración ósea guiada: nuevos avances en la terapéutica de los defectos óseos
Guided bone regeneration: new advances in the treatment of bone defects
Dra. Verónica Gómez Arcila, Dr. Guido Benedetti Angulo, Est. Camilo Castellar Mendoza, Dr. Luis Fang Mercado, Dr. Antonio Díaz Caballero
Facultad de Odontología de la Universidad de Cartagena. Cartagena, Bolívar, Colombia.
RESUMEN
Introducción: el procedimiento de regeneración ósea guiada ha demostrado ser una técnica exitosa para promover el llenado de defectos óseos presentes, así como para aumentar las dimensiones de rebordes alveolares atróficos previo a rehabilitación protésica convencional o implanto soportada.
Objetivo: describir la utilización clínica de injerto aloplástico de b-fosfato tricálcico como material de relleno en la regeneración de defectos óseos alveolares.
Presentación del caso: se presentó el caso de una paciente femenina de 57 años de edad quien acudió a la consulta odontológica por presencia de supuración en un diente anterosuperior, como consecuencia de un proceso infeccioso apical. Al examen clínico se observó resto radicular de incisivo central superior izquierdo e incisivo lateral superior izquierdo; radiográficamente se observó fractura radicular de incisivo central superior derecho. Posterior a la extracción de los restos radiculares, se empleó la técnica de regeneración ósea guiada, utilizando injerto aloplástico de b-fosfato tricálcico con una membrana de colágeno reabsorbible. Tres meses posteriores al tratamiento, se observó aumento en altura y anchura del reborde alveolar, con lo que se logró la conformidad estética y funcional deseada.
Conclusión: el caso presentado revela resultados clínicos satisfactorios gracias a la neoformación de hueso observada y a la planificación adecuada del tratamiento con regeneración ósea guiada, por lo que el uso de injerto óseo, específicamente el injerto aloplástico b-fosfato tricálcico, en combinación con las membranas de barrera, se sugiere para el manejo de los defectos óseos alveolares.
Palabras clave: reabsorción alveolar, injerto óseo, regeneración ósea, membrana.
ABSTRACT
Introduction: the procedure of guided bone regeneration has proven to be a successful technique to promote the filling of bone defects and enlarge the dimensions of atrophic alveolar ridges prior to conventional or implant-supported prosthetic rehabilitation.
Objective: describe the clinical use of b-tricalcium phosphate alloplastic graft as a filler material in the regeneration of alveolar bone defects.
Case report: a female 57-year-old patient presented at dentistry consultation with exudate from an upper anterior tooth due to apical infection. Clinical examination revealed root rests of the upper left central incisor and upper left lateral incisor. Radiography showed root fracture of the upper right central incisor. Upon extraction of the root rests, guided bone regeneration technique was performed, using b-tricalcium phosphate alloplastic grafting with a resorbable collagen membrane. Three months after treatment, an increase in height and width of the alveolar ridge was observed, achieving the desired aesthetic and functional status.
Conclusions: satisfactory clinical results in terms of bone neoformation are due to adequate therapeutic planning and the employment of guided bone regeneration. Use of bone grafting, specifically alloplastic graft of b-tricalcium phosphate in combination with barrier membrane, is thus suggested for the management of alveolar bone defects.
Key words: alveolar resorption, bone graft, bone regeneration, membrane.
INTRODUCCIÓN
La extracción de los dientes provoca una pérdida de hueso alveolar del 40 al 60 % en los dos a tres primeros años de realizada, y continua a través de la vida, sin tener en cuenta sexo, edad ni condición social. Esta atrofia ósea que se experimenta posterior a la pérdida de órganos dentarios es uno de los aspectos más preocupantes de la cavidad oral, además de la recuperación del contorno, altura y forma ósea después de la eliminación de procesos destructivos que afectan los huesos maxilares.1
Un reborde alveolar adecuado es fundamental para el éxito de la rehabilitación funcional de las arcadas dentarias, por lo que en pacientes con atrofia alveolar se requiere alguna técnica de aumento óseo previa a la rehabilitación protésica convencional o implante soportado.2 Para reconstruir estéticamente los defectos de los tejidos duros y blandos existen varias técnicas que pueden incrementar los rebordes; entre ellas se encuentran los injertos libres de encía, los injertos de tejido conectivo subepitelial, la distracción osteogénica y el uso de técnicas de regeneración ósea guiada (ROG) con membranas de barrera.3
El hueso sano conserva siempre su capacidad de regeneración; sin embargo, existen pérdidas por procesos traumáticos o infecciosos que requieren tratamientos de regeneración.4 La ROG es utilizada hoy en día de manera exitosa para tratar diversos tipos de defectos óseos utilizando membranas con funciones de barrera. Se considera una técnica de estimulación para la formación de hueso nuevo en donde las membranas favorecen la formación y preservación del coágulo para evitar la infiltración, en la zona de reparación, de componentes celulares (células epiteliales y conjuntivas) distinto a células osteopromotoras, lo que permite la diferenciación del coágulo en tejido óseo y, de esta manera, contar con cantidad y calidad adecuada de hueso, con estabilidad suficiente para la rehabilitación protésica convencional o con implantes dentales oseointegrados.5,6
Diversos materiales de injerto son usados para la ROG. Estos pueden ser: autoinjertos o autólogos, isoinjertos, xenoinjertos o heteroinjertos, aloinjertos u homoinjertos y, por último, injertos aloplásticos; estas son sustancias sintéticas utilizadas como sustitutos óseos, dentro de los que se citan: b-fosfato tricálcico (b-FTC), sulfato de calcio, cerámicos vítreos bioactivos y polímeros.6,7 El presente artículo describe la utilización clínica de injerto aloplástico de b-FTC como material de relleno para la regeneración de defectos óseos alveolares asociado al uso de membrana reabsorbible de colágeno.
PRESENTACIÓN DEL CASO
Paciente femenina de 57 años de edad, portadora de prótesis parcial fija desde hace 10 años, que acude a consulta odontológica por supuración de material purulento en encía del sector anterosuperior con cinco días de evolución. La paciente no reportó ningún antecedente sistémico de importancia. Al examen intraoral se observó encías enrojecidas y edematosas adyacentes a la prótesis parcial fija metal-cerámica, la cual abarcó desde primer premolar superior derecho hasta primer premolar superior izquierdo. Luego de la desinserción de la prótesis parcial fija, se observó núcleo colado en incisivo lateral superior derecho, muñón en resina con evidencia de núcleo colado en incisivo central superior derecho y resto radicular de incisivo central superior izquierdo e incisivo lateral superior izquierdo, además de fístula a nivel de este último órgano dentario (Fig. 1). Al examen radiográfico, se observó material radiopaco en incisivo central superior derecho e incisivo lateral superior izquierdo correspondientes con material de obturación en cada uno y núcleo colado en el primero. Además, se evidenció imagen radiolúcida apical compatible con lesión periapical inflamatoria. Gracias a la fistulografía realizada, se corroboró que el proceso infeccioso se originaba en el incisivo lateral superior izquierdo, y el diagnóstico fue absceso periapical crónico asociado a fracaso endodóntico y fractura vertical.
A partir de los hallazgos clínicos y radiográficos anteriormente descritos se decidió realizar cirugía bajo anestesia local con lidocaína 2 %, en donde se extrajeron los restos radiculares del incisivo central superior derecho, incisivo central superior izquierdo e incisivo lateral superior izquierdo a su pronóstico desfavorable para la rehabilitación. Luego de la extracción, se realizó un minucioso curetaje y desinfección del alvéolo con tetraciclina y suero fisiológico. Posteriormente, se realizó relajante distal y mesial con bisturí convencional (Bard Parker N°3, Hoja N° 15) y elevación de un colgajo de espesor total a nivel de dichos órganos dentarios, exponiendo el defecto de la cortical vestibular ósea; el tejido de granulación presente se eliminó con irrigación profusa de tetraciclina y suero fisiológico.
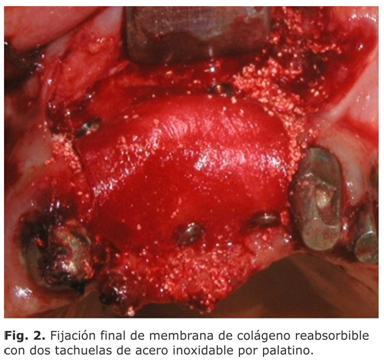
Con fresa redonda diamantada número 4, se realizaron perforaciones en la cortical para provocar sangrado; esta sangre posteriormente se empleó para humedecer el injerto óseo. A continuación, se procedió a fijar con tachuelas de acero inoxidable la membrana de colágeno reabsorbible de 15 mm x 20 mm (BICON) en la zona vestibular. Se procedió a mezclar el injerto aloplástico de b-FTC de 50-500 µm (Syntho Graft) con sangre previamente tomada de la paciente hasta alcanzar la consistencia de masilla, y con un elevador de periostio se llevó el material de relleno al defecto óseo. La membrana de colágeno reabsorbible se llevó hacia palatino para cubrir el material de relleno y finalmente se fijó con tachuelas de acero inoxidable en la misma zona (Fig. 2).
Los bordes del colgajo se suturaron con Poliglactina 910 reabsorbible (Vycril) 4-0 y puntos simples en las relajantes; luego, se colocó la prótesis provisional sin contacto con el área de la cirugía para evitar reabsorción del material de relleno. Una vez finalizada la intervención quirúrgica, a la paciente se le prescribió: amoxicilina 500 mg por 7 días, nimesulide 100 mg por 5 días y enjuagues con clorhexidina al 0,12 % 2 veces al día por 7 días. Tres meses posteriores a la colocación del injerto óseo, la paciente acudió a control posoperatorio y se observó cicatrización total del tejido. Se apreció aumento del reborde en sentido vestíbulo lingual y en altura en el sitio receptor del injerto, y se logró corrección satisfactoria del defecto óseo prexistente (Fig. 3).
DISCUSIÓN
La reabsorción del hueso alveolar es un proceso fisiológico posterior a una extracción dental simple; esta última es el resultado de procesos cariosos, trauma, lesiones endodónticas, defectos del desarrollo o periodontitis avanzadas.8 Esta pérdida dental trae como consecuencia deformidades óseas de la cresta alveolar, la cual empieza a colapsar significativamente. Su volumen óseo se va reduciendo tanto en anchura como en altura, sobre todo en las primeras 8 semanas luego de la extracción, y estos cambios afectan la función y la estética del paciente, más aun cuando la pérdida es en un diente anterior. Además, comprometen el área para futuras restauraciones.9
Previo a una extracción dentaria se debe tener previsto un plan de tratamiento para remplazar el diente perdido, teniendo en cuenta no solo la función, sino también la estética. El primer paso para lograr una óptima preservación de la cresta alveolar en el sitio edéntulo consiste en realizar una extracción atraumática; no obstante, si ocurren cambios dimensionales en el alvéolo posterior a dicha extracción,10 se intentará aumentar el proceso alveolar mediante técnicas de ROG que, gracias al uso de diversos materiales de relleno óseo, garantiza resultados clínicos favorables.11
Aunque existen muchos métodos para la regeneración ósea, todos ellos tienen indicaciones específicas y limitaciones. Los métodos establecidos son la distracción osteogénica e injertos óseos (autólogos, aloinjertos, sustitutos óseos o factores de crecimiento), que al combinarse con membranas con propiedades osteoinductivas, osteogénicas y angiogénicas demuestran resultados clínicos satisfactorios.12 El concepto de ROG con el uso de una membrana reabsorbible o no reabsorbible que actúe como una barrera para prevenir la invasión de los tejidos blandos en el defecto y formar una guía en el proceso de regeneración ósea es ampliamente utilizado hoy en día.13
Históricamente el concepto de ROG ha sido utilizado en cirugía reconstructiva experimental desde mediados de 1950, y la hipótesis inicial es que diferentes componentes celulares en el tejido tienen diferentes tasas de migración en un área de la herida durante la cicatrización, y que un obstáculo mecánico excluiría la invasión de sustancias inhibidoras, tales como fibroblastos.14 Los estudios preliminares mostraron que el uso de una membrana como una barrera mecánica evita la migración apical del epitelio y nueva inserción de tejido conectivo, para favorecer la migración de células osteogénicas desde la periferia hacia el centro con el fin de crear un tejido de granulación bien vascularizado, seguido por formación de hueso.15
Inicialmente, las membranas ampliamente usadas fueron las no reabsorbibles, y especialmente las de politetrafluoroetileno expandido (PTFEe), gracias a la biocompatibilidad y mantenimiento de su integridad estructural durante la implantación.16 Sin embargo, membranas reabsorbibles se han desarrollado para evitar la necesidad de una segunda intervención quirúrgica; dentro de este grupo se citan las membranas sintéticas y naturales, estas últimas hechas de colágeno, las cuales presentan ciertas ventajas como: 1) altamente biocompatibles (ningún efecto adverso a los tejidos circundantes durante la degradación), 2) promueven la cicatrización de la herida, 3) Los osteoblastos y los fibroblastos se pueden unir a las membranas de colágeno con independencia de su origen, 4) La forma y el volumen del hueso regenerado puede ser predefinido.17
A pesar de las diferentes membranas de barrera, reabsorbibles o no, nuevas membranas se han desarrollado en un esfuerzo por superar las limitaciones de las utilizadas actualmente. EJ Lee y otros en 2012,18 fabricaron una membrana híbrida colágeno-xerogel de sílice para la ROG. Este xerogel de sílice sintetizado se distribuyó uniformemente dentro de la matriz de colágeno en forma de nanopartículas, y mejoró las propiedades biológicas de la membrana de manera significativa. Sus conclusiones sugieren que el xerogel de sílice-colágeno híbrido se puede usar como una membrana para la ROG, pues su capacidad fue superior a la membrana de colágeno puro.
De la misma manera, CH Lai y otros19 utilizaron un modelo de regeneración ósea guiada en los huesos corticales externos de la bóveda craneal de conejos para evaluar si el uso de una membrana de colágeno cargado con pequeñas dosis de proteína humana-2 morfogenética ósea recombinante (rhBMP-2) aumentaría la regeneración ósea. Sus resultados demostraron que las membranas de colágeno cargadas con pequeñas dosis de rhBMP-2 indujeron la formación de hueso nuevo con mejor cantidad y calidad. Igualmente, SB Lee y otros evaluaron la bioactividad y las propiedades mecánicas de membranas de material compuesto de colágeno reforzadas por quitosano y b--FTC. Al analizarla por microscopia electrónica de barrido, sus resultados mostraron que las propiedades de adhesión celular y mecánicas de las membrana mejoraron con el aumento de â-FTC y el contenido de quitosano. Produjeron niveles adecuados de la adhesión de las células y la estabilidad mecánica adecuada para asegurar una ROG exitosa.20
Por otro lado, injertos de sustitución ósea son ampliamente utilizados para promover la formación de hueso y regeneración periodontal; el injerto de hueso funciona como andamio estructural y matriz para la fijación y la proliferación de los osteoblastos. Múltiples sistemas de clasificación se han utilizado para organizar los injertos de sustitución ósea, incluyendo aloinjetos, xenoinjertos e injertos óseos aloplásticos;21 estos últimos se han utilizado en combinación con las membranas de barrera para lograr la regeneración de tejidos óseos y defectos periodontales. Un estudio reciente de SC Jin y otros en el 2013,22 utilizaron una mezcla de fosfato tricálcico b-FTC y polvo de dientes a distintas proporciones para evaluar la regeneración ósea en modelos de cráneo de conejo. Sus resultados mostraron que hubo nueva formación de hueso alrededor de los márgenes del defecto en los grupos experimentales en comparación con el grupo de control. Esto sugirió que el polvo de diente en combinación con b-FTC puede ser útil en la ROG.
Finalmente, está demostrado que el interés en la promoción de la formación de hueso en defectos óseos ha llevado a los investigadores a combinar el uso de membranas de barreras con otros materiales osteoinductivos y así desarrollar nuevas membranas y andamios con sistemas mejorados para acelerar la regeneración ósea. Los resultados de estas investigaciones parecen ser prometedores; sin embargo, la investigación en este campo sigue en curso, pues la evidencia bibliográfica actual es insuficiente y la necesidad de generar y establecer la «ideal» membrana de barrera e injerto óseo con seguridad y eficacia es alta.
REFERENCIAS BIBLIOGRÁFICAS
1. García-Roco Pérez O, Arredondo López M. Evolución en el tratamiento de la atrofia alveolar. Rev Cubana Estomatol [Internet]. 2002 [citado 920 de octubre de 2013];39(2):234-249. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75072002000200008
2. García-Roco Pérez ON. Distracción osteogénica alveolar con dispositivo simple: Revisión del tema a propósito de un caso. Rev Cubana Estomatol [Internet]. 2006 [citado 920 de octubre de 2013];43(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0034-75072006000300010
3. Peñarrocha M, Uribe R, Balaguer J. Implantes inmediatos a la exodoncia: Situación actual. Med Oral Patol Oral Cir Bucal. 2004;9(3):234-5.
4. Schropp L. Cicatrización ósea y cambios en el contorno de los tejidos blandos tras una exodoncia simple: Estudio clínico y radiográfico prospectivo de 12 meses de duración. Rev Int Odontol Rest Period. 2003;7(4):341-52.
5. Alpiste Illueca FM, Buitrago Vera P, Grado Cabanilles Pd, Fuenmayor Fernandez V, Gil Loscos FJ. Regeneración periodontal en la practica clínica. Med Oral Patol Oral Cir Bucal (Internet). 2006;11(4):382-92. Disponible en: http://scielo.isciii.es/scielo.php?pid=S1698 -69462006000400017&script=sci_abstract
6. Dinatale E, Guercio E. Regeneración ósea guiada (GBR). Revisión de la literatura. Act Odont Ven. 2008;46(4):28.
7. Ochandiano Caicoya S. Relleno de cavidades óseas en cirugía maxilofacial con materiales aloplásticos. Rev Esp Cir Oral Maxilofac. 2007;29(1):21-32.
8. Moreno CS. Tratamiento del alvéolo posextracción. Revisión de la literatura actual. Rev Esp Odontoestomatol Impl. 2009;17(1):7-17.
9. Longoria JAG, de la Garza DR, López AM. Injerto de tejido conectivo inmediato postextracción para corregir defectos vestibulares. Reporte de tres casos. Rev Mex Periodontol. 2012;3(1):24-9.
10. Papadimitriou DE, Geminiani A, Zahavi T, Ercoli C. Sonosurgery for atraumatic tooth extraction: A clinical report. J Prosthet Dent. 2012;108(6):339-43.
11. Tortolini P, Rubio S. Diferentes alternativas de rellenos óseos. Av Periodon Implantol. 2012;24(3):133-8.
12. Giannoudis PV, Faour O, Goff T, Kanakaris N, Dimitriou R. Masquelet technique for the treatment of bone defects: tips-tricks and future directions. Injury. 2011;42(6):591-8.
13. Dimitriou R, Mataliotakis GI, Calori GM, Giannoudis PV. The role of barrier membranes for guided bone regeneration and restoration of large bone defects: current experimental and clinical evidence. BMC Med. 2012;10(1):81.
14. Ogiso B, Hughes FJ, Melcher AH, McCulloch CA. Fibroblasts inhibit mineralised bone nodule formation by rat bone marrow stromal cells in vitro. J Cell Physiol. 1991;146(3):442-50.
15. Chiapasco M, Casentini P, Zaniboni M. Bone augmentation procedures in implant dentistry. Int J Oral Maxillofac Implants. 2009 (24 Suppl.):237-59.
16. Gielkens PF, Schortinghuis J, de Jong JR, Paans AM, Ruben JL, Raghoebar GM, et al. The influence of barrier membranes on autologous bone grafts. J Dent Res. 2008;87(11):1048-52.
17. Behring J, Junker R, Walboomers XF, Chessnut B, Jansen JA. Toward guided tissue and bone regeneration: morphology, attachment, proliferation, and migration of cells cultured on collagen barrier membranes. A systematic review. Odontology. 2008;96(1):1-11.
18. Lee EJ, Jun SH, Kim HE, Koh YH. Collagen-silica xerogel nanohybrid membrane for guided bone regeneration. J Biomed Mater Res A. 2012;100(4):841-7.
19. Lai CH, Zhou L, Wang ZL, Lu HB, Gao Y. Use of a collagen membrane loaded with collagen-targeting recombinant human bone morphogenetic protein-2 for vertical guided bone regeneration. J Periodontol. 2013;84(7):950-7.
20. Lee SB, Kwon JS, Lee YK, Kim KM, Kim KN. Bioactivity and mechanical properties of collagen composite membranes reinforced by chitosan and beta-tricalcium phosphate. J Biomed Mater Res B Appl Biomater. 2012;100B(7):1935-42.
21. Sukumar S, Drizhal I.Bone Grafts in Periodontal Therapy. Acta Medica (Hradec Kralove). 2008;51(4):203-7.
22. Jin S-C, Kim S-G, Oh J-S, Lee S-Y, Jang E-S, Piao Z-G, et al. A Comparative Study of Bone Formation Following Grafting with Different Ratios of Particle Dentin and Tricalcium Phosphate Combinations. J Biomed Nanotech. 2013;9(3):475-8.
Recibido: 8 de noviembre de 2013.
Aprobado: 15 de febrero de 2014.
Dra. Verónica Gómez Arcila. Facultad de Odontología Universidad de Cartagena. Campus de la Salud Zaragocilla. Cartagena, Bolívar, Colombia. Correo electrónico: antoniodiazc@yahoo.com