Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.31 n.3 Ciudad de la Habana sep.-dic. 1997
Comunicación Breve
Empresa Laboratorio Farmacéutico "Dr. Mario Muñoz"Vía alternativa para la síntesis del 3-etilencetal-androsta-3,17-diona
María del Carmen Rodríguez Montero,1 José Manuel Méndez Stivalet2 y Mayra Reyes Moreno1- Aspirante a Investigadora.
- Profesor Titular A. Universidad Nacional Autónoma de México (UNAM). Facultad de Química. División de Estudios de Posgrado, México DF.
RESUMEN
Se reporta una vía alternativa para la síntesis del 3-etilencetal-androsta-3,17-diona, el cual es un intermediario importante para la obtención de corticoides por construcción de la cadena lateral de 17-ceto esteroides. En nuestro caso, partiendo de la androsta-4-ene-3,17-diona, se obtuvo el producto deseado en 3 pasos de síntesis con buenos rendimientos.Descriptores DeCS: VIA ALTERNATIVA DEL COMPLEMENTO; COLESTEROL DESMOLASA; ANDROSTERONA/antagonistas e inhibidores; ANDROSTERONA/síntesis química.
En los últimos años aparecen reportados en la literatura numerosos métodos eficientes para la construcción de la cadena lateral a partir de 17-ceto esteroides.
Un intermediario importante en algunos de los métodos reportados para la síntesis de la cadena lateral es el 3-etilencetal de la androsta-3,17-diona (AD), ya que presenta la función
3-ceto-D4 protegida con un grupo estable en medio básico, manteniendo el grupo en C-17 libre. La obtención de este intermediario es el objetivo de nuestro trabajo.
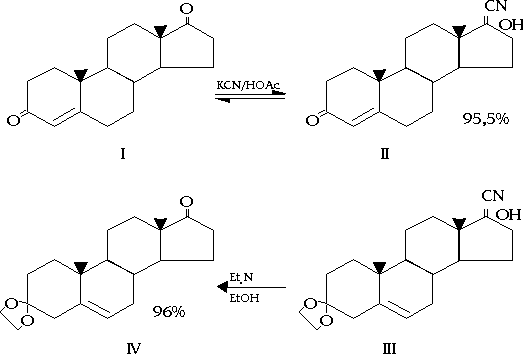
En la literatura1,2 se reporta la conversión directa de 1 en 4 pero con muy bajos rendimientos, pues mayoritariamente se obtiene una mezcla del 3,17-bis cetal, no siendo posible remover selectivamente el cetal en el C-17.
En otra referencia,3 se plantea la conversión de la AD en el 3-monocetal por protección inicial de la cetona en el C-17 como cianohidrina, realizando luego la cetalización del grupo carbonilo en el C-3, seguida de la hidrólisis de la cianohidrina en etanol al 96 % con unas gotas de piridina, pero sin especificar rendimientos ni condiciones de reacción.
Más recientemente se reporta4 la ob-tención de la 9-hidroxi-androst-4-eno- -3,17-diona, por formación de cianohidrina en el C-17, seguida de una cetalización del grupo carbonilo en el C-3 y posterior tratamiento del compuesto obte-nido con solución acuosa de NaOH 2 mol/L, usando metanol 10 % acuoso como solvente a 0 EC. La reacción se completa a las 3 h, con el 92 % de rendimiento.
En nuestro laboratorio estudiamos este método pero partiendo de la AD, la cual es un importante precursor para la construcción de la cadena lateral. Sintetizamos la cianohidrina en el C-17, por reacción del esteroide con KCN/AcOH en MeOH 50 % (acuoso), seguida de la formación del cetal en el grupo carbonilo del C-3 por reacción con etilenglicol, ortoformiato de etilo y ácido metano sulfónico como catalizador. Por último realizamos la hidrólisis selectiva de la cianohidrina y encontramos que en las condiciones empleadas por los autores, en nuestro sustrato la reacción no ocurre, pero si se añade un exceso de solución acuosa de NaOH 2 mol/L y la temperatura se eleva a 5-10 EC, la reacción se completa en 3 h con el 90 % de rendimiento.
Buscando la mejor alternativa para la reacción de hidrólisis selectiva de la cianohidrina en nuestras condiciones, empleamos trietilamina como base y etanol al 96 % como solvente a temperatura de reflujo. La reacción se completa al cabo de las 2 h obteniéndose el 96 % de rendimiento. Una muestra analítica del producto se caracterizó por su pun-to de fusión 201-203 EC (EtOH abs.) (lit. 199-202 EC) y por espectroscopia IR (KBr) 1 730 cm-1 (C = O) 1 090 cm-1 (C ! O). RMN-1H (CDCl3): d0,9 p.p.m. (3H, s, 18-CH3; d1,1 p.p.m. (3H, s, 19CH3); d3,95 p.p.m. (4H, m, OCH2CH2O); d5,4 p.p.m. (1H, d, H6). 13C (CDCl3): (Cquaternarios d221,016; 140,437; 109,303; 47,548; 36,77. CH d31,535; 49,85; 51,766; 121,402. CH2 d20,348; 21,894; 30,67; 31,46; 35,837; 36,268; 41,808; 64,252; 64,445. CH3 d13,568; 18,914).
En la figura se plantea el esquema de síntesis seguido.
En el presente trabajo se logró una variante simple de cetalización selectiva del grupo carbonilo en el C-3 del esteroide, en la que se obtienen altos rendimientos.
SUMMARY
It is reported an alternative pathway for the synthesis of 3-ethylencetal-androsta-3, 17-dione, which is an important intermediary to obtain corticoids for the construction of the lateral chain of 17-ceto steroids. In our case, starting from 4-androstene-3, 17 dione, it was obtained the desired product in a 3-step synthesis with good yields.Subject headings: COMPLEMENT PATHWAY ALTERNATIVE CHOLESTEROL; DESMOLASE; ANDROSTERONE/antagonists and inhibitors; ANDROSTERONA/chemical synthesis.
REFERENCIAS BIBLIOGRÁFICAS
- Herzog HL. Jevnik MA, Tully ME, Hershberg EB. Cyclic ketals of 4-androstene-3,17-dione. J Am Chem Soc 1953;(75):4425-7.
- Gardi R, Ercoli A. Protection of carbonyl and hydroxyl groups. En: Fried J, Edwards JA, eds. Organics reactions in steroid chemistry. New York: Van Nostrand Rienhold Company, 1972:391-2.
- Ercoli A, Ruggieri P. An improved methods of preparing testosterone, dihydrostestosterone ans some of their esters. J Am Chem Soc 1953;(75):650-3.
- Carruthers NI, Garshasb S. Synthesis of corticoids from 9a-hydroxyandrost-4-ene-3,17-dione. J Org Chem 1992;(57):961-5.
Lic. María del Carmen Rodríguez Montero. Empresa Laboratorio Farmacéutico "Dr. Mario Muñoz". Hacendados No. 1, municipio Habana Vieja, Cuidad de La Habana, Cuba.














