Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.32 n.2 Ciudad de la Habana Mayo-ago. 1998
Técnica analítica para el control de calidad de las tabletas de Ribofen 80 mg
Caridad Artau Flaifel,1 Alfredo Fernández Serret2 y Esther Alonso Jiménez3RESUMEN
Se desarrolló una técnica para el control de calidad de las tabletas de ribofen, con el empleo de la espectrofotometría UV y la cromatografía líquida de alta resolución, que incluye la identificación, disolución, uniformidad de dosis y valoración. Las tabletas cumplen con los índices de calidad establecidos en la técnica. Se estudió la especificidad, linealidad, precisión, exactitud, y se corroboró la validez de estos parámetros en ambos métodos.Descriptores DeCS: AGENTES ANTIRREUMATICOS/análisis; ACIDOS ANTRANILICOS/análisis; AGENTES ANTIINFLAMATORIOS NO ESTEROIDES/análisis; ESPECTROFOTOMETRIA ULTRAVIOLETA/métodos; CROMATOGRAFIA LIQUIDA DE ALTA PRESION/métodos; CALIDAD DE LOS MEDICAMENTOS; QUIMICA FARMACEUTICA; CONTROL.
El carfenil, cuyo principio activo es el lobenzarit disódico, es un producto que aparece reportado en la Farmacopea Japonesa. En Cuba, ha sido sintetizado por el Departamento de Síntesis Orgánica del Centro de Química Farmacéutica con el nombre de ribofen y se corresponde con la sal disódica del ácido ((2 carboxifenil) amino) 4 clorobenzoico, el cual es considerado como un agente inmunomodulador antirreumático, analgésico y antiinflamatorio. Este medicamento se presenta en el mercado en forma de tabletas de 40 y 80 mg.1-4
Se encontraron algunos estudios realizados al lobenzarit disódico por espectrofotometría UV-visible en agua, metanol, y en soluciones buffer de pH 6 y 10, los cuales muestran sus espectros ultravioletas, así como reportes de estudios hechos por cromatografía líquida de alta resolución al lobenzarit disódico y a productos de actividad y estructura análoga a él, en diferentes condiciones de trabajo.1,5
En el análisis espectrofotométrico cuantitativo el compuesto que se ha de ensayar o su derivado debe tener una absorción de suficiente intensidad para tener utilidad, por lo que es necesario también que la muestra no esté contaminada con sustancias capaces de interferir.6
La cromatografía líquida moderna es un método usado para la separación de los componentes de una muestra, en la cual dichos componentes se distribuyen en 2 fases, una de las cuales es estacionaria, mientras la otra se mueve mediante el empleo de altas presiones a través de la columna, teoría que se conoce como cromatografía líquida de alta resolución (HPLC), empleada para llevar a cabo diferentes ensayos como la identificación, purificación y cuantificación.7
Una vez desarrollado un método de análisis deberá validarse, es decir, someterse a un proceso establecido para obtener pruebas convenientemente documentadas y demostrativas de que un proceso de fabricación o método analítico es lo suficientemente fiable para producir el resultado previsto dentro de intervalos definidos, mediante el cumplimiento de diferentes parámetros, como selectividad, linealidad, precisión, exactitud, límite de detección, límite de cuantificación y robustez, reportados en la USP XXII y en la monografía española.8,9
El presente trabajo estuvo dirigido a desarrollar una técnica de análisis para el control de la calidad de la producción de las tabletas de ribofen, que incluye identificación, ensayo de disolución, uniformidad de dosis y valoración del principio activo, así como la validación de la técnica.
MÉTODOS
Todos los reactivos empleados fueron de calidad pura para análisis, la materia prima utilizada fue suministrada por el Centro de Química Farmacéutica y estandarizada por el Departamento de Sustancias de Referencias de los laboratorios del Centro de Investigación y Desarrollo de Medicamentos (CIDEM).Las tabletas analizadas se identificaron según los lotes 3006, 3008 y 3009, y se fabricaron en el Departamento de Formas Terminadas de los laboratorios del CIDEM.
Se evaluó la especificidad de ambos métodos mediante la preparación de una muestra placebo, y en el caso del método cromatográfico se prepararon además soluciones de los productos de partida (ácido antranílico y el ácido 2,4 diclorobenzoico) en concentraciones de 5 mg/mL y de lobenzarit disódico a 16 mg/mL.
Se comprobó la linealidad tanto del método cromatográfico como del espectrofotométrico mediante la verificación del cumplimiento de la ley de Lambert-Beer, en un rango de concentraciones de 2,0-20,0 mg/mL.
Se realizó la determinación de la precisión de los métodos, se estudió la repetibilidad sobre la base del resultado de 10 determinaciones, con el 100 % de la concentración teórica y se efectuaron valoraciones por 2 analistas, en 2 d diferentes para comprobar la reproducibilidad de los métodos.
Para el estudio de la exactitud, se empleó el método de recuperación, mediante la preparación de muestras con diferentes niveles de lobenzarit disódico que representan el 80, 90, 110 y 120 % de la concentración teórica del principio activo en la tableta, según la formulación propuesta.
La identificación y valoración de las tabletas de ribofen se desarrollaron por HPLC.
Se decidió desarrollar una técnica analítica y emplear la fase móvil que se describe a continuación.
Como fase móvil se mezclan 650 mL de buffer fosfato 0,2 mol/L y 350 mL de metanol, se ajusta el pH a un valor de 7,4 + 0,1, con un flujo de 1 mL/min. La detección se llevó a cabo a 225 nm y se empleó una columna Lichrosorb RP-18 de 5 mm y de 250 x 4 mm ID. Para el registro de los cromatogramas se utilizó un procesador de datos Shimadzu CR6A.
En la preparación de la solución de referencia, se pesó una cantidad determinada de muestra de referencia a fin de obtener una solución de concentración de 16 mg/mL, mientras que para la solución de ensayo se pesó la cantidad de polvo de tableta equivalente a 80 mg de lobenzarit disódico, teniendo en cuenta su peso promedio, se trasvasó a un matraz aforado de 100 mL y se diluyó en agua hasta volumen, se filtró y se centrifugó, se extrajo una alícuota con posterior dilución en fase móvil hasta obtener la concentración antes mencionada; posteriormente se inyectaron ambas soluciones en el cromatógrafo y se calculó el contenido de lobenzarit disódico.
La disolución y uniformidad de dosis se realizaron por espectrofotometría UV según los requerimientos generales descritos en la USP XXII y en el Hanbook de disolución.8,10
Se evaluó el perfil de disolución de las tabletas de producción nacional (ribofen) y se comparó con el perfil de disolución de las tabletas de importación (carfenil); como medios de disolución se utilizaron agua, jugo gástrico y jugo intestinal simulado sin enzimas.8 Para ello se empleó un disolutor de 6 plazas Erweka DT6 RE.
Para preparar la solución de referencia se pesó una cantidad de muestra de lobenzarit disódico, y se obtuvo una solución con 8 mg/mL de concentración.
En la técnica se estableció como medio de disolución agua destilada (900 mL) y paletas operadas a una velocidad de 75 min-1. Transcurrido un tiempo de 45 min, se tomaron 20 mL de muestra y se realizó una dilución hasta obtener igual concentración que la referencia. Se midió la absorbancia en un espectrofotómetro UV a una longitud de onda de 300 nm, en celdas de cuarzo de 1 cm, para lo cual se empleó agua destilada como blanco.
Para la uniformidad de dosis se pesó una determinada cantidad de muestra de referencia con la finalidad de lograr una concentración de 12 mg/mL. En la preparación de la muestra de ensayo se colocó cada tableta en un matraz aforado de 250 mL que contenía 120 mL de agua, se sometió a agitación mecánica y se llevó a volumen. Se filtró y se centrifugó con posterior dilución hasta obtener la concentración antes mencionada. Se midió la absorbancia en un espectrofotómetro UV a una longitud de onda de 300 nm, en celdas de cuarzo de 1 cm, con el empleo de agua destilada como blanco.
RESULTADOS
MÉTODO ESPECTROFOTOMÉTRICO
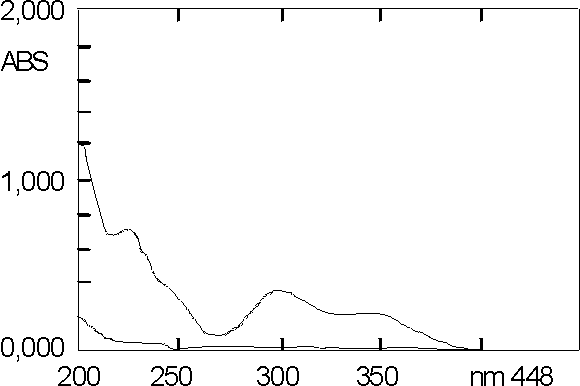
Los espectros UV de las soluciones de lobenzarit disódico en agua, en un intervalo de concentración comprendido entre 2,0 y 20,0 mg/mL, mostraron 2 máximos; el primero en la región de 222 a 225 nm y el segundo en la de 298 a 300 nm.En la figura 1, la curva A representa el espectro de absorción de una solución de muestra placebo y la B el espectro de absorción de la solución de ensayo. En la zona de máxima absorción a 300 nm, la solución de muestra placebo no presenta absorción, mientras que en la zona a 225 nm, se observa una ligera absorción del placebo.
La curva de calibración a 300 nm se confeccionó en un rango entre 2,0 y 20,0 mg/mL. La ecuación de la recta se expresó según y = 0,0405 x -0,000051 con un coeficiente de correlación lineal de 1,0008. Al aplicar el test de significación del intercepto, éste resultó ser no significativo, ya que la t calculada fue menor que la t tabulada (t60,975) (0,013 < 2,45).
El estudio de repetibilidad arrojó un valor promedio de 103,4 %, una desviación estándar de 1,36 y un coeficiente de variación de 1,32 %.
El estudio de reproducibilidad mostró un valor promedio de 102,1 %, una desviación estandar de 1,08 y un coeficiente de variación de 1,05 %.
Al aplicar la prueba de significación de F, la Fexperimental < Ftabulada (1,30 < 2,79), expresa que no existe diferencia significativa entre la precisión alcanzada por los analistas. Al realizar la prueba de significación de Student, la texperimental< ttabulada (0,668 < 2,07), nos indica que no existe diferencia significativa entre las medias obtenidas por los analistas. El intervalo de confianza para el 95 % de probabilidad resultó ser igual a 102,1 ± 0,5.
Los resultados del estudio de la exactitud mostraron un recobrado promedio de 100,70 %, con un coeficiente de variación de 0,65 %, una curva de recuperación expresada por la ecuación y=1,03 x - 1,77 y un coeficiente de correlación de 0,9926. Al aplicar el test de significación de la pendiente, la t calculada fue menor que la t tabulada (t20,975) (2,04 < 4,30), por lo que demostró ser no significativo.
MÉTODO CROMATOGRÁFICO
En la figura 2 se muestran los cromatogramas del ácido antranílico (A), con un tr de 2,2 min; del ácido 2,4 diclorobenzoico (B), con un tr de 3,9 min; de la solución mezcla de ambos con el lobenzarit disódico (C), con un tr de 7,1 min para este último, y para el caso de la muestra placebo (D), no se observó ninguna señal en la zona de elución del principio activo, a la longitud de onda de 225 nm.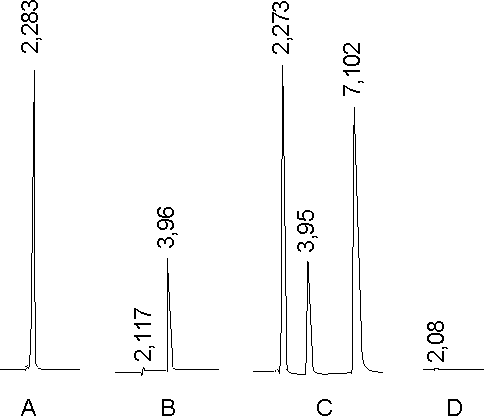
5 mg/mL con lobenzarit disódico 16 µg/mL (C) y solución placebo (D).
La curva de calibración a 225 nm se realizó en un rango de 2,0 - 20,0 mg/mL. La ecuación de la recta se expresó según y = 160715,66 x - 69339,78, con un coeficiente de correlación lineal de 0,9991. Al aplicar el test de significación del intercepto, éste resultó ser no significativo, ya que la t calculada fue menor que la t tabulada (t60,975) (0,019 < 2,45).
El estudio de repetibilidad arrojó un valor promedio de 104,3 %, una desviación estándar de 0,42 y un coeficiente de variación de 0,39 %.
El estudio de la reproducibilidad mostró un valor promedio de 103,4 %, una desviación estándar de 1,45 y un coeficiente de variación de 1,40 %. Al aplicar la prueba de significación de F, la Fexperimental < Ftabulada (1,14 < 2,79), indicó que no existe diferencia significativa entre la precisión alcanzada por los analistas. Al realizar la prueba de significación de Student, la texperimental < ttabulada (0,833 < 2,07), mostró que no existe diferencia significativa entre las medias obtenidas por los analistas. El intervalo de confianza para el 95 % de probabilidad fue de 103,4 ± 0,6.
Los resultados del estudio de la exactitud mostraron un recobrado promedio de 101,15 % y un coeficiente de variación de 0,57 %. La curva de recuperación se expresa según y = 1,008 x + 0,25, con un coeficiente de correlación de 0,9990. Al aplicar el test de significación de la pendiente, la t calculada fue menor que t tabulada (t20,975) (0,37 < 4,30), lo que resultó ser no significativo.
Los resultados analíticos de los ensayos realizados a los lotes estudiados se exponen en la tabla.
| Ensayos realizados | 3006 | 3008 | 3009 | Límite |
| Identificación | Tr=7,455 | tr=7,634 | tr=7,567 | El tr del pico correspondiente a la muestra y referencia coinciden en ± 5 % |
| Disolución* (%) | 105,3 | 107,1 | 101,8 | En 45 min debe disolverse el 80 % |
| Uniformidad de Dosis**(%) | 101,9 | 101,7 | 103,8 | 85,0-115,0 |
| Valoración (%) | 101,5 | 103,9 | 109,2 | 90,0-110,0 |
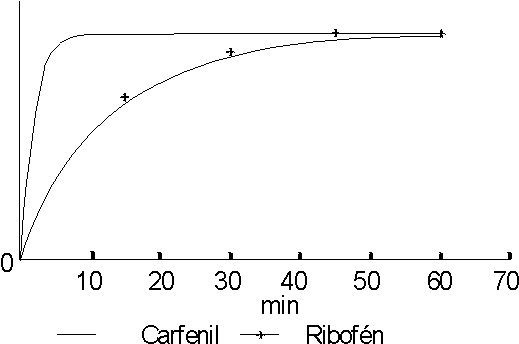
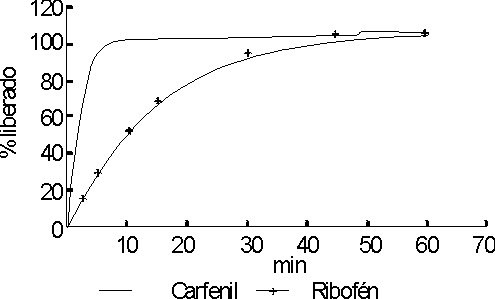
En las figuras 3 y 4 se muestran los perfiles de disolución de ambas tabletas en agua y jugo intestinal respectivamente. En jugo gástrico no se observó la disolución del principio activo.
DISCUSIÓN
MÉTODO ESPECTROFOTOMÉTRICO
Los máximos de absorción registrados en los espectros UV de las soluciones de lobenzarit disódico coinciden con los reportados por Suzuki, Kikuchi y Morita,1 y nos permite seleccionar la longitud de onda de trabajo.Los resultados mostrados en la figura 1 reafirman la especificidad del método, ya que la ausencia de absorción del placebo a 300 nm no constituye interferencia en el análisis, y nos permite evaluar el medicamento a esa l . Sin embargo, la ligera absorción del placebo a 225 nm, impide la evaluación de la muestra a dicha longitud de onda.
La ecuación de la recta y el coeficiente de correlación lineal obtenido de la curva de calibración demuestran el cumplimiento de la ley de Lambert-Beer y unido al resultado del test del intercepto corroboran la linealidad de éste.
Los valores expuestos en la repetibilidad y en la reproducibilidad y sus coeficientes de variación < 3 % demuestran la precisión del método.
El valor del recobrado promedio, la ecuación de la curva, unido al coeficiente de correlación cercano a la unidad y el del test de la pendiente corroboran la exactitud y linealidad de éste.
MÉTODO CROMATOGRÁFICO
Lo mostrado en la figura 2 demuestra la especificidad, al no existir interferencias en la identificación y cuantificación del principio activo en presencia de los productos de partida y los excipientes de la formulación. Además a 225 nm el principio activo presenta un máximo de absorción, el cual coincide con una máxima sensibilidad de detección de los productos de partida utilizados en la síntesis del lobenzarit disódico.De la curva de calibración, su ecuación y su coeficiente de correlación podemos demostrar el cumplimiento de la ley de Lambert-Beer, unido al resultado del test del intercepto corroboran que el método es lineal.
Los valores de la repetibilidad y la reproducibilidad mostrados y sus coeficientes de variación < 2 % demuestran su precisión.
El valor del recobrado promedio, la ecuación de su curva de recuperación, su coeficiente de correlación cercano a la unidad, unido al resultado del test de la pendiente reafirman la exactitud y linealidad del método.
Los resultados que se muestran en la figura 1, nos indican que cumplen con los índices de calidad establecidos, según las Normas de Calidad para el producto.
En los resultados que se exponen en las figuras 3 y 4, podemos observar que la velocidad de disolución del principio activo es mayor en las tabletas de carfenil que en las de ribofen, para los medios agua y jugo intestinal. Tampoco se observan diferencias apreciables entre los perfiles de disolución en ambos medios.
En conclusión, se desarrolló una técnica analítica que permite controlar la calidad de la producción de las tabletas de ribofen, mediante el empleo de los métodos espectrofotométricos y cromatográficos, y se demostró la especificidad, linealidad, precisión y exactitud de ambos métodos.
SUMMARY
A technique for the quality control of ribofen tablets was developed by using UV spectrophotometry and high pressure liquid chromatography, including identification, dissolution, dose uniformity and valuation. Specificity, lineality, precision and accuracy were studied and the validity of these parameters was corroborated in both methods.Subject headings: ANTIRHEUMATIC AGENTS/analysis; ANTHRANILIC ACIDS/analysis; ANTI-INFLAMMATORY AGENTS, NON-STEROIDAL/analysis; SPECTROPH0TOMETRY, ULTRAVIOLET/methods; CHROMATOGRAPHY, HIGH PRESSURE LIQUID/methods; DRUG QUALITY; CHEMISTRY, PHARMACEUTICAL; QUALITY CONTROL.
REFERENCIAS BIBLIOGRÁFICAS
- Suzuki Y, Kikuchi M, Morita T. Physical chemical propieties and stability of dissolution Lobenzarit. Iyakuchi Kenkyu 1984;15(2):201-5.
- Chemical Substance Index. New York: Russel and Rowlet; 1990; vol 113:1685.
- The Index Merck. 11 ed. New Jersey: Merck and Company; 1989;873.
- Martindale W. The extra pharmacopoeia. 29 ed. London: The Pharmaceutical Press; 1989;1584.
- Lin CK, Lee CS, Rerrin JH. Determination of two fenamates in plasma by high performance liquid chromatography. J Pharm Sci 1980;69:95-7.
- Connors KA. Curso de análisis farmacéutico. Barcelona: Ed. Revert; 1981;195-245.
- Quattrocchi O, Albelaira S, Laba R. Introducción a la HPLC. Aplicación y práctica. Buenos Aires: Artes Cráficas Faro; 1992;3-6.
- United States Pharmacopoeia 22 and National Formulary 17. Rockville: United States Convention: 1990;1617, 1697, 1710-2.
- Castro M, Gascón S, Pujol M, Sans JM, Pla LV. Asociación Española de Farmacéuticos de la Industria. Validación de Métodos Analíticos. Monografía Madrid: AEFI; 1989.
- Hanson WA. Handbook of dissolution testing. 2 ed. Oregon: Aster Publishing; 1991:28-41.
Lic. Caridad Artau Flaifel. Centro de Investigación y Desarrollo de Medicamentos. Ave 26 No. 1605 entre Rancho Boyeros y Calzada del Cerro, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1 Licenciada en Ciencias Farmacéuticas.
2 Licenciado en Química. Investigador Agregado.
3 Técnica en Tecnología Farmacéutica.














