Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.32 n.3 Ciudad de la Habana sep.-dic. 1998
Productos Naturales
Facultad de Farmacia y Alimentos. Universidad de La HabanaUtilización de quitina en formas farmacéuticas. I Ungüento
Ofelia Bilbao Revoredo,1 Sol A. Fernández Monagas,2 Olga M. Nieto Acosta,1 Ruth D. Henríques Rodríguez3- Doctora en Ciencias Farmacéuticas. Profesora Titular.
- Licenciada en Química. Profesora Auxiliar.
- Doctora en Ciencias. Profesora Titular.
Resumen
Se realizó un estudio tecnológico en la forma farmacéutica ungüento, para lo cual se empleó quitina como principio activo. Se utilizaron 2 tipos de base, oleosa e hidrosoluble, la primera con mejores características. Se estudiaron la liberación in vitro del fármaco, así como la cinética de este proceso, y se llegó a la conclusión de que el mayor porcentaje de quitina liberada fue en base oleosa. Se siguió en ambos casos una cinética de orden cero.Descriptores DeCS: QUITINA/aislamiento y purificación; BASES OLEOSAS; POMADAS; TECNOLOGIA FARMACEUTICA; QUIMICA FARMACEUTICA.
La quitina es un polímero de amplia aplicación industrial en países desarrollados. En los últimos años la literatura más actualizada señala su utilización con fines biomédicos.1-4
Los estudios de preformulación realizados permitieron la preparación de medicamentos terapéuticamente estables, al incorporar la quitina a una forma farmacéutica semisólida mediante el desarrollo de una tecnología que garantiza la liberación de este principio activo de la forma más eficaz.
Se realizó la evaluación de la quitina en la forma farmacéutica ungüento en 2 tipos de bases seleccionadas, considerando su relación con las características fisico-químicas del fármaco y su diferente grado de penetración en la piel.
Mediciones penetrométricas, de extensibilidad y adhesividad corroboraron la calidad tecnológica de ambas bases; se destacó la oleosa como la de mejores condiciones (Uraldes L. Aspectos tecnológicos y biofarmacéuticos de quitina en preparaciones semisólidas. Tesis de Diploma. Universidad de La Habana, 1986).
Se realizaron estudios de liberación del fármaco mediante consideraciones de aspectos fisiológicos concernientes a la vía percutánea, y se estudió la cinética del proceso.
Métodos
La quitina empleada fue suministrada por los laboratorios "Mario Muñoz" del Ministerio de Salud Pública (MINSAP), donde se procesa a escala semiindustrial a partir de carapachos de langostas, según el procedimiento desarrollado por Henríques y Nieto.5 En la elaboración de los ungüentos se utilizó quitina purificada y llevada a polvo fino, con un tamaño de partícula de 160 µm.Se emplearon 2 tipos de base:
Base oleosa: petrolato sólido (BDH); aceite mineral (BDH).
Base hidrosoluble: polietilenglicol 400 (BDH); polietilenglicol 4 000 (BDH).
Para la base oleosa se utilizó el método de preparación de incorporación y para la hidrosoluble el de fusión.
Mediciones penetrométricas. Se utilizó un penetrómetro Erweka, alemán. Las mediciones se realizaron a 25 °C.
Medición de extendibilidad. Se tomaron 2 láminas de vidrio de 12 x 15 cm, se colocó una de ellas sobre un papel milimetrado y se adicionó en un punto predeterminado aproximadamente 2 g del semisólido a ensayar. Sobre éste se colocó la otra lámina de vidrio de 404,05 g de peso. A los 5 min exactamente se midió la distancia del punto de aplicación del semisólido a los bordes de la lámina, en 4 direcciones perpendiculares entre sí y se determinó el área de la circunferencia mediante la fórmula siguiente:
A = d1d2/4
donde:
d1 y d2 : diámetros perpendiculares de la figura formada (mm).
Determinación de adhesividad. Para determinar el tiempo de deslizamiento en lámina se colocó 1,5 g del semisólido en un cilindro plástico de 15 mm de diámetro, 8 mm de altura y 1 g de peso.
El cilindro se puso sobre una lámina de vidrio de 20 x 20 mm, con un papel milimetrado, de modo que no tocara la superficie del vidrio; se colocó la lámina con un ángulo de inclinación de 45 °C. Se midió el tiempo que demora este sistema en deslizarse a una distancia de 100 mm.
Para determinar el coeficiente de fricción estático se preparó la muestra de la misma forma, se inclinó la lámina paulatinamente hasta alcanzar un ángulo en el cual se comienza a notar un movimiento del cilindro. En estas condiciones se cumple que:
P: peso del cilindro
f : coeficiente de fricción
q: ángulo mínimo al cual comienza el deslizamiento
Determinación cuantitativa de la quitina. Se empleó el método reportado por Snell y otros (1961) y modificado por O. Pupo (Evaluación de quitina en preparaciones semisólidas. Tesis de Diploma. Universidad de La Habana, 1985), con la utilización de un espectrofotómetro UV-Visible Unicam SP 1800.
Método de liberación in vitro. En el estudio de los perfiles de liberación se emplearon los métodos de placa de gel radial y lineal para los ungüentos que tenían una dosis de quitina del 5 %, ya que esta vía de administración presenta una alta complejidad en la detección de pequeñas cantidades de sustancias activas, por factores que le resultan inherentes. La simulación de las características fisiológicas de la piel se realizó mediante una solución de gelatina al 15 %.
Resultados
La evaluación de los ungüentos preparados con 3 niveles de dosis y 2 tipos de bases resultó ser adecuada desde el punto de vista organoléptico y químico-físico.Las tablas 1 y 2 reflejan los resultados obtenidos para estos semisólidos; puede señalarse la coincidencia en todos los casos de valores superiores y de mayor confiabilidad estadística para la base oleosa.
| | ||
| | | |
| | | |
| | | |
| | | |
| | ||
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
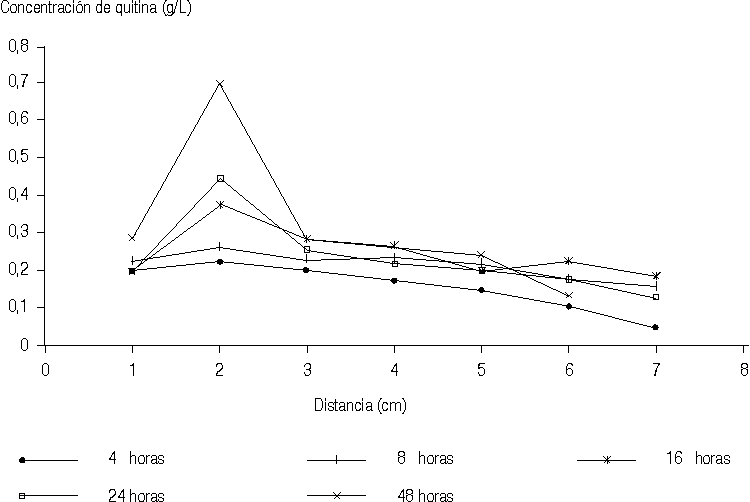
Como se puede observar en la figura 1 los gráficos obtenidos para la difusión lineal en base oleosa, no muestran el comportamiento esperado, que sería la disminución gradual de la concentración de quitina según aumenta la distancia a la zona de aplicación del ungüento.
Los resultados correspondientes a la difusión lineal en base hidrosoluble aparecen en la figura 2.

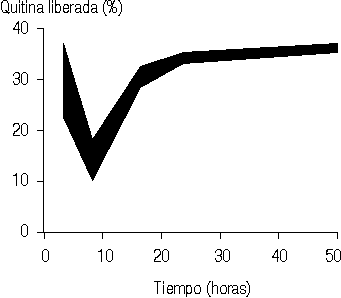
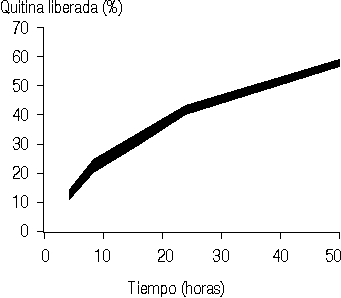
El perfil de liberación para la base hidrosoluble estudiado por el método lineal (fig. 3) muestra un comportamiento anómalo que sugiere una vez más la presencia de interacciones base-fármaco-gelatina. Los porcentajes obtenidos para la liberación de la quitina por el método lineal son inferiores a los correspondientes al método radial (fig. 4).
Una vez obtenidos estos resultados fue posible determinar el orden correspondiente a la cinética de liberación de la quitina para ambas bases (métodos radial).
Los valores obtenidos para los coeficientes de correlación lineal y de determinación se muestran a continuación:
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
Discusión
Los resultados presentados en la figura 1 sugieren que la base oleosa se difunde en la gelatina hasta una distancia de 2 cm -donde se obtiene un valor máximo para la concentración de quitina- a partir de la cual comienza a ser liberado el fármaco de forma gradual.Los resultados que se muestran en la figura 2 indican que la base hidrosoluble interactúa de alguna forma con la gelatina empleada como medio para la difusión, así como con la sustancia empleada como principio activo, lo cual provoca que se observen concentraciones crecientes de quitina a medida que aumenta la distancia a la zona de aplicación. Este comportamiento difiere para un tiempo de difusión de 4 h, por lo que podría pensarse que éste es un corto tiempo de interacción base-fármaco-gelatina, por lo que a partir de la distancia de 7 cm comienza a ser liberada la quitina de forma gradual, disminuyendo su concentración en la medida que aumenta la distancia a la zona de aplicación.
La diferencia obtenida para liberar la quitina, en base hidrosoluble, por los métodos lineal y radial resulta lógica dada la diferencia que existe entre las formas de difusión para ambos métodos, por lo que es evidente que en el estudio de liberación de este fármaco a partir de la forma farma-céutica empleada es más conveniente la utilización del método de placa de gel radial.
Sobre la base de los valores obtenidos para los coeficientes de correlación y determinación, es posible asignar un orden cero a la liberación de la quitina de ambos ungüentos. Las constantes aparentes de velocidad de liberación calculadas a partir de los gráficos tienen valores de 5.10-3 g/L para la base oleosa y de 13.10-3 g/L para la base hidrosoluble.
En conclusión los ungüentos que contienen quitina como principio activo, preparados con base oleosa, presentan buenas características tecnológicas, superiores a las correspondientes a la base hidrosoluble, así como una mayor liberación del fármaco, corroborada por los perfiles de liberación in vitro.
Summary
A technological study of pharmaceutical form ointment was undertaken for which chitin was used as an active agent. Two types of base were used: oinment and water-soluble; the former presented better characteristics. Drug release in vitro and the kinetics of this process were studied so it was concluded that the higher percentage of chitin was released in oinment. Zero kinetics was followed in both cases.Subject headings: CHITIN/isolation & purification; OINTMENT BASES; OINTMENT, TECHNOLOGY, PHARMACEUTICAL; CHEMISTRY; PHARMACEUTICAL.
Referencias Bibliográficas
- Balassa P, Pruden JF. Applications of chitin and chitosan in wound healing acceleration. En: Muzzarelli RAA, Pariser ER, eds. Proceeding of the First International. Conference on Chitin and Chitosan. M.I.T.S.G. 78-7, Cambridge: sn, 1978:296-305.
- Hirano S. Chitin and chitosan for use as a novel biomedical material. Polym Mater Sci 1985;53: 649-53.
- Suzuki S, Okawwa Y, Okura Y, Hashimoto K, Suzuki M. Inmunoad juvant effects of chitin and chitosan. En: Hirano S, Tokura S, eds. Proceeding of Second International Conference on Chitin and Chitosan. Tottori: The Japanese Society of Chitin and Chitosan, 1982:210-2.
- Itroi H. Pharmaceutical containing chitin or chitosan in control of peridontal disease (Lion Carp.) Japan, Kokai Tokyo Koho; (85-07-29) Pat. No. 85142923 (60) 14-2923 Int. Class; A 61 K-031/73. Appl: JP 83/247994 (83-12-28). (Chem Abst Vol. 104 No. 10, 075015L. Chem Abst Patent 040750-5).
- Henríques RD, Nieto OM. Método para la obtención de quitina suficientemente pura. C 08 B 37/08. Solicitud de Patente No. 34222 (06.03.75). Boletín Oficial de la Oficina Nacional de Invenciones. Información Técnica y Marcas No. 62, 1976. Certificado de concesión No. 20760 (01.07.80);1980.
Dra. Ofelia Bilbao Revoredo. Instituto de Farmacia y Alimentos. Universidad de La Habana.. San Lázaro y L, El Vedado, municipio Plaza de la Revolución, Ciudad de La Habana Cuba.














