Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.33 n.2 Ciudad de la Habana Mayo-ago. 1999
Laboratorio de Investigaciones de SIDA
Inactivacion de virus ADN envueltos en la producción de hemoderivados (Albúmina e Inmunoglobulinas)
Ignacio Juan Ruibal Brunet,1 Enrique Noa Romero,2 Regina Zonia Martín García,3 Nibaldo Luis González Sosa4 y Ana Teresa Ramírez Mas5Resumen
Se estudió la inactivación del virus herpes simple humano tipo 1 como modelo de virus ADN envueltos, durante las etapas de producción de las inmunoglobulinas intramuscular e intravenosa y la albúmina humana, las etapas del método de fraccionamiento alcohólico para la obtención de estos productos, así como los métodos de remoción y/o inactivación introducidos en el proceso de manufactura, pasteurización y cromatografía de intercambio iónico. El virus se cuantificó por efecto citopático. La obtención de valores de reducción acumulativos reportados en este trabajo demuestran que el método de fraccionamiento alcohólico utilizado en Cuba como variante del método de Cohn-Oncley, combinando métodos de inactivación/remoción, produce un nivel de inactivación de virus ADN envueltos que garantiza una alta seguridad biológica de estos productos para su uso en humanos.Descriptores DeCS: ADN VIRAL; HERPES VIRUS 1 HUMANO; ALBUMINA SERICA; INMUNOGLOBULINAS; COMPOSICION DE MEDICAMENTOS.
Los hemoderivados son fabricados a partir de la sangre humana, considerada como una fuente de materia prima variable con respecto a la contaminación viral, porque no existe un total control sobre los virus contaminantes, por lo que ha sido necesario conocer el nivel de inactivación viral de los procesos de fabricación de los derivados sanguíneos, para lo que se han utilizado diferentes modelos virales, entre los que se incluyen los herpesvirus como modelo de virus ADN envueltos.1,2
La familia Herpesviridae está formada por un grupo de virus con amplia diseminación en la naturaleza; se ha reportado la transmisión de ellos a través de la sangre y órganos trasplantados.3 La seroprevalencia de estos virus en la población humana adulta es muy alta, lo que hace ilógico el pesquisaje de anticuerpos a nivel de bancos de sangre.
El virus de la hepatitis B (VHB) es un virus ADN-envuelto que no se ha podido cultivar y se han utilizado los herpesvirus como modelos para los estudios de inactivación. A pesar de que el VHB puede ser detectado en el donante mediante la detección del antígeno de superficie, existe el riesgo de contaminación en la fabricación de los hemoderivados.4
La obtención de la albúmina humana y las inmunoglobulinas intramuscular e intravenosa (IgG im/iv) se fundamenta en una variante tecnológica del método de Cohn-Oncley basado en el fraccionamiento de las proteínas del plasma utilizando el etanol.5,6
La importancia de estos productos biológicos en el campo de la hemoterapia clínica ha hecho necesario medir la capacidad de inactivación o remoción viral de las diferentes etapas de fabricación, así como de los métodos de inactivación introducidos deliberadamente en la producción, teniendo en cuenta además las limitaciones de los estudios de pesquisaje a nivel de banco.1,2
El objetivo de este trabajo es conocer la capacidad de inactivación/remoción del virus herpes simple humano tipo 1 (VHS-1), modelo de virus ADN envueltos, en los procesos de producción de las IgG im/iv y la albúmina humana purificada.
Métodos
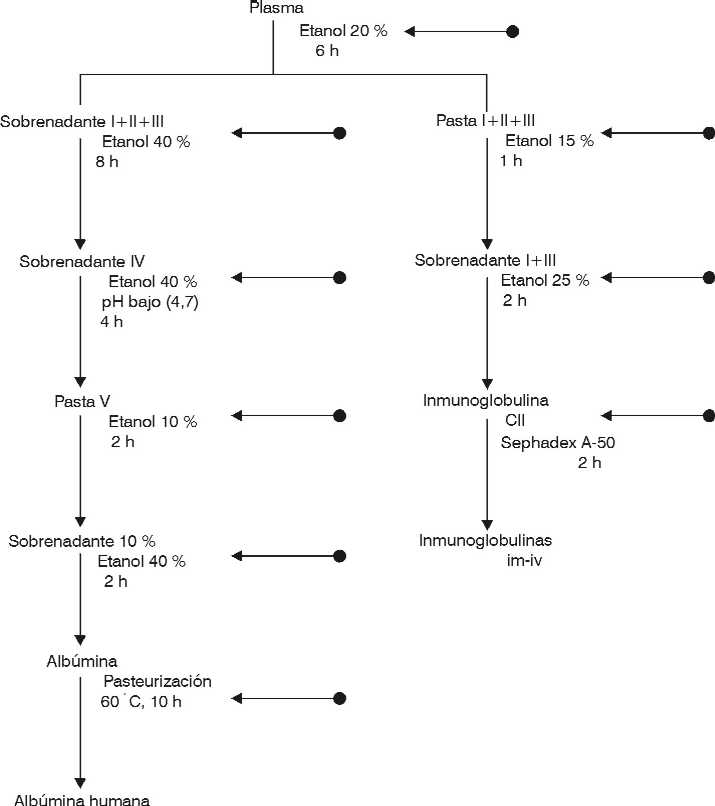
Colección y características del plasma. La mezcla de plasma utilizado en el estudio de inactivación se preparó a partir de 15 donaciones de sangre de diferentes bancos de sangre de Cuba. Cada donación fue negativa para antígeno de superficie del virus de la hepatitis B (Ags VHB), no reactivo para anticuerpos al virus de la inmunodeficiencia humana tipo 1 y 2 (VIH-1 y VIH-2) y al virus de la hepatitis C (VHC), y negativo a pruebas de neutralización de anticuerpos al VHS-1.Fraccionamiento del plasma. Se utilizó el método de fraccionamiento alcohólico de Cohn modificado por Cádiz A y otros,7 para el proceso de purificación de albúmina humana e IgG im/iv. Los estudios se realizaron a pequeña escala de acuerdo con el esquema tecnológico (fig. 1).
Sistema virus-célula. La cepa de VHS-1 se propagó en la línea de celular de riñón de mono verde africano (Vero), cultivada en medio MEM (Gibco) suplementado con suero fetal bovino (Gibco) al 5 %, 2 mM de L-glutamina (Flow) y 40 mg/mL de gentamicina (Pharmacia), incubada a 37 oC en atmósfera húmeda, con 5 % de CO2.
El virus se inoculó a una multiplicidad de infección de 1 (MOI=1), y se cosechó a las 72 pos-infección; posterior a la alícuota se almacenó a 85 oC.
Titulación del inóculo viral. La infectividad viral se realizó por un método de microtitulación en placas de 96 pozos.8 Las células se inocularon con diluciones seriadas del inóculo viral resuspendidas en medio MEM suplementado.
Se efectuaron 6 réplicas de cada dilución y un control celular fue establecido. La prueba se incubó a 37 oC en atmósfera húmeda durante 5 d, con un cambio de medio al 3er d. La producción viral se cuantificó por efecto citopático (ECP) de formación de sincicios o muerte celular aislada.
Los cálculos de la dosis infectiva media de cultivo de tejido (DICT50/mL) se realizó con la utilización del ECP, y se definió por el método de Reed y Muench, como la cantidad del inóculo viral capaz de matar al 50 % de los cultivos.9
Estudio de la inactivación/remoción viral. Las etapas retadas durante la purificación de albúmina humana e inmunoglobulinas son resaltadas mediante flechas en la figura 1. Los estudios se realizaron por triplicado y bajo las condiciones descritas anteriormente. Cada etapa se desafió con una alta concentración de virus.
Se realizaron estudios cinéticos de inactivación durante el fraccionamiento alcohólico y la pasteurización; se tomaron 2 muestras antes y después de la adición del virus. En la etapa de purificación de las inmunoglobulinas por Sephadex A-50 se determinó la carga viral antes y después del proceso.
Las muestras obtenidas de estas etapas se dializaron toda la noche contra solución salina 0,9 % a 4 oC, comprobándose la no presencia de etanol mediante ensayos cualitativos; las muestras se filtraron y se midió la infectividad viral inmediatamente.
Ensayo de infectividad. Las muestras dializadas fueron tituladas por el método descrito anteriormente;8,9 se incluyó por cada placa de titulación además de un control celular un control de la cepa empleada para el estudio. El ensayo de infectividad presenta un límite de detección de 101.301 DICT50/mL.
Los factores de reducción (FR) se calcularon por la fórmula:2
V1 x T1
10FR = ------------
V2 x T2
donde:
T1 = Concentración viral al inicio de la etapa.
V2 = Volumen al final de la etapa.
T2 = Concentración viral al final de la etapa.
Análisis estadístico. Para comprobar la confiabilidad y precisión de las titulaciones y del cálculo del factor de reducción, se determinó el intervalo de confianza al 95 % para la media de los 3 ensayos e intraensayos, tomándose en cuenta la varianza estimada.
Resultados
Inactivación del VHS-1 en el proceso de obtención de albúmina
Fraccionamiento alcohólico. La tabla 1 muestra el efecto del etanol sobre la infectividad del VHS-1 en el fraccionamiento del plasma para obtener la albúmina humana, así como los títulos infectivos logrados al inicio de cada etapa retada. Los títulos en el material inicial fueron de 6,81 hasta 8,82 log10, con logaritmos de reducción desde 4,74 hasta 6,90 log10. No se observó diferencias en la capacidad de inactivación del VHS-1 entre las diferentes etapas, que difieren entre sí en la concentración de etanol y tiempo de acción.| | |||
| Fracción de plasma retada | | | |
| Plasma | | | |
| Sobrenadante I + II + III | | | |
| Sobrenadante IV | | | |
| Pasta V (restituida) | | | |
| Sobrenadante 10 % | | | |
| Pasteurización | | | |
| Factor de reducción Total | | ||
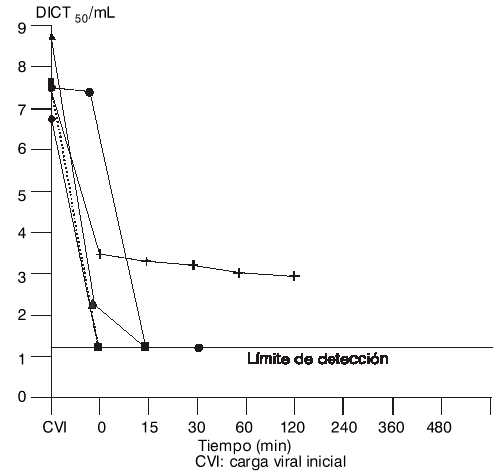
En la figura 2 se presentan las curvas de inactivación del virus en función del tiempo y de la concentración de etanol. La mayor inactivación se obtiene desde los primeros minutos después de iniciada la adición de etanol; con posterioridad no es detectable la presencia de partículas virales infectivas, con excepción de la etapa de fraccionamiento con 10 % de etanol, que al cabo de las 2 h aún se detecta virus infeccioso.
Pasteurización. La inactivación de VHS-1 por calentamiento durante 10 h en solución acuosa, se muestra en la tabla 1, con una completa inactivación del virus, y se alcanzan rápidamente valores menores que el límite de detección del sistema (101.301 DICT50/mL).
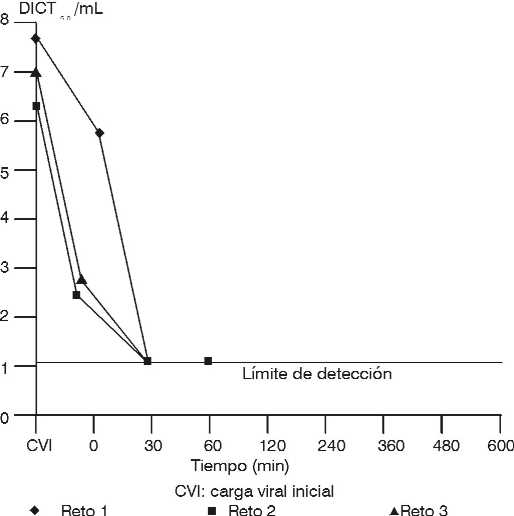
En la figura 3 está representada la cinética de inactivación del VHS-1 a 60 oC durante 10 h; a los 30 min después de estar la albúmina humana a 60 oC en los 3 retos no se detecta virus infeccioso.
Inactivación del VHS-1 en el proceso de obtención de IgG im/iv
Fraccionamiento alcohólico. La tabla 2 muestra los resultados del efecto del etanol sobre la infectividad del VHS-1 durante el proceso de purificación de las IgG, los títulos infectivos obtenidos al inicio de cada etapa, así como los factores de reducción totales.| | |||
| Fracción de plasma retada | | | |
| Plasma | | | |
| Pasta I+II+III (restituida) | | | |
| Sobranadante I+III | | | |
| CII | | | |
| Factor de reducción Total | | ||
Se obtuvieron títulos infectivos en el material inicial de 6,76 hasta 8,17 log10, con factores de reducción desde 4,86 hasta 6,27 log10.
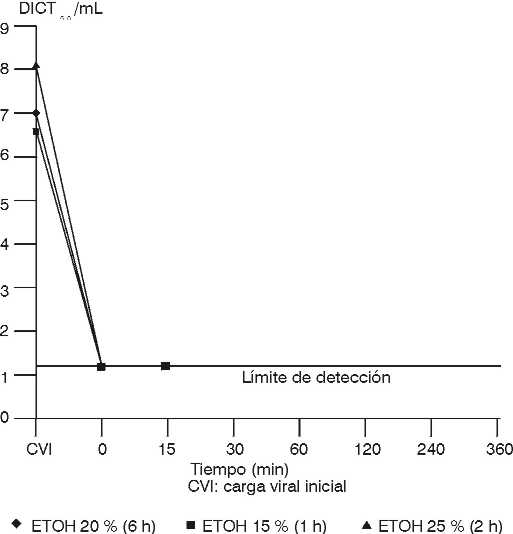
La cinética de inactivación del VHS-1 en función del tiempo y de la concentración de etanol son representadas en la figura 4; obsérvese una marcada disminución de la infectividad viral, la cual no es dependiente de la concentración de etanol empleada en estas etapas, ni del tiempo de acción de éste.
Remoción del VHS-1 por DEAE Sephadex A-50 en la purificación de las inmunoglobulinas. Se determinó la capacidad de remoción viral del paso cromatográfico antes y después de la adsorción con DEAE, Sephadex A-50, lográndose 2,12 logaritmos de reducción de la carga viral (tabla 2), pero esta etapa no es capaz de remover todo el virus infeccioso.
Factores de reducción totales
Los 27,84 logaritmos de reducción son obtenidos por el fraccionamiento alcohólico del proceso de producción de albúmina, lo que sumado con el factor de reducción aportado por la pasteurización, se alcanza un FR total de 33,06 log10.En el proceso de obtención de las inmunoglobulinas se alcanzó un FR total de 18,16 log10, al sumar los 16,04 log10 que aporta el fraccionamiento alcohólico y los 2,12 log10 de la cromatografía de intercambio iónico.
Discusión
La transmisión de herpesvirus humanos por productos derivados de la sangre no ha sido reportada; el proceso de fabricación basado en el fraccionamiento alcohólico ofrece una alta seguridad en la inactivación de herpesvirus, y es conocida la susceptibilidad de esta familia viral a los solventes lipídicos, pH extremos y al calor, de ahí que nuestros resultados coincidan con el de otros estudios en cuanto a los altos valores de reducción obtenidos.10,11Los métodos cromatográficos contribuyen a la remoción viral; en dependencia de la técnica utilizada, se han reportado valores de reducción entre 2,2 y 5,11 log10 para VHS-1.12,13
Nuestros estudios muestran una marcada disminución de la infectividad viral en la purificación de la albúmina humana, con factores de reducción de 27 log10 y la pasteurización aporta 5 logaritmos de reducción adicionales al proceso, lo que garantiza la no presencia de virus infectivos en el producto final; resultados similares han sido reportados por otros investigadores.10,11,14
En el caso de las inmunoglobulinas se ha hecho un mayor énfasis en estos estudios por su uso en personas inmunodeprimidas. Diechtelmuller y otros11 reportaron de 23 a 27 logaritmos de reducción para virus herpes, incluyendo pasos de inactivación introducidos al final del proceso. En nuestro estudio obtuvimos valores de reducción de 18 logaritmos incluyendo la cromatografía de intercambio iónico.
La transmisión del virus de la hepatitis B por el uso de hemoderivados contaminados constituyó un problema de salud en el pasado, lo que ha ido mejorando con la utilización de métodos de pesquisaje a nivel de banco con una mayor sensibilidad, y la introducción de métodos de inactivación en los procesos de fabricación.4 Sin embargo, la concentración de virus que pudiera estar presente en una persona infectada alcanza valores de entre 106 y 108 partículas virales por mililitros de plasma, lo que pudiera en un momento determinado contaminar el lote de plasma, y se han recomendado niveles de inactivación superiores a 8 log10 para lograr una adecuada seguridad al producto final.1,4
En el FR total del proceso de producción de las inmunoglobulinas se toma en cuenta el FR aportado por la etapa de cromatografía de intercambio iónico, pues aunque ésta no es capaz de remover todo el virus infeccioso, si obtiene más de 1 log de reducción de la carga viral, y según la OMS y las normas de la CEE, se pueden tener en cuenta en el nivel de seguridad del proceso de producción; pero no se considera una etapa segura, éstas sólo se consideran así si aportan más de 3 log de reducción de la carga viral.12,15
Los valores de reducción acumulativos totales (albúmina 33,06 log10 e inmunoglo-bulinas 18,16 log10) en sus procesos de fabricación, son mayores en varias magnitudes que la carga viral que pudiera estar presente en un lote de plasma, y muy superiores aún al valor de reducción teórico de 12 logaritmos reportado como eficaz para la inactivación de virus en un proceso, lo cual aporta un gran rango de seguridad a los pacientes que por el uso de la albúmina humana y las inmunoglobulinas intravenosa e intramuscular no tienen riesgo de infectarse con virus ADN envueltos.
Summary
Inactivation of human herpes simplex virus I asa model of enveloped DNA virus was studied in the stages of production of intramuscular/ intravenous inmunoglobulins and human albumin, in the phases of alcohol fractionation for obtaining these products, and in the methods of removal and/or inactivation implemented in manufacture, pasteurization and ion - exchange chromatography. The virus was quantified by cytophatic effects. The cumulative reduction values reported in this paper proved that the use of alcohol fractionation in Cuba, as a variant of Cohn - Oncley method, combined with removal/inactivation procedures resulted in enveloped DNA virus inactivation assuring high biological safety for albumin and immunoglobulins for their use in human beings.Subject headings: DNA, VIRAL; HERPES VIRUS 1, HUMAN; SERUM ALBU-MIN, IMMUNOGLOBULINS; DRUG COMPOUNDINGS.
Referencias Bibliográficas
- Who. Viral inactivation of blood and blood products. (Prepared on behalf of the WHO by Dr. H. Soumela. Finnish Red Cross Blood Transfusion Service): Global Blood Safety Initiative. WHO/LBS/92.5.1992:2-34.
- Comittee Propietary Medical Products (CPMP). Biotechnology Working Party. Note for guidance on virus validation studies: the design, contribution and interpretation of studies validating the inactivation and removal of viruses. CPMP/BWP/268/95. FINAL VERSION-2, 1996.
- Ashley RL, Corey L. Herpes simplex viruses. En: Schmidt NJ, Emmons RW, ed. Diagnostic procedures for viral, rickettsial and clamydial infectious. 6 ed. Washington: APHA; 1989;265-317:cap11.
- Gürther L. Blood-borne viral infections. Blood Coagul Fibrinolysis 1994;5(3):55-510.
- Cohn EJ, Strong LE, Hughes WL, Mulford DJ, Ashworth JN, Melin M, et al. Preparation and properties of serum and plasma proteins IV: a system for the separation into fractions of the protein and lipoprotein components of biological tissues and fluids. J Am Chem Soc 1946;68;459-75.
- Oncley JL, Melin M, Richert DA, Cameron JW, Gross PM. The separation of antibodies isoagglutinins, prothrombin, plasminogen and beta I-lipoprotein into subfractions of human plasma. J Am Chem Soc 1949;71:514-50.
- Cádiz A, Gutiérrez A, Giraldino Y, García L. Ensayo de un método de obtención industrial en Cuba de una inmunoglobulina humana normal biológicamente activa por fraccionamiento etanoico. Rev Cubana Farm 1977;11:5-12.
- Johnson VA, Byington RE. Quantitative assays for virus infectivity (Virus Yield Assay) En: Aldovani A, Walker BD. eds. Techniques in HIV research. New York: Stockton Press; 1990:71-6.
- Reed LJ, Muench H. A simple method of estimating fifty percent endpoint. Amer J Hyg 1938;27:493-7.
- Grandgeorge M, Veron JL. Viral validation of the manufacturing process of high purity albumin from placentas. Dev Biol Stand 1993;81:237-44.
- Dichtelmuller H, Rudnick D, Breuer B, Ganshirt KH. Validation of virus inactivation and removal for the manufacturing procedure of two immunoglobulins and 5 % serum protein solution treated with beta-propiolactone. Biologicals 1993;21(3):259-68.
- Grun BJ, White ME, Sito FA. Viral removal/inactivation by purification of biopharmaceuticals. Bio Pharm 1992;Nov-Dic:22-30.
- O´Nell PF, Balkovic ES. Virus harvesing and affinity-based liquid chromatography. Biotechnology 1993;11:173-7.
- Nowak T, Gregersen JP, Klockman U, Cummins BL, Hilfenhaus J. Virus safety of human immunoglobulins. Efficient inactivation of hepatitis C and other human pathogenic viruses by the manufacturing procedure. J Med Virol 1992;36:209-16.
- European Plasma Fractionation Association (EPFA) and European Association of the Plasma Products Industries (EAPPI). Points to consider on virus safe plasma products. CPMP ad hoc Working Party on Biotechnology/Pharmacy (1994). Biologicals 1995;23:193-5.
Recibido: 21 de diciembre de 1998. Aprobado: 27 de enero de 1999.
Dr. Ignacio Juan Ruibal Brunet. Laboratorio de Investigaciones de SIDA. Apartado postal 23031, Marianao 14, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Microbiología. Investigador Agregado.
2 Licenciado en Biología. Investigador Agregado.
3 Especialista de II Grado en Microbiología.
4 Licenciado en Microbiología. Investigador Agregado.
5 Licenciada en Biología. Planta Productora de Hemoderivados "Arístides Viera".














