Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.33 n.2 Ciudad de la Habana Mayo-ago. 1999
Centro de Investigación y Desarrollo de Medicamentos
Estudio de preformulación del citrato de dietilcarbamazina
Rafael León Rodríguez,1 Alexander González Calzadilla,2 Luis Martínez Álvarez3 y Yamilka Roberto Cordovés4Resumen
Se realizó el estudio de preformulación del citrato de dietilcarbamazina con el objetivo de conocer las características físico-químicas y tecnológicas de este fármaco para el posterior desarrollo de una tableta de 50 mg de dosis, el cual incluyó la determinación del tamaño de partícula micronizada y sin micronizar según el método de microscopia óptica, de manera que quedó demostrado la influencia que presenta éste en la disolución del fármaco in vitro. Se efectuó el estudio de incompatibilidad principio activo-excipientes mediante el método de calorimetría diferencial de barrido; no se encontró ninguna interacción entre éstos, en las condiciones de trabajo experimentales. Se estudiaron otras propiedades físico-químicas y tecnológicas del fármaco.Descriptores DeCS: DIETILCARBAMACINA/química; FILARICIDAS/química; QUIMICA FARMACEUTICA.
La dietilcarbamazina es un fármaco que se emplea eficazmente en el tratamiento de infecciones producidas por filarias, como Wuchereria bancrofti, Brugia malayi, Loa loa y Onchocerca volvulus.
Este medicamento también se utiliza en el tratamiento de la larva migrans cutánea y para combatir las infecciones producidas por Eosinofilia tropical, causando rápida desaparición de los síntomas.1
El objetivo del presente trabajo es obtener la mayor información del principio activo con la finalidad de trazar una estrategia correcta para el posterior desarrollo de la formulación.
En este estudio de preformulación se analizan, fundamentalmente, parámetros físico-químicos de la dietilcarbamazina, como el tamaño de partículas mediante el método de la microscopia óptica, la posible incompatibilidad principio activo-excipientes según el método de calorimetría diferencial de barrido, así como otras propiedades del fármaco.
Métodos
Los materiales empleados fueron los siguientes:- Citrato de dietilcarbamazina de la firma Grace Rexolin, Suiza, con especificaciones de calidad según Farmacopea USP edición XXII, Farmacopea Británica 88.
- Excipientes para la elaboración de tabletas según especificaciones de calidad de la Farmacopea USP edición XXIII; lactosa monohidratada, almidón de maíz, sodio almidón glicolato, polivinilpirrolidona K-25 y estearato de magnesio.
Parámetros.
- Volumen: 900 mL de agua desionizada y desgasificada.
- Aparato: No 2, 50 r.p.m.
- Tiempo: 45 min.
- Límite: no menos del 75 % (Q) de la cantidad declarada, se disuelve en 45 min.
Las muestras de materia prima micronizadas y sin micronizar fueron suspendidas en petrolato líquido, con el empleo de un agitador magnético IKA.
Las medidas se realizaron teniendo en cuenta las consideraciones siguientes.
Se tomaron como mínimo 15 campos de medición, se midieron 100 partículas de forma tal que una misma partícula no fuera medida 2 veces, para lo cual éstas fueron seleccionadas siguiendo una dirección horizontal y pasando por el centro de ellas.
Estudio de incompatibilidades principio activo-excipientes. Esta determinación fue realizada en un equipo de análisis térmico TA-3000 de la firma METTLER con una celda térmica DSC 20. Primeramente se estudiaron cada una de las sustancias por separado y posteriormente se prepararon mezclas binarias entre el principio activo y cada uno de los excipientes propuestos en las relaciones siguientes: 1:1, 1:3 y 3:1, respectivamente.
Estas mediciones se efectuaron bajo condiciones estáticas del aire, a una velocidad de calentamiento de 5 °C/min y un rango de temperaturas entre 35 y 300 °C.
Densidad de vertido y asentamiento del principio activo. Con la finalidad de determinar estas propiedades físicas, se pesaron 50,0 g de las muestras sin micronizar y micronizadas y se adicionaron a un cilindro graduado de 100 mL. La densidad de vertido fue calculada a partir del volumen ocupado por el sólido.
Para determinar la densidad de asentamiento, el fármaco fue sometido a 3 series de 500 percusiones cada una y dicha densidad fue calculada a partir del volumen final.
Índice de Haussner y determinación del porcentaje de compresibilidad. El índice de Haussner (IH) y el porcentaje de compresibilidad (% C) se calcularon según las ecuaciones siguientes:

Se registra el tiempo de caída, posteriormente se mide la altura del cono así como su radio.
El ángulo de reposo fue calculado a partir de la ecuación siguiente:

donde:
h: es la altura del cono (cm).
r: es el radio del cono (cm).
Para el caso de la velocidad de flujo, ésta fue calculada a partir de la ecuación siguiente:

G: masa (g).
d: diámetro embudo (cm).
t: tiempo de caída (s).
Resultados
Ensayo de disolución.2 Los resultados de los ensayos de disolución realizados a tabletas de citrato de dietilcarbamazina 50 mg con el principio activo sin micronizar y micronizado se muestran en la tabla 1.| Ensayo | | | | |
| Disolución inicial | | | | |
| Disolución a los 12 meses | | | | |
| Lotes | | | | |
| Disolución inicial | | | | |
| Disolución a los 12 meses | | | |
Dureza: 4-5 kgf.
Límite: No menos del 75 % (Q) se disuelve en 45 min.
Determinación del tamaño de partícula por microscopia óptica.3-5 Los resultados obtenidos en la medición del tamaño de partícula del principio activo citrato de dietilcarbamazina sin micronizar y micronizado se presentan en la tabla 2 y en las figuras 1 y 2.
| Límite de clases (µm) | | | | |
| 0,0 - 5,0 | | | | |
| 5,0 - 10,0 | | | | |
| 10,0 - 15,0 | | | | |
| 15,0 - 20,0 | | | | |
| 20,0 - 25,0 | | | | |
| 25,0 - 30,0 | | | | |
| 0,0 - 1,0 | | | | |
| 1,0 - 2,0 | | | | |
| 2,0 - 3,0 | | | |

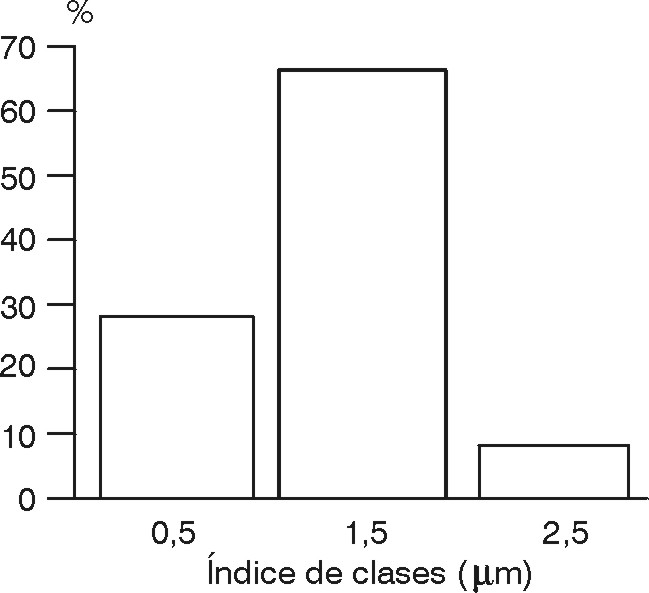
La comparación de los parámetros calculados correspondientes a la determinación del tamaño de partícula de citrato de dietilcarbamazina sin micronizar y micronizado se presentan en la tabla 3.
| Parámetros | | |
| Diámetro medio (No) (mym) | | |
| Diámetro medio (Vol-Sup) (mym) | | |
| Superficie específica (g/cm2) | | |
| Densidad vertido (g/cm3) | | |
| Densidad asentamiento (g/cm3) | | |
| Índice de Haussner | | |
| Porcentaje de compresibilidad | | |
| Velocidad de flujo (g/cm2s) | | |
| Ángulo de reposo (a) | | |
Estudio de incompatibilidades.6,7 La realización de este estudio entre el fármaco y los excipientes propuestos, es sumamente importante, por que se hace necesario determinar con exactitud la existencia o no de interacciones de tipo físico-químicas entre éstos.
Los resultados obtenidos a partir de este estudio son los siguientes:
- El citrato de dietilcarbamazina presenta su señal a 137,8 °C; el rango de temperatura de fusión reportado es de 137 - 143 °C.8
- Las mezclas binarias del fármaco con almidón de maíz en las relaciones 1:1, 1:3 y 3:1, presentan la señal de éste a 139,4; 139,2 y 139,7 °C respectivamente; no se presentan corrimientos de las señales tanto del principio activo como del excipiente.
- Las mezclas binarias del fármaco con lactosa monohidratada en las relaciones 1:1, 1:3 y 3:1, presentan la señal de ésta a 135,4; 142,1 y 137,4 °C respectivamente; no se presentan corrimientos de las señales tanto del principio activo como del excipiente.
- Las mezclas binarias del fármaco con sodio almidón glicolato, en las relaciones 1:1, 1:3 y 3:1, presentan la señal de éste a 137,0; 137,0 y 137,6 °C respectivamente; no se presentan corrimientos de las señales tanto del principio activo como del excipiente.
- Las mezclas binarias del fármaco con polivinipirrolidona K-25 en las relaciones 1:1, 1:3 y 3:1 presentan la señal del fármaco a 139,6; 139,7 y 138,9 °C; no se presentan corrimiento de las señales tanto del fármaco como del excipiente.
- Las mezclas binarias del fármaco con estearato de magnesio en las relaciones 1:1, 1:3 y 3:1, presentan la señal de éste a 138,0; 138,0 y 138,2 °C respectivamente; no se presentan corrimientos de las señales tanto del principio activo como del excipiente.
- Las temperaturas de fusión de los excipientes empleados no fueron modificadas por la presencia del fármaco.
- No aparecieron nuevas señales en los termogramas obtenidos, tanto del fármaco solo, excipientes solos, así como en las mezclas binarias estudiadas.
Discusión
Ensayo de disolución. Siendo el citrato de dietilcarbamazina un fármaco reportado como soluble en agua,2 los resultados obtenidos de los ensayos de disolución (tabla 1) realizados a tabletas que contienen el principio activo sin micronizar, independientemente que cumplen con los límites establecidos para este producto,2 requieren un tratamiento de micronización con el objetivo de lograr un tamaño de partículas adecuado, que permita mejorar estos resultados sin la necesidad de emplear otras sustancias auxiliares como los agentes tensioactivos y por consiguiente incrementar la biodisponibilidad de este principio activo. El tamaño de partículas recomendado se enmarca en un rango de hasta 3,0 µm, y la mayor población de partículas se encuentra en el rango comprendido entre 1,0 y 2,0 µm, según se muestra en el histograma de frecuencia (fig. 2).Estas tabletas fueron elaboradas manteniendo constante la dureza para ambos casos, en un valor comprendido entre 4 y 5 kgf, con el objetivo de mantener constante dicho parámetro y de esta forma eliminar la influencia que ésta ejerce en la disolución.
Determinación del tamaño de partícula por microscopia óptica.3-5 De los resultados obtenidos podemos plantear (tabla 2):
- Existe una gran dispersión en el tamaño de partícula del producto sin micronizar, la cual se mueve en un rango de hasta 30,0 µm, y presenta mayor porcentaje poblacional en el rango comprendido entre 15,0 y 20,0 µm, como se puede observar en el histograma de frecuencia (fig. 1).
- Una vez efectuada la micronización se reduce considerablemente esta dispersión, la cual se mueve en un rango de hasta 3,0 µm, y presenta el mayor porcentaje poblacional entre 1,0 y 2,0 mm, como se puede observar en el histograma de frecuencia (fig. 2).
- El valor del diámetro medio numeral disminuye al micronizarse la droga, con una diferencia en valores del orden de 15 µm5 (tabla 3).
- El valor del diámetro medio volumen-superficie también se ve disminuido en 217,3 µm, lo cual trae aparejado un incremento en la superficie específica, en el orden de 655 g/cm2 tal como debiera esperarse según lo reportado en la literatura5 (tabla 3).
En el caso del principio activo se observa una señal correspondiente al efecto endotérmico a la temperatura de fusión de éste.
Otras propiedades físico-químicas y tecnológicas. Las propiedades de flujo del fármaco en forma de polvo es un parámetro importante dentro de un estudio de preformulación, máxima cuando ésta se encuentra micronizada.9
Tomando en consideración las relaciones existentes entre ángulo de reposo, porcentaje de compresibilidad e índice de Haussner con las propiedades de flujo del fármaco,5,9 podemos concluir que este principio activo posee buenas propiedades de flujo micronizado, pero éstas se verán mejoradas al utilizar un agente aglutinante en la formulación.
Nótese que el resultado obtenido en la determinación del porcentaje de compresibilidad está en relación inversa con la fluidez del material, es decir, con un resultado de este parámetro inferior al 21 % estos materiales son considerados como de flujo libre.5,9
En cuanto a los valores obtenidos del ángulo de reposo, éste se encuentra dentro de los límites establecidos (entre 25 y 30 °), lo que le confiere al material buenas características de flujo3 (tabla 3).
Summary
The study of diethycarbamazine citrate preformulation with a view to finding uot the physico - chemical and tachnological characteristics of this pharmaceutical for further production of a 50 mg tablet was performed. This study included the determination of the size of micronized and non-micronized particles by optical microscopy in which the influence of size on the pharmaceutical dissolving in vitro was shown. Drug - excipient incompatibility was analysed using differential scannig calorimetry and no interaction was found under experimental working conditions. Other physico-chemical & technological properties of this pharmaceutical were examined.Subject headings: DIETHYCARBAMAZINE/chemistry; FILARCIDES/ /chemistry; CHEMISTRY, PHARMACEUTICAL.
Referencias Bibliográficas
- Martindale W. The extra pharmacopoeia. 30 ed. London: The Pharmaceutical, 1993:41.
- The United States Pharmacopoeia. 23 ed. Rookville: Convention; 1995;503.
- Iraizos A, Bilbao O, Barrios MA: Conferencias de tecnología farmacéutica II. La Habana: Editorial Pueblo y Educación; 1990;106-8.
- Lieberman HA, Lachman L. Preformulation testing. New York: Marcel Dekker; 1981;vol 1:120-2.
- Wells JI. Pharmaceutical preformulation: the physico-chemical properties of drug substances. Chichester: Ellis Horwood; 1987:14.
- Botha SA, Loter AT. Compatibility study between atenolol and tablet excipients using differential scanning calorimetry. Drug Dev Ind Pharm 1990;16(12):1945-54.
- Hartauer KJ, Guillory JK. A comparison of diffuse reflectance FT-IR spectroscopy and differential scanning calorimetry in the characterization of drug-excipient interaction. Drug Deu Ind Pharm 1991;17(4):617-30.
- The Merck Index. 11 ed. Rahway: Merk, 1989:492.
- Wadke DA, Jacobson H. Pharmaceutical dosage forms. Tablets, in preformulation testing. Philadelphia: Lea and Febiger; 1981;vol.1:16.
Recibido: 21 de diciembre de 1998. Aprobado: 29 de enero de 1999.
Lic. Rafael León Rodríguez. Centro de Investigación y Desarrollo de Medicamentos. 19 de mayo No.13 esquina a Amezaga, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1 Investigador Auxiliar.
2 Aspirante a Investigador.
3 Investigador Agregado.
4 Licenciada.














