Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm v.34 n.1 Ciudad de la Habana ene.-abr. 2000
Instituto de Farmacia y Alimentos. Universidad de La Habana
Validación de 2 métodos espectrofotométricos para la cuantificación de taninos y flavonoides (quercetina) en Psidium guajaba, L.
Yamilet Irene Gutiérrez Gaitén,1 Migdalia Miranda Martínez,2 Noel Varona Torres3 y Aida Tania Rodríguez4RESUMEN
Se realizó la validación de 2 métodos espectrofotométricos que posibilitan cuantificar taninos y flavonoides en la droga cruda de Psidium guajaba, L., pues la literatura no cuenta con métodos oficiales que permitan cuantificar dichos compuestos en esta planta. Se determinó que ambos métodos (método del tungsto-molíbdico-fosfórico para taninos descrito por Miranda M y el método espectrofotométrico para flavonoides totales expresados como quercetina, de Kostennikova Z y modificado por Méndez G) cumplían con todos los requisitos de validación propuestos para el control químico de calidad de la especie (linealidad, precisión [repetibilidad y reproducibilidad], exactitud y especificidad).Descriptores DeCS: ESPECTROFOTOMETRIA/métodos. TANINOS/análisis; QUERCETINA/análisis; HOJAS DE PLANTA.
La validación de un método es aquel proceso por el cual se establece mediante estudios de laboratorio que su capacidad satisface los requisitos para las aplicaciones deseadas; esta capacidad se expresa en términos de parámetros de análisis, donde se tiene en cuenta la linealidad, precisión (repetibilidad y reproducibilidad), exactitud, especificidad, sensibilidad, entre otros, en dependencia del objetivo que se persiga.
En la actualidad reviste gran importancia la validación de métodos, procesos, etc., que permitan mayor confiabilidad en los resultados, fundamentalmente cuando se trabaja con productos naturales, donde es necesario obtener datos y resultados experimentales que demuestren la aptitud para el uso que se destina; es por ello, que nos trazamos como objetivo la validación de 2 métodos espectrofotométricos que permiten cuantificar los compuestos que según referencias bibliográficas, están relacionados con la acción antidiarreica de Psidium guajaba, L. (taninos y el flavonoide quercetina), y de esta manera proponer ambos métodos para el control químico de calidad de la droga cruda de dicha especie.
MÉTODOS
Como material se emplearon hojas adultas de Psidium guajaba, L. procedentes de Ceiba del Agua, provincia La Habana, previamente secadas y molinadas. A partir de la droga cruda obtenida se prepararon las muestras para el proceso de validación de los 2 métodos espectrofotométricos para cuantificar taninos y flavonoides totales expresados como quercetina, los cuales se describen a continuación:Método del tungsto-molíbdico-fos-fórico para cuantificar taninos (descrito por Miranda M en el Manual de prácticas de laboratorio de análisis farma-cognóstico. 1992:54-5): se agitan 10 g de muestra con 500 mL de etanol al 50 % durante 6 h, se deja en reposo 8 h y se agita nuevamente por 30 min, para pos-teriormente filtrar. Se transfieren 3 mL del filtrado a un matraz aforado de 50 mL y se diluye con agua destilada hasta enrase (Sm). Finalmente se preparan matraces aforados de 50 mL, los cuales contendrán:
| Reactivos Blanco Patrón Muestra | |||
| Sm | - | - | 1,0 mL |
| Solución de referencia | |||
| de ácido tánico | - | 3,0 mL | - |
| Agua destilada | 5,0 mL | 2,0 mL | 4,0 mL |
| Reactivo para taninos | 2,0 mL | 2,0 mL | 2,0 mL |
| Se agita y se deja en reposo 5 min | |||
| Solución de carbonato de sodio al 20 % | 1,0 mL | 1,0 mL | 1,0 mL |
Se completa con agua destilada hasta enrase, se mazcla bien y se lee cada uno a 700 nm.
Solución de referencia de ácido tánico: se disuelven 25 mg de ácido tánico en 100 mL de agua destilada, de ahí se cogen 20 mL y se completa volumen hasta 100 mL.
Reactivo para taninos: 10 g de tungstato de sodio dihidratado, 0,2 g de ácido fosfomolíbdico y 5 mL de ácido fosfórico al 85 % en 75 mL de agua destilada. Se refluja 2 h y después se completa a 100 mL con agua destilada.
La expresión para los cálculos es la siguiente:
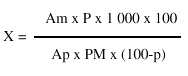
donde:
X: contenido de taninos en la droga (%)
P: masa de la sustancia de referencia (g)
Am: absorbancia de la muestra (nm)
Ap: absorbancia de la solución de referencia (nm)
PM: masa de la droga (g)
p: humedad de la droga (%)
Método espectrofotométrico para cuantificar flavonoides totales expresados como quercetina, descrito por Kostennikova Z1 (este método modificado por Méndez G en su Tesis de Maestría: Estudio farmacognóstico y fitoquímico preliminar de Cymbopogon citratus (DC) stapf y sus extractos, 1996:36-8): se refluja 0,5 g de muestra 2 h con 20 mL de ácido sulfúrico al 10 % y 20 mL de etanol al 50 %, luego se enfría y se filtra con ayuda de vacío. El residuo se lava con 30 mL de etanol al 50 % para desecharlo finalmente; el filtrado se evapora en baño de agua hasta la mitad del volumen inicial, se enfría sobre baño de hielo durante 30 min y luego se filtra, lavando el precipitado formado con 4 porciones de 10 mL de agua destilada fría (10--15 ° C). Se elimina el filtrado y los lavados, y el residuo tanto del filtro como del recipiente se disuelve con 70 mL de etanol al 96 %, calentando previamente a 50 ° C; la solución se pasa a un volumétrico de 100 mL y se completa volumen con etanol al 96 % (solución muestra). Poste-riormente se leen las absorbancias a 258 nm.
Como patrón se empleó 0,04 g de quercetina, los cuales se disolvieron con etanol al 96 % hasta completar un volumen de 50 mL; de esta solución se toma 1 mL y se diluye a 100 mL con etanol al 50 %. El blanco consistió en una solución de etanol al 50 %.
La expresión empleada para el cálculo fue la siguiente:
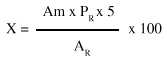
donde:
X: contenido de flavonoides totales expresados como quercetina (%)
Am: absorbancia de la solución muestra (nm)
PR: peso de la sustancia de referencia (g)
AR: absorbancia de la solución de referencia (nm)
Los parámetros evaluados en el proceso de validación (según lo reportado por Fernández A en Validación de métodos analíticos. II Taller de validación; 1996:10-29) fueron:
Linealidad: se prepararon 5 soluciones muestras, cada una por triplicado a partir de la droga cruda, correspondiente al 50, 80, 100, 120 y 150 % del peso inicial indicado en cada método y se determinó la absorbancia de cada una. Posteriormente se construyeron curvas de absorbancia contra concentración y se efectuó un análisis de regresión, calculando el coeficiente de regresión (r), el coeficiente de determinación (r2), coeficiente de variación de los factores de respuesta (CVf), las pendientes, interceptos y significación de las pendientes e interceptos. El criterio establecido es: CVf £ 1,5 %; r 3 £ 0,99; r2 £ 0,98; intercepto que no sea significa-tivamente diferente de cero y la pendiente significativamente igual a 1.
Precisión: este parámetro incluye la repetibilidad y reproducibilidad. Se realizó una prueba de Fischer y una prueba t de Student.
Repetibilidad: se repitieron los métodos espectrofotométricos señalados anteriormente, 6 veces cada uno, para la muestra correspondiente al 100 %, por el mismo analista, el mismo día y con el mismo equipo. El criterio establecido es: CV £ 1,5 %.
Reproducibilidad: se efectuó con la muestra correspondiente al 100 %, por triplicado, por 2 analistas, 2 d diferentes. El criterio establecido es: CV £ 3,0 %.
Exactitud: se utilizó el método de adición de patrón. Se partió de una muestra de la que se tomaron 3 alícuotas y se les añadieron cantidades crecientes de patrón correspondiente al 80, 100 y 120 %, es decir, quercetina (16 m g/mL) para el método de cuantificación de flavonoides y ácido tánico (3 m g/mL) para el de taninos. Los resultados se expresaron como porcentaje de recobro (R) y coeficiente de variación (CV). El criterio establecido es: R=97-103 %; CV £ 3,0 %.
Especificidad: se analizaron muestras que contenían solamente las sustancias de interés (quercetina y ácido tánico), otras que contenían placebo y otras a las cuales al placebo se les agregó la sustancia de interés al 100 %. Todos los ensayos se efectuaron por triplicado y como criterio se establece que no debe existir absorbancia significativa del placebo en la longitud de onda de trabajo.
El placebo para el método de taninos fue etanol al 50 % y en el caso de flavonoides una solución de ácido sulfúrico al 10 % y etanol al 50 %.
Todos los resultados obtenidos fueron procesados de forma automatizada, con el empleo del programa estadístico Stat para Window, donde se realizó el análisis de regresión de la curva de calibración para determinar la significación de las pendientes y los interceptos.
RESULTADOS
En el primer parámetro evaluado que fue la linealidad (tabla), se obtuvieron valores de coeficientes de correlación r igual a 0,9991 y 0,9928 para el método de cuantificación de taninos y flavonoides totales respectivamente, así como coeficientes de variación de los factores de respuesta de 0,72 % para el primer caso y 0,56 % para el segundo.| Linealidad (%) | Parámetros determinados en la validación |
Especificidad | |||
| Repetibilidad(%) | Reproducibilidad(%) | Exactitud(%) | |||
| Método para cuantificar taninos | r=0,9991 r2=0,9834 CVf = 0,72 % | CV = 0,50 | CV = 0,35 | R = 97,63 CV = 1,63 | El placebo no ab- sorbió de forma Significativa en el área de trabajo |
| Métodopara cuantificar Flavonoides totales | r2 = 0, 9928 r2=0,9834 CVf = 0,56 % | CV = 0,28 | CV = 0,49 | R = 97,44 CV = 1,89 | El placebo no ab- sorbió de forma Significativa en el área de trabajo |
| Criterios establecidos | r3 0,99 r2 ³ 0,98 CVf £ 1,5 | CV £ 1,5 | CV £ 3,0 | R = 97-103 CV £ 3,0 | El placebo no ab- sorbió de forma Significativa en el área de trabajo |
El análisis estadístico de regresión mediante Stat para Window ofreció al método de cuantificación de taninos un intercepto que no es significativamente diferente de cero: 0,0008 con un error estándar de 0,001 y una probabilidad de 0,4915, o sea, mayor que 0,05. La pendiente resultó ser significativamente igual a uno: 0,9997 con un error estándar de 0,004 y una probabilidad menor que 0,05, o sea, 0,0001.
Para el método de cuantificación de flavonoides el intercepto no es significativamente diferente de cero: 0,0006 con un error estándar de 0,0005 y una probabilidad de 0,3488 (> 0,05). La pendiente es significativamente igual a uno: 0,9998 con un error estándar de 0,0031 y una probabilidad de 0,0002 (< 0,05).
Para la repetibilidad (tabla) se apreciaron valores de CV=0,50 y 0,28 % para el método de taninos y flavonoides respectivamente. La reproducibilidad (tabla) dio como resultados el 0,35 % para taninos y el 0,49 % para flavonoides totales.
Por su parte la exactitud (tabla), brindó valores de coeficientes de recobro R de 97,63 y 97,44 %, así como CV de 1,63 y 1,89 %.
Finalmente se determinó la especificidad de los métodos donde se obtuvo como resultado al aplicar ANOVA 1, para el 95 % de confianza, que el placebo no absorbió de forma significativa en la región de trabajo, pues las absorbancias fueron casi cero, o sea, 0,0003 (± 0,010) para el método de cuantificación de taninos y 0,0007 (± 0,009) para el de flavonoides totales expresados como quercetina. Todo lo anterior se corroboró al comparar los valores de absorbancia de las sustancias de interés (ácido tánico y quercetina) al 100 % y la del placebo con dichas sustancias, donde los resultados de absorbancias medidas fueron bastante similares: 0,267 (± 0,002) y 0,269 (± 0,003) para taninos y 0,150 (± 0,006) y 0,149 (± 0,009) en el caso del método de cuantificación de flavonoides.
DISCUSIÓN
Al analizar los resultados obtenidos en la linealidad se pudo constatar que los valores de coeficientes de correlación r para los 2 métodos evaluados, se acercaron bastante a la unidad, además de obtener coeficientes de determinación r2, coeficientes de variación de los factores de respuesta CVf, pendientes e interceptos dentro de los límites exigidos. Todo lo anterior nos permite afirmar que existe una buena correlación entre la concentración y la respuesta obtenida (valores de absorbencia), lo cual demuestra linealidad en el rango de concentraciones estudiadas.La precisión, evaluada como respetabilidad y reproducibilidad, mostró resultados satisfactorios, pues los coeficientes de variación determinados en ambos métodos cumplieron con el criterio de aceptación. Se realizó la prueba de Fischer, donde se apreció que no existían diferencias estadísticamente significativas entre la precisión alcanzada por ambos analistas. También se aplicó la prueba t de Student, la cual reveló la ausencia de diferencias estadísticamente significativas entre las medias obtenidas por los analistas. El cumplimiento de ambos estudios nos permiten afirmar que el método es preciso.
Otro aspecto importante que se tuvo en cuenta en el proceso de validación fue la exactitud, la cual se expresa por el coeficiente de recobro R y el coeficiente de variación CV. Como se puede evidenciar en la tabla, los métodos propuestos son exactos, ya que los valores de porcentajes de recobro y coeficientes de variación se encuentran dentro del intervalo establecido.
En el último parámetro medido (especificidad) hay que señalar que los 2 métodos son específicos, pues se comprobó al aplicar ANOVA 1, para un 95 % de confianza, que no existían diferencias estadísticamente significativas entre los valores medios de absorbancia de las sustancias (ácido tánico y quercetina) de interés al 100 % y la del placebo con dichas sustancias, lo cual demuestra que el placebo no absorbió significativamente en la longitud de onda de trabajo, pues las absorbancias fueron de 0,0003 para el método de taninos y 0,0007 para el de flavonoides, valores muy cercanos a cero.
Todo el estudio desarrollado nos permite afirmar que los métodos espectrofotométricos propuestos para la cuantificación de taninos y flavonoides totales expresados como quercetina, validados para el control químico de calidad de la droga cruda de Psidium guajaba, L. son fiables, pues demuestran mantener los criterios fundamentales de linealidad, precisión (repetibilidad y reproducibilidad), exactitud y especificidad.
SUMMARY
We validated two spectrometric methods that facilitate to quantify tannins and flavonoids in a raw drug from Psidium guajaba L. Since literature does not provide official methods for quantifying such compounds from this plant. It was determined that both methods (tungsten-molybdic-phosphoric method for tannins by Miranda M., and spectrophotometric method for total flavonoids expressed as quercentin by Kostennikova Z as modified by Méndez G.) meet all the proposed validating requirement for a quality chemical control of the species (linearity, precision (repeatability and reproducibility) accuracy and specificity).Subject headings: SPECTOPHOTOMETRY/methods; TANNINS/analysis; QUERCETIN/analysis; PLANT LEAVES.
REFERENCIAS BIBLIOGRÁFICAS
- Kostennikova ZA. UV spectrophotometric quantitative determination of flavonoid in calendula tinture. Farmatsiya 1983;33(6):83-6.
M. Yamilet Irene Gutiérrez Gaitén. Instituto de Farmacia y Alimentos. Universidad de La Habana. Ave 23 No. 21422 entre 214 y 222, La Coronela, municipio La Lisa, Ciudad de La Habana, Cuba.
1 Master en Tecnología y Control de Medicamentos. Aspirante a Investigadora.
2 Doctora en Ciencias Químicas. Profesora Titular.
3 Licenciado en Farmacia. Reserva Científica.
4 Licenciada en Farmacia. Reserva Científica.














