Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.34 n.3 Ciudad de la Habana sep.-dic. 2000
Artículos de Revisión
Centro Estatal de Control de Calidad de los MedicamentosResinas de intercambio iónico para prolongar la liberación de los fármacos
Héctor M. Alfonso Zerquera,1 Graciela Pérez Ramos,2 Irina Díaz Alfonso,2 Susana Alba Delgado3 y Rufo de Armas y Leyva4RESUMEN
Se realizó el estudio de las resinas de intercambio iónico como sistemas para liberación prolongada con atención a los factores que afectan la formación de los resinatos o complejos fármacoresina. También se estudió la liberación de los principios activos a partir de los complejos y de las formas terminadas que los contienen, evaluándose los factores que afectan dicho proceso y las cinéticas a las que se ajusta. Se revisaron las combinaciones de procesos tecnológicos (principalmente la formación de complejos iónicos y su recubrimiento) que potencian la utilidad de los resinatos para prolongar la liberación a través de mecanismos combinados de intercambio iónico y difusión a través de membranas, combinaciones dirigidas a reducir las limitaciones inherentes a cada proceso por separado y conseguir un control eficaz de la liberación de fármacos iónicos.
Descriptores DeCS: RESINAS DE INTERCAMBIO IONICO/química; INTERCAMBIO IONICO; TECNOLOGIA FARMACEUTICA; COMPOSICION DE MEDICAMENTOS.
Las resinas de intercambio iónico (RII) han sido utilizadas en distintos campos de la tecnología farmacéutica; una de las aplicaciones más importantes es su empleo como matrices para prolongar la liberación de fármacos, de manera que resulta un método atractivo, pues las características de liberación dependen principalmente de la fuerza iónica del medio que rodea a los complejos fármacoresina.1,2
Los principios del intercambio iónico han sido utilizados en métodos de purificación, análisis químico, tratamiento de agua y otras aplicaciones, a escala industrial y de laboratorio, lo que unido al amplio surtido y diversidad de resinas disponibles, permite ofrecer soluciones a muchos problemas científico-técnicos del campo farmacéutico y sanitario.
Propiedades de las RII
Las RII son insolubles en agua, de naturaleza polimérica, contienen grupos ionizados (aniones o cationes), en forma repetitiva a lo largo de la cadena que las forman.3 Estos grupos tienen su carga neutralizada por iones de signo contrario (contraiones), que pueden ser intercambiados de manera estequiométrica por otros iones de igual signo al ponerse en contacto con una solución de electrólitos. Las resinas intercambiadoras de cationes se denominan catiónicas y las de aniones, aniónicas. Las reacciones de intercambio pueden ser esquematizadas como sigue: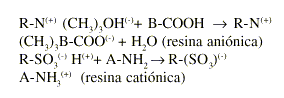
R representa el esqueleto de la resina, A-NH2 y B-COOH un medicamento básico y uno ácido, respectivamente.3
Las RII se caracterizan por su capacidad de intercambio, directamente relacionada con la naturaleza y el número de grupos ionizables en su estructura. Se expresa en miliequivalentes de un ion por gramo de resina, usualmente H(+) en las catiónicas o Cl(-) si son aniónicas. Es una medida del poder de intercambio de contraiones, específico de cada RII.4,5
Otras propiedades dependen de la peculiar estructura, internamente reticulada de la matriz polimérica que las conforma. Así sucede con la capacidad de hin-chamiento y expansión al contacto con muchos solventes, en que el entrecruzamiento determina el tamaño de los canales internos. Un alto grado de reticulación, expresado por un contenido elevado de agente reticulante en la RII, se asocia con poros de pequeño tamaño y baja capacidad de hinchamiento.3,6,7
En la práctica farmacéutica se emplean frecuentemente los copolímeros de estireno divinilbenceno. Los grupos iónicos se ubican como sustituyentes en la porción del estireno y el agente reticulante es el divinilbenceno, cuyo porcentaje en la composición (% de DVB) es la forma de expresión del grado de reticulación.3,6,7
Las RII se clasifican en débiles o fuertes, según la naturaleza química de los grupos ionizables. Las catiónicas débiles presentan grupos carboxílicos solo ionizables a valores altos de pH, las catiónicas fuertes, grupos sulfónicos ionizados incluso a bajos valores de pH. Las aniónicas débiles contienen grupos amino primarios, secundarios o terciarios de escaso poder intercambiador y las aniónicas fuertes grupos amonio cuaternario, ionizados a cualquier valor de pH.3,6,7
Las RII disponibles comercialmente, contienen impurezas que pueden dar lugar a la aparición de fenómenos tóxicos, por lo que para uso farmacéutico en humanos son sometidas a tratamientos de purificación, durante el cual además del intercambio iónico de diferentes especies, se procede al lavado en solventes, eliminando las impurezas tóxicas.1,2,4,6-9 Una vez purificadas, son inocuas.10 La administración de dosis elevadas de RII pueden provocar cambios del equilibrio iónico fisiológico del organismo,6,7,10 modificando la fuerza iónica de los fluidos biológicos a veces con efectos indeseados como reducción de los niveles sanguíneos de potasio en personas adultas, o los niveles de calcio en niños.6,7,11
Formación del complejo fármaco-resina
Inicialmente se requiere seleccionar una RII adecuada para el fármaco propuesto, para lo que deben tenerse en cuenta aspectos como:- Capacidad de intercambio iónico de la RII. Está determinada por la cantidad de grupos funcionales existentes en la estructura polimérica. El rendimiento con que se incorpora el fármaco en las reacciones de formación de los complejos está muy relacionado con la capacidad de intercambio.
- Carácter ácido o básico y fortaleza de los grupos funconales de la resina. Condiciona la velocidad a que transcurre el intercambio iónico, así las resinas fuertes, cuya interacción con los iones enlazados es más fuerte, liberan el medicamento mucho más lentamente que las resinas débiles, por eso estas últimas no son usadas para prolongar la cesión de los medicamentos.6,7,12
- Grado de entrecruzamiento o reticulación. Determina la porosidad de la resina y su capacidad de hinchamiento. Los valores de reticulación más usados oscilan entre 2 y 12 % y están muy relacionados con la velocidad del proceso de formación del complejo y de liberación del fármaco a partir de este.1,2,4,6,7,13
- Talla y forma de las partículas de la RII. El tamaño de las partículas de las RII en pocos casos afecta la velocidad de liberación, tiene mayor influencia en la velocidad con que se alcanza el equilibrio.14,15 El tamaño debe ser lo más uniforme posible (isometría) para la mayor parte de las aplicaciones galénicas, especialmente para su uso como portadores revestidos, donde la uniformidad del recubrimiento estará relacionada con la uniformidad en talla, por lo que es conveniente el uso de partículas esferoidales y de superficie lisa.
Métodos para incorporar el fármaco
El proceso siempre se comienza con la purificación inicial de la RII, para lo que son sometidas a lavados repetidos con soluciones de electrólitos, agua y alcoholes, con pases de una a otra de las formas iónicas de la resina, proceso que algunos llaman de "activación".1,2,4,16Las sales complejas de resina con fármaco, generalmente se preparan mezclando la resina con una solución del fármaco, mediante el paso de la solución por una columna que contiene la resina o mantiene el contacto entre solución y resina durante un período más o menos largo en un recipiente (método por lote o batch), donde la resina se carga hasta que se establece el equilibrio. Pocos artículos recogen estudios comparativos entre los métodos por columna y por lote.17,18 En el método por lote, los iones liberados como consecuencia de la reacción de intercambio, permanecen en el medio sin eluirse, lo que puede afectar los rendimientos por competencia con los iones de principio activo. La cinética con que se forma el complejo fármacoresina ha sido poco tratada en la literatura, y se refieren tiempos de 24 a 72 h de reacción.1,2,5,12,14,15,17,18 Algunos autores han estudiado factores como la hidrofobicidad y el coeficiente de partición de los fármacos y su influencia en la selectividad del intercambio, así como de las concentraciones de la solución del fármaco sobre la velocidad del proceso.19 Finalmente el complejo es separado por filtración, decantación, centrifugación u otro método; lavado con agua para remover los iones libres residuales y secado. Los factores que afectan el proceso de formación de los resinatos son:
- Grado de reticulación de la resina. La capacidad de carga de las RII disminuye en la medida que aumenta el grado de reticulación,16-23 debido al impedimento estérico que dificulta el acceso de los iones de fármaco en dependencia de su tamaño molecular.1,2,4 Este factor determina la porosidad de la resina, por lo que también por la vía de la reducción del tamaño de poro puede limitar el paso de iones grandes y la velocidad de intercambio.24
- Tamaño de partícula de la resina. Se puede afirmar que el tamaño de partícula no afecta la capacidad de carga de la resina, aunque han sido informados ligeros incrementos en carga de fármaco relacionados con la disminución en talla de partícula de resinas con alto grado de reticulación.14,15,17,18,20,21 Efectos de mayor relevancia han sido informados para la influencia sobre la velocidad con que se alcanza el equilibrio de intercambio, reduciéndose el tiempo necesario al disminuir el tamaño de las partículas de la RII reaccionante, efecto este que se atribuye al acortamiento de los canalículos porosos a recorrer por los iones.17,18
- Contraión de la RII. La naturaleza del contraión unido a los grupos sulfónicos de las resinas catiónicas fuertes, afecta la reacción de formación, aumentando la capacidad de intercambio de la resina según el contraión cambie en el orden: Li+, Na+ K+, H+.14,15 De acuerdo con este efecto, se estima que el procedimiento más eficiente consiste en el uso de las RII en forma ácida y los principios activos en forma de base.12,25 No todos los principios activos en forma de base presentan una solubilidad adecuada para la reacción, por lo que debe usarse en ocasiones una sal del fármaco, así se obtienen entonces los mejores rendimientos con la resina también en forma de sal.6,7
- Temperatura de reacción. Un aumento de la temperatura durante el proceso de intercambio, ha sido considerado causante de la elevación en la capacidad de carga de la resina,8,9 y se han obtenido porcentajes más altos de fijación de principio activo, atribuidos al hinchamiento de la resina y su estructura porosa, tanto por efecto de la hidratación como de la temperatura.17-21 Otros autores afirman que en sus experimentos la interacción fármaco--resina disminuyó al aumentar la temperatura, decreciendo la capacidad de intercambio.12 Estos resultados fueron obtenidos en un medio en que había disuelto cloruro de sodio además del fármaco, lo que a temperaturas elevadas podría inducir al predominio del ion Na+ en la competencia por los sitios de unión en la resina, por disminución en la selectividad de la resina ante el aumento de la temperatura.8,9,26 Luego la disminución observada en la capacidad de carga de las RII, pudo no ser provocada directamente por el incremento térmico, sino por disminución en la selectividad inducida por la temperatura.6,7
- pH del medio. Las RII débiles, cuyos grupos de intercambio son carboxilo o amino secundario, son muy influen-ciadas por el pH del medio donde se desarrolla la reacción, variando su capacidad de intercambio acorde con el pH. Esta elevada dependencia es consecuencia de los valores de pKa que son de 4-6 y 5-9, respectivamente. También ha sido demostrado que presentan un pH óptimo de máxima interacción entre fármaco y resina.12
Liberación del fármaco a partir de los resinatos
Desde 1950, que aparecieron los primeros preparados de liberación prolongada (Strassionic) basados en RII, se han descrito gran número de métodos para el estudio de las características de liberación de los resinatos. Casi cada investigador ha utilizado un método de ensayo propio, poniéndose en evidencia una extendida falta de estandarización que dificulta la comparación de los resultados obtenidos por diversos grupos de investigadores.6,7,27 Se ha podido, sin embargo, identificar un grupo de los factores que más afectan la liberación del fármaco contenido en los complejos con las RII:- Grado de reticulación de la resina. Este es un factor de máxima importan-cia por su influencia en la cinética de cesión del complejo. Según crece el entrecruzamiento, dismimuye la porosidad y poder de hinchamiento de los resinatos, con lo que se producen disminuciones significativas de la velocidad de cesión4,13,17,18 y también de la fracción de medicamento que es efectivamente liberado,16,20,21,24 ambos a consecuencia de los impedimentos estéricos al tránsito de los iones y la difusión, por el enrejado interior más tupido en las partículas de la resina.27
- Tamaño de partículas de la resina. A medida que aumenta la talla de partícula, se alarga el recorrido a transitar por los iones para alcanzar los sitios de intercambio, con lo que se hace más lento el proceso de cesión.14,15 Comoquiera que la superficie específica es inversamente proporcional al diámetro de las partículas, una menor talla de estas favorece adicionalmente el aumento de la velocidad de liberación por la vía del aumento de la superficie útil de difusión de los iones hacia el medio externo.17,18,22 En estudios realizados con propranolol, Gyselinck y otros20,21 encontraron una relación lineal entre la velocidad de liberación y la raíz cuadrada del diámetro de partícula.
- Fuerza iónica del medio. El aumento de la fuerza iónica del medio en que se libera el fármaco, produce incrementos en la velocidad de liberación, ya que la disponibilidad aumentada de iones intercambiables lo hace más fácil.27-29 Es importante tener en cuenta que la afinidad de las resinas por diferentes iones, establece ordenamientos de selectividad que pueden variar la velocidad de intercambio en función de la abundancia relativa de ionres en el medio.6,7
- Estructura y tamaño molecular del medicamento. La masa y las dimensiones moleculares de los iones de principio activo afectan el intercambio con las resinas tanto en velocidad como magnitud y muchos autores han incluido en sus trabajos experiencias al respecto.1,2,4,6,7,24 Irwin y otros17,18 utilizaron diferentes ésteres de propranolol unidos a resinas Dowex 50 W-X8 y estudiaron el efecto de la longitud de la cadena hidrocarbonada sobre el proceso de liberación, y concluyeron que a mayor longitud de la cadena la velocidad de liberación de fármaco disminuye, haciéndose más lenta la cesión de medicamento al medio.
- Velocidad de agitación. La aplicación de velocidades de agitación altas (200 r.p.m. y mayores) al medio de disolución durante la ejecución de los ensayos in vitro, aumenta la cantidad de medicamento liberado a cada tiempo por los resinatos de fármacos.14,15,17,18,20,21,24,28-30 Una explicación a tal comportamiento puede estar en que la barrera de difusión formada en la interfase medioresinato tiende a desaparecer a medida que aumenta la turbulencvia, con lo que después de cierta velocidad desaparecerá la influencia de la agitación en el proceso de liberación.6,7
- Particularidades del proceso de incorporación. Altas temperaturas durante el proceso de incorporación del fármaco,20,21 así como grados de saturación muy altos del resinato durante la formación del complejo,1,2 pueden afectar la velocidad de liberación reduciéndola, probablemente debido a que tras el enfriamiento o por deshidratación al finalizar el proceso de carga, la estructura de la resina recupera su rigidez, que disminuye durante el proceso de carga por efecto de la alta temperatura, de la fuerza iónica elevada o de una solvatación extrema.8,9 Así una vez recuperada la rigidez de la estructura de la resina, los iones quedan atrapados en esta aumentando la dificultad para difundir hacia el medio.
Cinética del proceso de liberación
La liberación de las moléculas activas a partir de los complejos, transcurre en 2 etapas: la difusión a través de la estructura matricial de la resina y la difusión a través de la capa líquida que rodea la interfase sólido--líquido. Estas etapas son consecutivas, por lo que, de ambos procesos él más lento será el limitante, determinando la velocidad de liberación. Cuando la etapa más lenta es la difusión a través de la partícula de la resina, que es la circunstancia más frecuentemente informada, la ecuación de velocidad que gobierna el proceso es la propuesta por Boyd,5 en que, considerando que las resinas son esferas uniformes de radio r y que predomina la instauración como condición del medio de disolución (sink condition), la fracción de medicamento F, liberada a cada tiempo, viene dada por la expresión siguiente: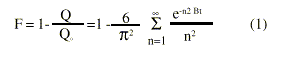
donde la constante de velocidad B viene dada por
![]()
siendo: Q el contenido de principio activo en el resinato a cualquier tiempo; Q0 el contenido de principio activo en el resinato a tiempo = 0; D el coeficiente de difusión de los iones intercambiados; r el radio de las partículas de resina y t el tiempo.
De la ecuación 1, no es posible estimar directamente los valores de B para cada fracción liberada F, pero aplicando las transformadas de Fourier y luego inte-grando, Reichenberg31 consiguió obtener las aproximaciones siguientes:

A partir de las cuales calculó y tabuló los valores del producto Bt correspondientes a valores de F desde 0,01 hasta 0,99, los cuales han sido utilizados por diversos autores20-22 para la estimación de la constante B de velocidad cuando el paso limitante de la liberación es la difusión intraparticular. Partiendo de B se puede calcular el coeficiente de difusión D, usando la ecuación (2).
El procedimiento antes descrito es, además de engorroso, dependiente de la consulta obligada de las tablas de Reichenberg. Por eso, otros investigadores desarrollaron un procedimiento más sencillo, que consiste en comprobar la linealidad entre -1n (1-F) y t0,65 para conocer si el proceso es controlado por la difusión intraparticular, o si por el contrario, está controlado por la difusión en la película líquida. El procedimiento de Bhaskar32 se basa en el uso de la ecuación siguiente:
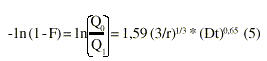
La validez de esta ecuación aproximada se puso de manifiesto aplicando a datos experimentales de otros autores este procedimiento; en todos los casos se confirmó las conclusiones alcanzadas originalmente usando las tablas de Reichenberg, pues rindieron un buen ajuste a la nueva ecuación.31
Revestimiento y microencapsulación de los resinatos
Las RII constituyen un sustrato idóneo para la aplicación de cubiertas protectoras, en especial las resinas que se presentan para su comercialización en forma de partículas esféricas, que son muy homogéneas en forma y talla, lo que favorece la uniformidad y reproducibilidad del proceso de deposición del material de cubierta sobre la superficie a revestir, con perfiles de liberación más uniformes y repetibles.33Los procesos de revestimiento que usa RII como sustrato, se ven también favorecidos por obtenerse mayores rendimientos que al microencapsular directamente el principio activo. El uso de las RII, por su reconocida insolubilidad, permite además, sortear las dificultades presentadas cuando el material a microencapsular o revestir presentan alguna ligera solubilidad en el disolvente del polímero filmógeno.33
Las primeras experiencias en microencapsulación de RII por Borodkin,12 se realizaron con resinas catiónicas débiles (carboxílicas) y fueron dirigidas al enmascaramiento de sabor. Desde entonces, se facilitó obtener perfiles de liberación adecuados con las RII para su aplicación en formas de liberación extendida, adicionando el control por difusión a través de una cubierta al control de la liberación ejercido por las leyes del intercambio iónico.
Los trabajos de Raghunathan34,35 dieron lugar al sistema Pennkinetic, que consiste en suspensiones de resinatos revestidos. Durante el proceso de obtención y antes del revestimiento con etilcelulosa en lecho fluidizado, se aplica a los resinatos un tratamiento de impregnación (con polietilenglicol, propilenglicol, glicerina u otros agentes), para evitar la rotura de la cubierta provocada por el hinchamiento de la matriz resinosa al contactar con un medio líquido, especialmente relevante cuando la operación de recubrimiento ha tenido lugar sobre el resinato seco que se hinchará al rehidratarse.
Nonomura y otros en 1990,25 plantean una solución diferente al problema de la preservación de la integridad de las cubiertas, mediante la adecuada selección del grado de entrecruzamiento de la RII, que rigidiza el resinato y evita el excesivo hinchamiento y la rotura de la película polimérica.
Los principales agentes filmógenos utilizados para el revestimiento y microencapsulación de los resinatos han sido: etilcelulosa,34 celulosa acetoftalato,36 celulosa acetobutirato,37 hidroxipro-pilmetilcelulosa ftalato,38 polimetacrilatos,25 ceras39 y poliamidas (nylon).33
Aplicaciones
Si nos referimos solo a las aplicaciones de las RII en la tecnología farmacéutica, se pueden considerar 3 tipos generales de aplicación: en aislamiento y purificación,6,7 en sistemas de cesión de fármacos y otras aplicaciones terapéuticas y médicas.En el primer grupo de aplicaciones llama la atención por su importancia y extensión, el uso de resinas para el tratamiento y obtención de agua farmacéutica por suavización y desmineralización o desionización,8,9 también se usan con frecuencia para neutralizar, purificar y fraccionar compuestos en aplicaciones analíticas y de obtención de fármacos.14,15
Entre las aplicaciones galénicas se conocen, su uso para enmascaramiento de sabores y olores,12,40 como desintegrante en formas sólidas orales,6,7 para aumentar la estabilidad de principios activos susceptibles a degradación,1,2,12,41 como portador de fármacos para dirigir selectivamente su cesión en órganos y tejidos,23,42 también como portador inerte, que por su forma de presentación multiparticular, esferoidal e isométrica facilita los procesos de revestimiento y microencapsulación13,30,33,43 y otras aplicaciones galénicas, como la eliminación de pirógenos.44 Sin embargo, la aplicación galénica más relevante es su empleo en la obtención de formas de liberación prolongada, donde se arguyen como ventajas, la sencillez de los procesos de obtención de los complejos fármacoresina, la dependencia funcional de la liberación con respecto a la fuerza iónica del medio,6,7 que fisiológicamente es muy estable; la poca dependencia demostrada entre la cinética de liberación y el pH del tracto gastro-intestinal (TGI), así como lo controlable que resultan muchos de los factores que afectan la velocidad de cesión.
Como aplicaciones terapéuticas y médicas pueden ser citadas, su uso en el diagnóstico de la acidez gástrica, la adsorción de productos tóxicos por hemoperfusión y en el control de los niveles plasmáticos de potasio y de colesterol.6,7,10,11
El mayor campo de aplicación de las RII para la prolongación de la liberación de los medicamentos es en la terapia por administración oral, ya que el paso obligado por el TGI enfrenta los resinatos a un medio rico en iones como son los jugos gastrointestinales. No sucede de igual forma con la adminsitración por vía tópica, donde el intercambio del resinato con el medio para liberar el medicamento, se ve limitado por la baja disponibilidad de iones presentes en la piel.45 Por vía parenteral, las RII han sido usadas para controlar el sitio de la liberación (targeting) mediante el uso de la quimioembolización en la terapia antitumoral,23,42 lográndose concentraciones de citostático a nivel del tumor 39 veces superiores a las encontradas en los tejidos sanos.
Pueden mencionarse algunos fármacos que han aparecido informados en combinación con RII: aminofilina,46 anfetamina,1,2,4 atropina,1,2,4 aminobutanona,40 blufo-medil,40 carbinoxamina,12 ciprofloxacina,40,47 claritromicina,40 clorfeniramina,27 codeína,28,29 cromoglicato disódico,48 dextrometorfan,34 diclofenaco,38 dihidrocodeína,25 diltiazem,49 doxorrubicina,23,42 efedrina,43,50 epinefrina,41 eritromicina,40 fenilpropanolamina,35 fenitoína,26 flurbiprofen,41 hidralazina,51 hidromorfona,52 ibuprofen,18 ketoprofen,18 levamisol,22 levobunolol,41 mefenámico ácido,18 metandifosfónico ácido,53 metapi-rileno,12 metoclopramida,52 morfina,52 pilocarpina,41 procainamida,20,21 propranol,16,17 pseudoefedrina,50,54 quinidina,14,15 quinina14,15 ranitidina,40 salbutamol,2,55,56 teofilina,13,30,57 tiopropazato4 y tobramicina47.
Un uso muy novedoso de las RII en la prolongación de la liberación de los medicamentos, fue informado por Zentner,49 al usar resinas aniónicas como carga eléctrica del mismo signo que el catión de un fármaco (diltiazem), ambos incluidos en un núcleo revestido de liberación con-trolada por la presión osmótica a través de la membrana del revestimiento y donde la RII ejerce un efecto similar al donnan, permitiendo hacer independiente la velocidad de liberación en relación con el pH del TGI. También por su originalidad y novedad se destaca el uso de las RII en formas flotantes, diseñadas para el caso de medicamentos con ventanas de absorción en regiones proxinales del TGI.46
SUMMARY
The study of the ion exchange resins as systems for the prolonged release was conducted, making emphasis on the factors affecting the formation of resinates or drug-resin complexes. The release of the active principles was also studied starting from the complexes and the finished forms containing them. The factors affecting this process and the kinetics to which it is adjusted were evaluated, too. The combinations of technological processes (mainly the formation of ion complexes and their coating) potentiating the usefulness of resinates to prolong the release by combined mechanisms of ion exchange and difussion through membranes, combinations directed to reduce the limitations inherent to each process separately and to achieve an efficient control of the release of ion drugs, were reviewed.Subject headings: ION EXCHANGE RESINS/chemistry; ION EXCHANGE; TECHNOLOGY, PHARMACEUTICAL; DRUG COMPOUNDING.
REFERENCIAS BIBLIOGRÁFICAS
- Alfonso Zerquera HM, Alba Delgado S, Armas y Leyva R de. Medicamentos de acción sostenida por resinas de intercambio iónico. Parte I. Rev Cubana Farm 1978;12:71-81.
- . Medicamentos de acción sostenida por resinas de intercambio iónico. Parte II. Rev Cubana Farm 1978;12:301-7.
- Bauman WC, Eichorn J. Fundamental properties of a synthetic cation exchange resin. J Am Chem Soc 1947;69:2830-6.
- Hirscher D, Miller O. Drug release from cation exchange resins. J Am Pharm Assoc 1962;NS2:105-8.
- Boyd GE, Adamson AW, Myers LS. Exchange adsorption of ions from aqueous solutions by organic zeolites. II: Kinetics. J Am Chem Soc 1947;69:2836-48.
- García Encina G, Seijo B, Boado I, Vila Jato JL, Torres D. Resinas de intercambio iónico como sistemas de liberación sostenida de medicamentos. I: factores que afectan a la formación del complejo iónico. Ind Farm 1993;(ene-feb):41-3.
- García Encina G, Seijo B, Boado I, Vila Jato JL, Torres D. Resinas de intercambio iónico como sistemas de liberación sostenida de medicamentos. II: factores que afectan al proceso de liberación. Ind Farm 1993;(mar-abr):59-64.
- Collentro WV. USP purified water systems. Discussion of ion exchange. Part I. Pharm Tech 1994;18(9):100-16.
- Collentro WV. USP purified water systems. Discussion of ion exchange. Part II. Pharm Tech 1994;18(10):56-76.
- Burt HM, Cameron EC, Erber H, Price JD. Ion exchange resins as potential phosphate binding agents for renal failure patients: effect of the physicochemical properties of resins on phosphate and bile salt binding. J Pharm Sci 1987;76(may):379-83.
- Homes WL. Cholestyramine. Clin Med 1970;77(apr):41-5.
- Borodkin S, Sundberg DP. Polycarboxylic acid ion exchange resin adsorbates for taste coverage in chewable tablets. J Pharm Sci 1971;60(oct):1523-27.
- Moldenhauer MG, Nairn JG. Formulation parameters affecting the preparation and properties of microencapsulated ion-exchange resins containing theophylline. J Pharm Sci 1990;79(8):659-66.
- Kanhere SS, Vyas AH, Bhat CV, Kamat BR, Shah RS. Studies with ion exchange resins on Cinchona alkaloids. III: Exchange rates. J Pharm Sci 1969;58(dec):1550-2.
- Kanhere SS, Vyas AH, Bhat CV, Kamat BR, Shah RS. Studies with ion exchange resins on Cinchona alkaloids. IV: effect of resin particle size on equilibrium exchange and column studies. J Pharm Sci 1971;60(feb):319-20.
- Burke GM, Mendes RW, Jambhekar SS. Investigation of the applicability of ion exchange resins as a sustained release drug delivery system for propranolol hydrochloride. Drug Dev Ind Pharm 1986;12(5):713-32.
- Irwin WJ, Belaid KA, Alpar HO. Drug delivery by ion exchange. Part III: interaction of ester pro-drugs of propranolol with cationic exchange resins. Drug Dev Ind Pharm 1987;13(9-11):2047-66.
- Irwin WJ, Belaid KA, Alpar HO. Drug delivery by ion exchange. Part VII: release of acidic drugs from anionic exchange resinate complexes. Drug Dev Ind Pharm 1990;16(6):883-98.
- Kril MB, Fung HL. Influence of hydrophobicity on the ion exchange selectivity coefficients for aromatic amines. J Pharm Sci 1990;79(may):440-3.
- Gyselink P, Severen R van, Braeckman P, Schacht E. Drug polymer combinations. Part 1: the preparation of sustained release drugs by combination with ion exchanging resins. Pharmazie 1981;36:769-72.
- Gyselink P, Severen R van, Braeckman P, Schacht E. Drug polymer combinations. Part 2: influence of the testing method on the in vitro drug release from ion exchange resins. Pharmazie 1982;37:672-81.
- Schacht E, Goethals E, Gyselinck P, Thienpont D. Polymer drug combinations. Part 6. Sustained release of levamisole from ion exchange resins. J Pharm Belg 1982;37(may-jun):183-8.
- Chan Y, Burton MA, Codde JP, Napoli S, Martins IJ, Gray BN. Evaluation of ion exchange microspheres as carriers for the anticancer drug doxorubicin: in vitro studies. J Pharm Pharmacol 1992;44:211-7.
- Farag Y, Nairn JG. Rate of release of organic carboxylic acids from ion exchange resins. J Pharm Sci 1988;77(mar):872-81.
- Nonomura M, Susuki Y, Yamada M. Takeda Chem. Ind. Ltd (assignee). Sustained release preparation and production thereof. US Pat. 4,894,239;1990, Jan 16.
- Laurent D, Guenzet J. In vitro adsorption of sodium phenytoin by anion exchange resin. Drug Intell Clin Pharm 1985;19(jul-aug):584-5.
- Ogger KE, Noory C, Gabay J, Shah VP, Skelly JP. Dissolution profiles of resin-based oral suspensions. Pharm Technol 1991;15(9):84-91.
- Plaizier-Vercammen JA. Investigation of the bioavailability of codeine from a cation-exchange sulfonic acid. Part 1. Effect of parameters. Int J Pharm 1992;85:45-50.
- Plaizier-Vercammen JA. Investigation of the bioavailability of codeine from a cation-exchange sulfonic acid. Part 2. Evaluation of release kinetics of codeine from the resinate and uptake of Na+ from the solution. Int J Pharm 1992;87(nov):31-6.
- Motycka S, Newth CJL, Nairn JG. Preparation and evaluation of microencapsulated and coated ion exchange resin beads containing theophylline. J Pharm Sci 1985;74(jun):643-6.
- Reichenberg D. Properties of ion exchange resins in relation to their structure. III. Kinetics of exchange. J Am Chem Soc 1953;75:589-98.
- Bhaskar R, Murthy RSR, Miglani BD, Viswanathan K. Novel method to evaluate diffusion controlled release of drugs from resinates. Int J Pharm 1986;28:59-66.
- García Encina G, Seijo B, Boado I, Vila Jato JL, Torres D. Microencapsulación de resinas de intercambio iónico. Ind Farm 1993;(jul-ago):17-24.
- Raghunathan Y. Pennwalt Corp. (assignee). Prolonged release pharmaceutical preparations. US Pat. 4,221,778;1980, Set. 9.
- Raghunathan Y, Amsel L, Hinsvark O, Bryant W. Sustained release drug delivery system. Part 1. Coated ion exchange resin system for phenylpropanolamine and other drugs. J Pharm Sci 1981;70(apr):379-84.
- Beyger JW, Nairn JG. Some factors affecting the microencapsulation of pharmaceuticals with Cellulose Acetate Phathalate. J Pharm Sci 1986;75(3):573-81.
- Sprockel OL, Prapaitrakul W. Effect of eluant properties on drug release from cellulose acetate butyrate coated drug resin complexes. Int J Pharm 1988;48(dec):217-22.
- Torres D, García Encina G, Seijo B, Vila Jato JL. Formulation and in vitro evaluation of HPMCP microencapsulated drug-resin complexes for sustained release of diclofenac. Int J Pharm 1995(a);121(jul):239-43.
- Kogan PW, Rudnic EM, Sequeira JA, Chaudry IA. Schering Corp. (assignee). Sustained release oral suspensions. US Pat. 5,186,930; 1993, Feb.16.
- Roy Glen M. Taste masking in oral pharmaceuticals. Pharm Tech 1994;18(4):84-99.
- Chang Nienyuan J. Allergan Inc. (assignee). Stable suspension formulations of bioerodible polymer matrix microparticles incorporating drug loaded ion exchange resin particles. US Pat.5,275,820;1994,Jan.4.
- Codde JP, Burton MA, Kelleher DK, Archer SG, Gray BN. Reduced toxicity of adriamycin by incorporation into ion exchange microspheres: A therapeutic study using a rat liver tumour model. Anticancer Res 1990;10:1715-8.
- Chow San L, Raghunathan Y. Fisons Corp. (assignee). Polymer treated ion exchange resins. US Pat.4,859,462;1989, Aug. 22.
- Budziszewski A. Adsorption of pyrogens on Polish made ion exchangers. Acta Pol Pharm 1970;27(1):47-52.
- Banerjee PK. Composition and method of controlling transdermal penetration of topical and systemic agents. Eur. Pat. Appl. EP 195, 643;1986, 24 set.
- Atyabi F, Sharma HL, Mohammad HA, Fell JT. Controlled drug release from coated floating ion exchange resin beads. J Controll Release 1996;42(oct):25-8.
- Wood LL, Calton GJ. Srchem Inc (assignee). Cryogel oral pharmaceutical composition containing therapeutic agent. US Pat.5, 288,503;1994,Feb.22.
- Illum L. Fisons Corp. (assignee). Pharmaceutical composition including sodium cromoglycate. US Pat. 4,847,091;1989,Jul.11.
- Zentner GM. Merck & Co. Inc. (assignee). Device for pH independent release of drugs through the Donnan like influence of charged insoluble resins. US Pat.4,795,644;1989,Jan.3.
- Pongpaibul Y, Sayed H, Whitworth CW. Preparation and evaluation of a long acting liquid antitussive product. Drug Dev Ind Pharm 1990;16(6):935-43.
- Ludden TM, Rotenberg KS, Ludden LK, Shepherd AM, Woodworth JR. Relative bioavailability of immediate and sustained release hydralazine formulations. J Pharm Sci 1988;77(dec):1026-32.
- Malkowska S, Burton IR, Prater DA, Norman AA. Euroceltique S.A. (assignee). Pharmaceutical ion exchange composition. US Pat. 5,071,646;1991,Dec. 10.
- Khanna SC, Green J. Ciba Geigy Corp. (assignee). Methanediphosphonic acid formulations with ion exchangers. US Pat. 5,344,825;1994, Set. 6.
- Wecker MT, Graves DA, Amsel LP, Hinsvark ON, Rotenberg KS. Influence of a standard meal on the absorption of controlled release pseudoephedrine capsules. J Pharm Sci 1987;76(jan):29-31.
- Alfonso Zerquera HM, Armas y Leyva R de, Bermúdez Barceló E, Alba Delgado S. Unión Industrial de Empresas de la Industria Médico Farmacéutica (assignee). Procedimiento para la preparación de un antiasmático de administración oral con efecto prolongado. Patente Cubana 46/87-445/90;1990(c), Abr. 20.
- Abdel Monem Sayed H, El Sayed AM, Hamed Osman AM, Fathy M. Design of sustained release formulations of salbutamol: part 1. Ion-exchange resin systems. Bull Pharm Sci Assiut Univ 1991(a);14(1-2):46-60.
- Warchol MP, Chrzan ZJ. Rhone Poulenc-Rorer Pharm. Inc. (assignee). Binding theophylline to ion exchange resins. US Pat.5,162,110;1992, Nov. 10.
Lic. Héctor M. Alfonso Zerquera. Centro Estatal de Control de Calidad de los Medicamentos. Ave 17 No. 20005, Siboney, municipio Playa. AP 16065, CP 11600, Ciudad de La Habana, Cuba.
2Licenciado en Ciencias Farmacéuticas. Aspirante a Investigador.
3Licenciada en Química. Jefa del Laboratorio de Control de la Calidad. Empresa Laboratorio Farmacéutico "Juan R. Franco".
4Doctor en Ciencias Farmacéuticas. Investigador Titular. Centro de Investigaciones y Desarrollo de Medicamentos.














