Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.35 n.2 Ciudad de la Habana Mayo-ago. 2001
Artículos de revisión
Centro de Investigación y Desarrollo de Medicamentos
Métodos de obtención de microesferas biodegradables
Diana Ramos Picos,1 Martha Gómez Carril2 y Dianelis Fernández Mena3
Resumen
La liberación controlada de agentes terapéuticos desde microesferas biodegradables poliméricas ha sido extensamente estudiada. El ácido poliláctico y sus copolímeros con el ácido glicólico se han utilizado en la preparación de microesferas debido a su biodegradabilidad y biocompatibilidad. Estas microesferas han sido preparadas por varios métodos de obtención, los que son revisados en este trabajo. Se plantean las ventajas y desventajas de algunos de los métodos de obtención. En el caso del método de evaporación/extracción del solvente, que es el más usado, se plantean las variables que pueden influir en este y se discuten algunas de ellas.
DeCS: MICROESFERAS; POLIMEROS; POLIGLACTINAGIO; TECNOLOGIA FARMACEUTICA; BIODEGRADACION; COMPOSICION DE MEDICAMENTOS.
Recientemente han resultado útiles para formulaciones de liberación controlada de uso parenteral los sistemas de liberación consistentes en polímeros biodegradables, debido a sus posibilidades de controlar la liberación del fármaco de forma efectiva. Entre estos polímeros han desempeñado una función importante los de los ácidos láctico y glicólico teniendo en cuenta su disponibilidad, biodegradabilidad, no toxicidad y biocompatibilidad.1
Dentro de estas formulaciones se encuentran las microesferas que se han utilizado exitosamente para encapsular una amplia variedad de principios activos, incluyendo citostáticos, antiinflamatorios, péptidos y hormonas, entre otros.2-5 Estas microesferas son partículas esféricas análogas de las microcápsulas pero sin una distinción clara entre núcleo y pared. Tiene una estructura monolítica preparada a partir de materiales biodegradables y con un gran espectro de velocidad de cesión y propiedades degradativas, donde el principio activo o agente terapéutico está distribuido a través de la matriz como una dispersión molecular o de partículas.
Se han usado varios métodos para la preparación de microesferas de diferentes polímeros biodegradables, incluyendo polímeros naturales y sintéticos. La selección de un método de preparación adecuado depende de las propiedades del polímero y el principio activo que se utilice y puede afectar las características de las microesferas.6
Este trabajo persigue el objetivo de revisar los métodos más empleados en la obtención de microesferas biodegradables obtenidas a partir del ácido poliláctico y/o glicólico.
Métodos de preparación
Existen varios métodos para la preparación de microesferas biodegrada-bles preparadas de polímeros de ácido láctico y glicólico.
El método de evaporación/extracción del solvente y de separación de fases son los 2 principales métodos usados para estos fines.
La elección de la técnica de micro-encapsulación se hace principalmente sobre la base de las características físico--químicas del polímero y del principio activo a encapsular y se deben tener en cuenta los requerimientos siguientes:
- El rendimiento de microesferas con el intervalo de tamaños deseado debe ser alto.
- La eficiencia de encapsulación del principio activo debe ser alta.
- La actividad biológica del principio activo debe mantenerse durante el proce-so de encapsulación.
- La reproducibilidad lote a lote en términos de un perfil cualitativo y de liberación del principio activo debe estar dentro de los límites especificados.
- El perfil de liberación debe ser ajustable mediante el control de la composición y las variables del proceso.
- Las microesferas no deben agregarse, deben ser un polvo fino que fluya libremente.
Por otra parte algunas de las propiedades de las microesferas deben ser optimizadas como son:
- Tamaño y distribución de tamaños.
- Propiedades de superficie.
- Carga de principio activo.
- Velocidad de liberación del principio activo.
- Velocidad de degradación de la matriz.
Otros aspectos como esterilidad, apirogenicidad y contenido de solvente residual tienen que ser satisfactorios.8
A continuación se discutirán varios métodos de preparación de microesferas obtenidas a partir de polímeros biodegradables.
1. Método de evaporación/extracción del solvente. En este método están incluidos todos los procesos en los que tiene lugar la eliminación del solvente, en el que está disuelto el polímero, ya sea por evaporación o por extracción de este. En todos los casos previamente tiene que formarse una emulsión. En dependencia de la naturaleza de la fase continua de la emulsión que se forme se clasificarán en técnicas de evaporación/extracción del solvente en fase acuosa o en fase oleosa.9-11
a) En fase acuosa:
- Método de la emulsión aceite en agua (o/w). En este método la fase orgánica que contiene el polímero y el principio activo se emulsifica en una fase acuosa que contiene un tensioactivo. Posterior-mente las gotas orgánicas emulsificadas que contienen el polímero y el principio activo son endurecidas como microesferas por eliminación del solvente orgánico.12
En la figura 1 aparece representado el esquema de preparación de este método.
Fig.1. Preparación del método de evaporación/extracción del solvente en fase acuosa o/w.
Ventajas del método o/w:
- Es ampliamente usado en la encapsulación de p.a. liposolubles, debido a que se logra una eficiente incorporación de principio activo lipofílicos.
- Amplio rango de tamaños (desde grandes hasta pequeños) esencialmente controlados por la velocidad y las condiciones de agitación.
- Las microesferas tendrán propiedades superficiales hidrofílicas, lo que permite su resuspensión sin agregación.
Desventajas del método o/w:
- La incorporación de principios activos solubles en agua es muy baja debido a la repartición del principio activo en la fase acuosa externa de la emulsión.9
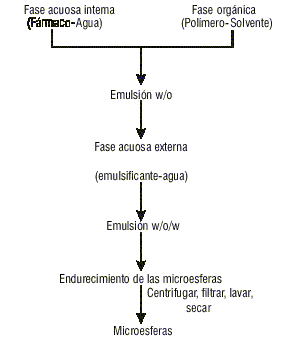
- Método de la emulsión agua en aceite en agua (w/o/w). También se conoce como método de la emulsión múltipe. Es una modificación del método o/w. Se utiliza para encapsular principios activos solubles en agua y se ha probado que es muy eficiente para encapsular este tipo de sustancia. En este método el principio activo se disuelve en agua (fase acuosa) y el polímero se disuelve en un solvente orgánico (fase orgánica). Ambas fases se mezclan obteniéndose la emulsión w/o, la que se adiciona lentamente sobre un medio acuoso que contiene un emulsificante como el alcohol polivi-nílico. Luego el solvente orgánico es eliminado y se obtienen las microesferas.9 En la figura 2 se muestra el esquema de preparación de este método.
Jeffery y otros prepararon microesferas de albúmina de ácido poliláctico-co-glicólico usando este método y evaluaron el efecto de los parámetros de la formulación sobre las características de las microesferas obtenidas.13-17
b) En fase oleosa:
- Emulsión o/o. Este método es otra modificación de la emulsión o/w y la fase continua estará formada por un líquido orgánico como el aceite mineral18,19 y se forma la emulsión o/o. Se usa para encapsular eficazmente principios activos solubles en agua.1
En la figura 3 aparece representado este método.
Fig. 2. Flujo para la obtención de las microesferas por el método de emulsión múltiple w/o/w.
Fig. 3. Preparación del método de evaporación/extracción del solvente en fase oleosa o/o.
Tsai y otros usaron este método para encapsular mitomicina C en microesferas de ácido poliláctico.20
Desventajas del método o/o:
- Se hace difícil la obtención de microesferas pequeñas (menores de 50 µm).21
- Las microsferas tienden a agregarse cuando se resuspenden en vehículos aucosos debido a la naturaleza hidrófoba de su superficie y la ausencia de un estabilizador hidrofílico.8
c) Otros métodos de multifase. Más recientemente se han reportado los siguientes:
- Emulsión w/o/w/o.22,23
- Emulsión w/o/o.23
- Emulsión w/o/o/o.24
Aunque el método de evaporación//extracción del solvente es conceptualmente simple, existen muchas variables que pueden influir en las características de las microesferas obtenidas.25-29 Estas variables son:
- Solvente orgánico.
- Naturaleza y cantidad de emulsificante.
- Naturaleza y solubilidad del principio activo.
- Temperatura de evaporación del sol-vente.
- Relación de volumen de las fases orgánica y acuosa.
- Relación principio activo y polímero.
- Estructura y masa molecular del polímero.
- Tipo y velocidad de agitación.
A continuación revisaremos las variables antes mencionadas:
Los solventes. Cuando se usa el proceso de evaporación/extracción del solvente, el solvente para los polímeros de ácido láctico/glicólico debe ser inmiscible o solo ligeramente soluble en el medio de suspensión (acuoso u oleoso). Bodmeier y Mcginity evaluaron el efecto de diferentes solventes en la formación de microesferas de ácido poli (DL-láctico).30-34 Ellos encontraron que los solventes miscibles en agua, como la acetona y el dimetilsulfóxido, no conducen a la formación de microesferas durante la emulsificación. Por el contrario, se forman aglomerados irregulares debido al rápido intercambio del solvente. Sin embargo, Kawashina Y, Yamamoto H y otros utilizan solventes como la acetona para realizar mezclas que contribuyen a mejorar el proceso de evaporación del solvente y así reducir el tiempo de formación de las microesferas.10 Adicionalmente, el punto de ebullición del solvente debe ser más bajo que el del medio de suspensión si el solvente es eliminado por evaporación. Los solventes más comúnmente utilizados son el acetato de etilo y el diclorometano, por su baja toxicidad, su fácil eliminación y su excelente habilidad para disolver polímeros. Otros solventes que se han usado son el cloroformo y el acetonotrilo. Si se desea la disolución del principio activo en la solución del polímero, se necesita tener también en consideración la habilidad del disolvente para disolver el principio activo. También se han utilizado mezclas de solventes para disolver el polímero y el principio activo,35 por ejemplo, diclorometano (inmiscible en agua) más metanol, etanol o propilenglicol (miscibles en agua). El uso de estos 3 últimos permite una rápida eliminación del solvente y una rápida precipitación del polímero.
Los emulsificantes. Los emulsificantes proporcionan una lámina fina protectora alrededor de las gotículas de aceite, polímero y principio activo, y de esta forma disminuyen la coalescencia y la coagulación y estabilizan el sistema emulsión. Frecuentemente, la dificultad inicial encontrada en el desarrollo de un procedimiento de microencapsulación es la aglomeración de las gotículas de aceite durante el proceso de fabricación. Cuando se está eliminando el solvente, el emulsificante continúa manteniendo las gotículas de aceite en su configuración esférica y las previene de la agregación hasta que el solvente es eliminado completamente y las microsferas son endurecidas como partículas discretas.9
Los emulsificantes más comúnmente empleados en el proceso de evaporación//extracción del solvente son los coloides poliméricos hidrofílicos y los surfactantes aniónicos o no iónicos. Ejemplos de ellos son el alcohol polivinílico,36-38 la poli-vinilpirrolidona, los alginatos,39 la gelatina,40 la metilcelulosa,41 la hidroxialquilcelulosa,30 el polisorbato,42,43 el span,20 la lecitina,43 etc. El emulsificante más comúnmente empleado en el método o/w es el alcohol polivinílico. La concentración requerida y la efectividad de cada emulsificante es diferente, y el mejor emulsificante para una aplicación en particular es determinado experimentalmente.
Las propiedades físico-químicas, las propiedades estructurales y la concentración del emulsificante influyen en las características de las microesferas.41,43-45 Generalmente se dice que para un emulsificante dado, a mayor concentración se obtienen microesferas más pequeñas. Sin embargo, han aparecido concentraciones limitantes, por encima de las cuales el emulsificante no aumenta su efecto. Esto se debe probablemente a que se haya alcanzado la concentración óptima de empaquetamiento de la emulsión.
Los principios activos. Debido a que el método o/w involucra una emulsión acuosa, este se limita a encapsular en las microesferas aquellos principios activos que presentan una baja solubilidad en agua, ya que si el principio activo es soluble en agua se repartirá desde la fase orgánica hacia la fase acuosa. Esta pérdida del principio activo traerá como resultado una pobre eficiencia de encapsulación.41,42 Por el contrario, los principios activos liposolubles como los esteroides, pueden ser encapsulados exitosamente en microesferas usando este método o/w.46
Para minimizar la pérdida de principios activos ionizables hacia la fase acuosa durante el proceso de microencapsulación o/w, el pH de la fase acuosa puede ajustarse para suprimir la ionización del principio activo y consecuentemente reducir la solubilidad de este en dicha fase. Este resultado negativo puede también reducirse por la previa saturación de la fase acuosa con el mismo principio activo. Wakiyama y otros observaron que al presaturar la fase acuosa de una emulsión con el principio activo (tetracaína) a encapsular aumentaba el contenido de este en las microesferas formadas.
Si el principio activo a ser incorporado en las microesferas es insoluble en el solvente usado para disolver el polímero, este puede ser pulverizado o micronizado para proporcionar una distribución homogénea de partículas discretas mediante la emulsión y la microesfera resultante. Si el principio activo no es completamente soluble en el solvente orgánico empleado, este puede cristalizar dentro de la microesfera a ciertas concentraciones. En este sentido los cristales deben concentrarse en algunas regiones de las microesferas, como en la superficie, dando una distribución heterogénea del principio activo que alterará su perfil de liberación.41,47
Estructura y masa molecular. La naturaleza del polímero, la secuencia de los monómeros y de ahí su masa molecular permiten ajustar la liberación del fármaco al tiempo en que se alcanzan las concentraciones terapéuticas en sangre.
Los polímeros de diferentes masas moleculares varían en sus viscosidades intrínsecas, parámetro que determina en la eficiencia del proceso de obtención de las microesferas y en sus propiedades.
El resto de los parámetros influyen en el proceso de optimización del método de obtención y están íntimamente relaciona-dos con el solvente, el polímero, el emulsificante y el principio activo.
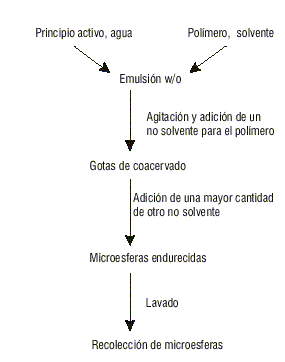
2. Método de separación de fases (coacervación). Es un método no acuoso de preparación de microesferas y es utilizado fundamentalmente para principios activos solubles en agua. Consiste en disolver primeramente el polímero en el solvente orgánico y el principio activo en agua. Luego la emulsión microfina se obtiene por la adición de la solución acuosa a la solución orgánica. Un primer no solvente para el polímero se adiciona lentamente al sistema, formándose las gotículas de coaservado que son muy blandas para ser recolectadas, por lo que se hace necesaria la adición de una mayor cantidad de un segundo no solvente para endurecer las microgotas, las que ahora serán llamadas microesferas (fig. 4).9
Desventajas del método de separación de fases:
- Frecuente aglomeración porque no hay un estabilizador.
- La variación lote a lote ha causado problemas tanto en el proceso de coacervación como en el perfil de velocidad de liberación.8
- Más costoso comparado con los otros métodos debido a la gran cantidad de solventes que se necesitan aumentando la contaminación ambiental.
Fig. 4. Método de separación de fases.
Muchos solventes para el polímero pueden usarse en el proceso de separación de fases. En comparación con el método de evaporación/extracción del solvente, los requerimientos para el solvente del polímero son menos rigurosos. El solvente no tiene que ser inmiscible con el agua y el punto de ebullición puede ser mayor que el del agua. Sin embargo, el solvente debe disolver solo al polímero y no al p.a., es decir, se prefiere que el p.a. esté disperso en lugar de disuelto en la solución que contiene el polímero.9
Algunos de los ejemplos de solventes para el polímero usado en la separación de fases, son: diclorometano, acetato de etilo, acetonitrilo y tolueno.
Los no solventes influyen sobre la separación de fases y sobre el endurecimiento de las nuevas microesferas formadas. Además, debe tenerse mucho cuidado en su selección. El no solvente no debe disolver al polímero o al principio activo, pero debe ser inmiscible con el solvente para el polímero. El primer no solvente debe ser fácilmente removido por lavado con el segundo no solvente. El segundo no solvente debe ser relativamente volátil. Ejemplos del primer no solvente son líquidos viscosos polibutadienos líquidos de bajo peso molecular; polímeros metacrílicos líquidos de bajo peso molecular, aceite de silicona, aceites vegetales y aceite de parafina líquida.7,48,49 Los hidrocarbones alifáticos como el heptano, hexano y éter de petróleo se han usado comúnmente como segundo no solvente.50
Fong patentó una única técnica de separación de fases que utiliza bajas temperaturas,51 donde microencapsuló 2 principios activos en ácido poliláctico usando tolueno como solvente para el polímero e isopropanol como único no solvente.
Ruiz y otros también estudiaron el proceso de separación de fases usando ácido polilácticocoglicólico para formar microesferas que contenían triptorelina53 y concluyeron que la naturaleza físico-química del polímero, la concentración del polímero, la viscosidad del aceite de silicona y la relación polímero-aceite de silicona afectaban la estabilidad del sistema emulsión en el proceso de separación de fases y por tanto la formación y calidad de la microesfera.
3. Otros métodos. A continuación mencionamos otros métodos que han sido utilizados para la obtención de microesferas biodegradables pero en una menor cuantía (Conti B, Pavanetto F, Genta I, Giunchedi P. Solvent evaporation, solvent extraction, and spray drying for polylactide microspheres preparation. Proc Pharm Technol Conf, bologna, 1991 (April 16-18):16-9).
- Secado por atomización.53-55
- Fusión en caliente.56
- Secado en frío.57
- Fluidización.57
La selección se fundamenta en las características del principio activo que se va a encapsular y por las ventajas que ofrece este método como son su reproducibilidad y bajo costo.
Summary
The controlled release of therapeutic agents from polymeric biodegradable microspheres has been widely studied. Polylactic acid and its copolymers with glycolic acid have been used in the preparation of microspheres because of their biodegradability and biocompatibility. These microspheres have been prepared by various methods which are reviewed in this paper. As to their most used solvent evaporation-extraction method. The variables that might affect it are set forth here and some of them are also discussed.
Subject headings: MICROSPHERES; POLYMERS; POLYGHANTINGIO; TECHNOLOGY, PHARMACEUTICAL; BIODEGRADATION; DRUG COMPOUNDING.
Referencias bibliográficas
- Sánchez BA, Tobio BM, Alonso MJ. Los copolímeros del ácido láctico y glicólico. Características y aplicaciones en la liberación de macromoléculas. Ind Farm 1995(1):69-6.
- Ike O, Shimizu Y, Wada R, Hyon SH, Ikada Y. Controlled cisplatin delivery system using poly (DL-lactic acid). Biomaterials 1992(13):230-4.
- Ogawa Y, Okada H, Shimamoto T. Controlled release of LHRH agonist, leuprolide acetate from microspheres: Serum drug levels profiles and pharmacological effects in animals. J Pharm Pharmacol 1989(41):439-4.
- Heya T, Okada Y, Ogawa Y, Toguchi H. Factors influencing the profiles of TRH release from copoly (d,1 lactic/glicolic acid) microspheres. Int J Pharm 1991(72):199-5.
- Hermann J, Bodmeier R. Peptide containing biodegradable microspheres prepared by modified solvent evaporation methods. Proceed. Intern. Symp. Control Rel. Bioact Mater 1993(20):258-9.
- Pavanetto F, Conti B, Genta I, Giunchedi P. Solvent evaporation, solvent extration and spray drying for polylactide microsphere preparation. Int J Pharm 1992(84):151-9.
- Fong JW. Microencapsulation by solvent evaporation and organic phase separation processes. En: Hsieh D, ed. Controlled release systems: fabrication technology; Boca Raton: CRC Press, 1988;vol 1:81-108.
- Whateley TL. Biodegradable microspheres for controlled delivery, En: Whaterley TL, ed. Encapsulation and controlled release, Reino Unido: Harwood Acad, 1993:57.
- Wu XS. Preparation, characterization, and drug delivery applications of microspheres based on biodegradable lactic/glycolic acid polymers. En: Wise DL, Trantolo DJ, Altobelli DE, Yaszemski MJ, Gresser JD, Schwartz ER, eds. Encyclopedic handbook of biomaterials and bioengineering. New York: Marcel Dekker, 1995:1151-60.
- Kawashima Y, Yamamoto H, Takeushi H, Hino T, Niwa T. Properties of a peptide containing DL-lactide-glicolyde copolymer nanospheres prepared by novel emulsion solvent diffusion methods. Eur J Pharm Biopharm 1998(45):41-8.
- Gamisans F, Lacoulonche F, Chauvet A, Espina M, García ML, Egea MA. Flurbiprofen-loaded nanospheres: analysis of the matrix structure by thermal methods. Int J Pharm 1999(179):37-8.
- Görner T, Gref R, Michenot D, Sommer F, Tran MN, Dellacheire E. Lidocaine-loaded biodegradable nonospheres. I. Optimization of the drug incorporation into the polymer matrix. J Controlled Rel 1999(57):259-8.
- Jeffery H, Davis SS, O´Hagan DT. The preparation and characterization of poly (lactide-coglycolide) microparticles. II the entrapment of a model protein using a (water-in-oil)-in-water emulsion evaporation technique. Pharm Res 1993(10):362-8.
- Yamakawa I, Ishida M, Kato T, Ando H, Asakawa N. Release behavior of Poly (Lactic Ac-co-Glycolic Acid) implants containing phosphorothioate oligodeoxynucleotide. Biol Pharm Bull 1997; 20(4):455-9.
- Uchida T, Nagareya N, Sakakibara S, Konishi Y, Nakai A, Nishikata M, et al. Preparation and characterization of Poly lactic Acid microspheres containing bovine insulin by a w/o/w emulsion solvent evaporation method. Chem Pharm Bull 1997;45(9):1539-3.
- Okada H. Preface. Advan Drug Del Rev 1997(28):1-3.
- Okada H. One _and tree_ month release injectable microspheres of the LH-RH superagonist leuprolerin acetate. Adv Drug Del Rev 1997(28):43-70.
- Leelarassama N, Howard SA, Malanga CJ, Cuzzi LA, Hogan TF, et al. Kinetic of drug release from polylactic acid-hidrocortisone microcapsules. J Microencapsulation 1986(3):171.
- Spenlehauer G, Spenlehauer-Bonthonneau CF, Thies C. Biodegradable microparticles for delivery of polypeptides and proteins. En: Butterfield DA, ed. Progress in clinical and biological research. New York: Alan R. Liss, 1989:283-1.
- Tsai DC, Howard SA, Hogan TF, Malangu CJ, Ma JK. Preparation and in vitro evaluation of polylactic acid-mitomycin C microcapsules. J Microencapsulation 1986(3):181-3.
- Jalil R, Nixon JR. Biodegradable poly (lactic acid) and poly (lactic-co-glycolide) microcapsules: Problems associated with preparative techniques and release properties. J Microencapsulation 1990(7):297.
- Iwata M, McGinity JW. Dissolution, stability and morphological properties of conventional and multi-phase poly (dl-lactic-co-glycolic acid) microspheres containing water-soluble compounds. Pharm Res 1993;(10):1219-7.
- Yen MK, Coombes AGA, Jenkins PG, Daris SS. A novel emulsification-solvent extraction technique for production of protein loaded biodegradable microparticles for vaccine and drug delivery. J Controlled Rel 1995(33):437-5.
- Iwata M, McGinity JW. Prepartion of multi-phase microspheres of poly (dl-lactic acid) and PLGA containing a w/o emulsion by a multiple emulsion solvent evaporation technique. J Microencapsulation 1992(9):201-14.
- Jalil R, Nixon JR. Microencapsulation using poly (L-lactic acid). IV. Release properties of microcapsule containing phenobarbitone. J Microencapsulation 1990(7):53-6.
- Thies C, Bissery C. Biodegradable microspheres for parenteral administration. En: Lim F, ed. Biomedical applications of microencapsulation. Boca Raton: CRC Press, 1984:53-74.
- Jalil R, Nixon JR. Microencapsulation using poly (DL-lactic acid). I. Effect of preparative variables on the microcapsule characteristic and release kinetic. J Microencapsulation 1990(7):229-44.
- Jalil R, Nixon JR. Microencapsulation using poly (DL-lactic acid). II. Effect of polymer molecular weight on the microcapsule properties. J Microencapsulation 1990(7):245-4.
- Jalil R, Nixon JR. Microencapsulation using poly (Lo-lactic acid). III. Effect of polymer molecular weight on the microcapsule properties. J Microencapsulation 1990(7):41-52.
- Bodmeier R, McGinity W. Solvent selection in the preparation of poly (DL-lactide) microspheres prepared by the solvent evaporation method. Intern J Pharm 1988(43):179-6.
- Morlock M, Winter G, Kissel T. Microencapsulation of rh-erythropoietin using biodegradable Poly (DL-lactide-co-glycolide): protein stability and the effects of stabilizing excipients. Eur J Pharm Biopharm 1997(43):29-6.
- García L, Abu-Izza K, Lu DR. Biodegradable cisplatin microsphere for direct brain injection preparation and characterization. Pharm Dev Tecnol 1997(2):53-5.
- Salmore MD, Hernández PJ, Cerezo A. Encapsulation study of 6-methylprednisolone in lipid microsphere. Drug Dev Ind Pharm 1997(23):133-6.
- Rafler G, Johmann M. Controlled release systems of biodegradable polymers. Part 5: microparticles preparation by a salting-out process. Pharm Ind Germany 1997(59):622-4.
- Herrmann J, Bodmeier R. Peptide-containing biodegradable microspheres prepared by modified solvent evaporation methods. Proc Int Symp Control Rel Bioact Mater 1993(20):258-9.
- Beck LR, Cowsar DR, Lewis DH. Systemic and local delivery of contraceptive steroids using biodegradable microcapsules. En: Hafez ESE. Progress in contraceptive delivery systems. Lancaster: MTP Press, 1980:63-81.
- Beck LR, Cowsar DR, Lewis DH, Cosgrove RJ, Riddle CT, Lowry SL, et al. A new long-acting injectable microcapsule system for the administration of progesterone. Am Fertil Soc 1979(31):545-51.
- Wang HT, Palmer H, Linhardt RJ, Flanagan Dr, Schmitt E. Controlled release of protein and vaccines from poly (ester) microspheres in vitro. En: Gebelein CD et al, eds. Cosmetic and pharmaceutical applications of polymers. New York: Plenum, 1991:239-53.
- Arshady R. Biodegradable microcapsular drug delivery systems: Manufacturing methodology, release control and targeting prospect. J Bioact Compatible Polym 1990(5):315-34.
- Wakiyama N, Juni K, Nakano M. Preparation and evaluation in vitro and in vivo of polylactic acid microspheres containing dibucaine. Chem Pharm Bull 1982(30):3719-27.
- Spenlehauer G, Benoit JP, Veillard M. Formation and characterization of poly (DL-lactide) microspheres for chemoemobilization. J Pharm Sci 1986(75):750-55.
- Bodmeier R, McGinity JW. Poly (lactic acid) microcapsules containing quinidine base and quinidine sulphate prepared by solvent evaporation technique. J Microencapsulation 1987(4):279-88.
- Bodmeier R, McGinity JW. Poly (lactic acid) microspheres containing quinidine base and quinidine sulphate prepared by solvent evaporation technique. II. Some process parameter influencing the preparation and properties of microspheres. J Microencapsulation 1987(4):289-97.
- Juliane MC, Alonso MJ, Gomez Amoza JL, Benoit JP. Preparation of poly (DL-lactide/glycolide) nanoparticles of controlled particle size distribution: Aplication of experimental designs. Drug Dev Ind Pharm 1992(18):1063-77.
- Wakiyama N, Juni K, Nakano M. Preparation and evaluation in vitro of poly (lactic acid) microspheres containing local anesthetics. Chem Pharm Bull 1981(29):3363-68.
- Bodmeier R, McGinity JW. The preparation and evaluation of drug-containing poly (DL-lactide) microspheres formed by the solvent evaporation. Pharm Res 1987(4):465-71.
- Spenlehauer GM, Vert M, Benoit JP, Chabot F, Veillard M. Biodegradable cisplatin microspheres prepared by the solvent evaporation method: Morphology and release characteristics. J Contr Rel 1988(7):217-29.
- Tice TR, Meyers WE, Lewis DH, Cowsar DR. Controlled release of ampicillin and gentamicin from biodegradable microcapsules. Proceeding intern symp Control Rel Bioact Mater 1981(8):108-11.
- Kent JS, Sanders LM, Lewis DH, Tice TR. Microencapsulation of water soluble polypeptides. Eur Patent Appl 1982(52):510.
- Wang HT, Palmer H, Linhardt RJ, Glanagan DR, Echmitt E. Degradation of poly (ester) microspheres. Biomaterials 1990(11):679-85.
- Fong JW. Process for preparation fo microspheres; US Patent; 1979;(4):166-800.
- Ruiz JM, Tissier B, Benoit JP. Microencapsulation of peptide: a study of the phase separation of poly (DL-lactic-co-glycolic acid) copolymer 50/50 by silicone oil. Int J Pharm 1989(49):69-77.
- Linhardt RJ, Flanagan DR, Schmitt E, Wang HT. Quantitative analysis of the monomer product formed on the hydrolysis of poly (ester) and poly (anhidrides). Polym Prepr 1989(30):464-5.
- Linhardt RJ, Flanagan DR, Schmitt E, Wang Ht. Biodegradable poly (esters) and the delivery of bioactive agents. Polym Prepr 1990(31):249-50.
- Wichert B, Rohdewald P. A new method for the preparation of drug containing polylactic acid microparticles without using organic solvent. J Contr Rel 1990(14):269-83.
- Shanh D, Shah Y, Prodhan R. Development and evolution of controlled-release diltiazen HCL microparticles using cross-linked polyvinyl alcohol. Drug Dev Ind Pharm 1997(27):567-74.
- Aftabrouchad C, Doelker E. Méthodes de préparation des microparticules biodégradables chargées en principes actifs hydrosolubles. STP Pharm Sci 1992(2):365-80.
Recibido: 27 de noviembre del 2000. Aprobado: 31 de enero del 2001.
M.Sc. Diana Ramos Picos. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605 entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, Ciudad de La Habana, CP 10600, Cuba.
1 Master en Ciencias en Tecnología y Control de los Medicamentos. Investigadora Aspirante.
2 Master en Ciencias en Tecnología y control de los Medicamentos. Investigadora Auxiliar.
3 Licenciada en Ciencias Farmacéuticas. Especialista.