Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.36 n.1 Ciudad de la Habana ene.-abr. 2002
Artículos Originales
Instituto de Farmacia y Alimentos.
Universidad de La Habana
Diseño y evaluación de nuevas formulaciones de tabletas de acetato de cortisona (25 mg)
Lissette González Chávez,1 Yadira González Herrera,2 Mirtha Castiñeira Díaz,3 Esther Alonso Jiménez,4 Miriam Moya Jure5 y Antonio Iraizoz Colarte6
Resumen
Se produjeron 3 formulaciones diferentes de tabletas de acetato de cortisona (25 mg) a escala de laboratorio, con el objetivo de obtener una formulación que cumpla con los parámetros establecidos en la Farmacopea Británica (2000), específicamente el parámetro de disolución con el cual no cumple la formulación actual. En las 3 formulaciones estudiadas se sustituyó la solución aglutinante de la formulación actual (gelatina-almidón) por la polivinilpirrolidona en solución alcohólica y se adicionó desintegrante extragranular (acdisol), entre otras variaciones. Las tabletas se analizaron teniendo en cuenta las características tecnológicas y analíticas según las especificaciones de calidad de las farmacopeas oficiales; se realizaron además el ensayo de uniformidad de contenido, con el empleo de un método espectrofotométrico previamente validado. Se estudió la estabilidad física y química de las 3 formulaciones ensayadas por un período de 3 a. Todas las formulaciones cumplieron con los parámetros de calidad establecidos, recién fabricadas y durante el período de vida útil estudiado, lo cual soporta la factibilidad para su producción a escala piloto.
DeCS: QUIMICA FARMACEUTICA; CONTROL DE CALIDAD; ESTABILIDAD DE MEDICAMENTOS; CORTISONA/administración & dosificación; CORTISONA/análisis; CORTICOSTEROIDES/adminsitración & dosificación; CORTICOSTEROIDES/análisis; COMPRIMIDOS/análisis; TECNOLOGIA FARMACEUTICA.
El acetato de cortisona (AC) es un corticosteroide semisintético que se presenta en diversas formas farmacéuticas y se emplea en el tratamiento de enfermedades como insuficiencia adrenocortical, el lupus eritematoso sistémico, el reumatismo articular y la enfermedad de Adison por su acción antiinflamatoria, antirreumática y antialérgica.1,2
La formulación actual de tabletas de AC (25 mg) producidas en el país no cumple con el ensayo de disolución establecido por las farmacopeas actuales. Este ensayo tiene gran significación por ser un arma cualitativa que brinda información sobre la disponibilidad biológica de un fármaco, y desde el punto de vista tecnológico asegura la reproducibilidad entre un lote y otro. El ensayo de disolución es considerado hoy, la prueba más importante del control de la calidad de las formas farmacéuticas sólidas de dosificación, donde el principio activo debe disolverse en el ambiente acuoso del tracto gastrointestinal para ser absorbido.3
Con vistas a resolver este problema nos propusimos diseñar y elaborar formulaciones de tabletas de AC a escala de laboratorio, con adecuada calidad tecnológica, que cumplan con los controles de calidad exigidos por la Farmacopea Bri-tánica (2000)4 y realizar su estudio de estabilidad.
Métodos
Diseño de la formulación. Se prepararon 3 formulaciones (A, B, C) con los excipientes que se muestran en la tabla 1. La elaboración de los granulados en todos los casos se sigue por el método de vía húmeda tradicional a escala de laboratorio y en el caso de la formulación C, el principio activo se disolvió previamente en suficiente cloroformo formando una solución, la cual se mezcló con la masa en proporción 1:1. El proceso de compresión se realizó en una troqueladora de simple impacto con troquel de ¼ plano biselado ranurado ajustado a una masa de 120 mg.
Tabla 1. Composición de las 3 formulaciones elaboradas. Escala de laboratorio
| Componentes | A | B | C |
| Acetato de cortisona (mg) | 25 | 25 | 25 |
| Almidón de maíz (masa) | X | X | X |
| Acdisol intragranular (%) | 0,5 | 1 | 0,5 |
| Lactosa | X | X | X |
| Polivinilpirrolidona etanólico 10 % | X | X | X |
| Talco (%) | 3 | 1,5 | 1,5 |
| Estearato de magnesio (%) | 1 | 0,5 | 0,5 |
| Acdisol extragranular (%) | 0,5 | 1 | 0,5 |
| Cloroformo | - | - | X |
Todas las materias primas empleadas cumplen con las especificaciones de la United States Pharmacopoeia XXIV y el solvente es de calidad analítica.
Control de calidad del producto terminado. Se determinaron las propiedades físico-mecánicas y tecnológicas de las tabletas de las 3 formulaciones ensayadas a través de la determinación del peso promedio,5-7 dureza,6-7 friabilidad5,7 altura,6,7 tiempo de desintegración y 1 ensayo de disolución.5 El análisis químico se realizó según los requerimientos de la BP-20004 que exige los ensayos de identificación por cromatografía en capa delgada (CCD) y espectrofotometría infrarroja (lR), sustancias relacionadas por CCD y valoración por cromatografía líquida de alta resolución (CLAR). El ensayo de uniformidad de contenido se realizó empleando un método espectrofotométrico desarrollado y validado previamente (González L. Estudio tecnológico y analítico de tabletas de acetato de cortisona (25 mg). Tesis en opción al título de Master en Tecnología y Control de los Medicamentos. Universidad de La Habana, 1997).
Estabilidad. Se realizó mediante el estudio de vida de estante una vez comprobado que las 3 formulaciones elaboradas a escala de laboratorio cumplieron con el control químico-físico y tecnológico inicial. Para este se almacenaron muestras de cada una de ellas en condiciones ambientales de temperatura y humedad y se analizaron a los 6, 12, 24 y 36 meses de fabricadas. Por otra parte, de cada una de las formulaciones se tomaron aleatoriamente tabletas que se expusieron a la luz solar durante 24 meses en envases de vidrio transparente. La estabilidad física se realizó teniendo en cuenta las características organolépticas y propiedades físicomecánicas y tecnológicas de las tabletas;5-7 la estabilidad química se determinó por CCD (según el ensayo de sustancias relacionadas4 y para la cuantificación de AC, la CLAR de fase reversa previamente desarrollada y validada para estudios de estabilidad, así como el ensayo de disolución establecido para este producto por la USP XXIV.
Resultados
Control de calidad del producto terminado. Las 3 formulaciones estudiadas respondieron adecuadamente a los ensayos de evaluación tecnológica, como las pruebas físico-químicas de los granulados (resultados no mostrados) y físico-mecánicas y tecnológicas de las tabletas. La tabla 2 resume estos últimos resultados.
Tabla 2. Propiedades físico-mecánicas y tecnológicas de las diferentes formulaciones de AC recién fabricadas y a los 3 a de estudio
| Formulaciones | A | B | C | |||
| Propiedades | T=0 | T=3 años | T=0 | T=3 a | T=0 | T=3 a |
| Peso promedio (mg) | 128,16 ± 0,001 | 125,57 ± 0,001 | 127,79 ± 0,002 | 126,21± 0,002 | 127,43± 0,002 | 128,48 ± 0,001 |
| Altura (mm) | 3,25 ± 0,10 | 3,21 ± 0,13 | 3,23 ± 0,02 | 3,30 ± 0,06 | 3,22 ± 0,00 | 3,19 ± 0,13 |
| Dureza (kgf) | 4,05 ± 0,16 | 7,80 ± 1,11 | 4,40 ± 0,51 | 10,37 ± 1,56 | 5,01 ± 0,78 | 9,20 ± 0,13 |
| Friabilidad (%) | 0,04 ± 0,06 | 0,05 ± 0,07 | 0,19 ± 0,02 | 0,06 ± 0,04 | 0,11 ± 0,21 | 0,08± 0,06 |
| Abrasividad (%) | 0,09 ± 0,15 | 0,03 ± 0,08 | 0,21 ± 0,03 | 0,09 ± 0,10 | 0,12 ± 0,18 | 0,03 ± 0,06 |
| HFR | 101,25 | 156,0 | 23,16 | 172,83 | 45,54 | 115 |
| Desintegración (min) | 2,30 | 3,44 | 1,45 | 3,56 | 2,30 | 3,30 |
Los resultados correspondientes al control de la calidad fueron satisfactorios y cumplieron con las especificaciones y límites exigidos por la Farmacopea Británica 2000,4 como puede comprobarse en la tabla 3, excepto en el caso de la disolución que cumple con las especificaciones de la USP XXIV.
Tabla 3. Estudio de estabilidad. Vida útil de las formulaciones ensayadas por 3 a
| Formulaciones | A | B | C | |||
| Propiedades | T = 0 | T = 3 a | T = 0 | T = 3 a | T = 0 | T = 3 a |
| CCD (Rfp = 0,81) | Rfm = 0,81 | Rfm = 0,80 | Rfm = 0,81 | Rfm = 0,81 | Rfm = 0,81 | Rfm = 0,80 |
| Disolución (%) | 98,53 | 106,87 | 96,20 | 90,14 | 101,35 | 97,67 |
| Espectrofotometría UV | 96,32 | 105,36 | 98,57 | 106,25 | 98,43 | 91,64 |
| 89,75 | 103,48 | 89,21 | 102,77 | 100,16 | 90,78 | |
| 91,66 | 94,45 | 88,44 | 98,41 | 94,38 | 98,96 | |
| 95,60 | 90,72 | 95,37 | 78,38 | 97,45 | 94,66 | |
| 87,73 | 94,82 | 92,48 | 97,54 | 98,54 | 103,26 | |
| Contenido de AC (%) | 104,72± 0,001 | 98,21± 0,002 | 104,70± 0,002 | 97,79± 0,01 | 99,62± 0,03 | 95,68 ± 0,001 |
| CLAR |
* Rfp: Rf obtenido por la solución estándar de AC. Rfm: Rf obtenido por la solución muestra de cada formulación analizada.
Los espectros de absorción al IR obtenidos para la materia prima de AC y las tabletas de las 3 formulaciones mostraron correspondencia en cuanto al número y posición de bandas e igual complejidad en la zona de la huella dactilar (1 500-700 cm-3). La identificación de esteroides por CCD mostró resultados sastifactorios ya que la mancha obtenida por la solución estándar de AC y por cada una de las formulaciones tienen similares Rf (resultados no mostrados).
La cuantificación del principio activo en cada una de las formulaciones mostró porcentaje de AC permisibles de acuerdo con lo establecido para este producto (90-110 %), lo cual garantiza el cumplimiento del nivel de principio activo que declara la formulación.
Los resultados del ensayo de uniformidad de contenido se exponen en la tabla 4, donde las 3 formulaciones cumplen con este ensayo al encontrarse el contenido del fármaco dentro de los límites establecidos (85-115 %), con una desviación estándar relativa menor del 6 %.
Tabla 4. Resultados del ensayo de uniformidad de contenido a las formulaciones ensayadas
| A | B | C | |
| 106,55 | 102,60 | 104,00 | |
| 113,13 | 112,70 | 100,60 | |
| 112,47 | 106,66 | 93,33 | |
| 111,93 | 108,00 | 100,30 | |
| Contenido del | 106,07 | 103,30 | 100,33 |
| fármaco (%) | 113,00 | 106,60 | 105,53 |
| 105,20 | 112,60 | 108,86 | |
| 106,53 | 106,70 | 105,86 | |
| 107,63 | 106,60 | 104,88 | |
| 113,43 | 106,70 | 104,33 | |
| DSR (%) | 3,23 | 3,08 | 3,54 |
Estabilidad. Las tabletas de las formulaciones A, B y C analizadas mantuvieron constantes durante los 3 a de estudio las propiedades organolépticas de color y olor. Los resultados obtenidos en su evaluación tecnológica fueron también satisfactorios (tabla 2). En cuanto a los ensayos de identificación y valoración, para todas las formulaciones se comprobó que las tabletas cumplieron con todos los parámetros y se mantuvieron dentro de los límites exigidos por la farmacopea4 al igual que para el caso del parámetro de disolución, pero según USP XXIV.
Las muestras de las formulaciones A, B y C que se expusieron a la luz solar durante 24 meses evidenciaron un contenido de fármaco igual a 98,1; 100,80 y 98,83 % respectivamente y no mostraron manchas correspondientes a productos de degra-dación en sus cromatoplacas, lo que demuestra la no influencia de este factor en la degradación de AC.
Discusión
Las 3 formulaciones diseñadas a escala de laboratorio presentan adecuada calidad tecnológica y analítica por un período de 36 meses, inclusive para el parámetro de disolución, aspecto central que se trataba de resolver por constituir un indicador esencial en la calidad de las tabletas.
Para el diseño de las formulaciones se tuvo en cuenta que la solución aglutinante que presenta la formulación actual compuesta por gelatina y almidón puede brindar una elevada cohesión entre partículas, obteniéndose gránulos sumamente duros que conspiran contra la efectividad del proceso de disolución, y se sustituyó por polivinilpirrolidona (PVP) en solución alcohólica. Además se incorporó el acdisol como desintegrante intragranular y extragranular en diferentes proporciones, debido a que la formulación anterior carece de desintegrantes extragranulares que faciliten la desintegración de las tabletas, existiendo solo almidón intragranularmente con la finalidad específica de excipiente.
Por otra parte se disminuyó al 2 % el total de lubricantes en la formulación producto de la hidrofobicidad característica del talco y el estearato de magnesio,6,8 evitando así que estos reduzcan la superficie interfacial eficaz droga-solvente mediante el cambio de las características superficiales de las tabletas, lo cual provoca una disminución de su humidificación, prolongando su tiempo de desintegración.9,10
El AC como corticosteroide, es un fármaco poco soluble en medios acuosos,1,5 y esta es una característica determinante en la disolución, por lo que como última variación se disolvió el principio activo en la cantidad mínima necesaria de cloroformo con el objetivo de obtener un pequeñísimo tamaño de partícula, mejorando su disolución por un aumento de la superficie de contacto sólido-líquido. Esta operación intermedia favorece lógicamente alcanzar una mejor distribución del fármaco en la masa y por ende garantizar una adecuada uniformidad de contenido.8,10,11 El método de preparación de las tabletas fue por vía húmeda tradicional, pues se ha demostrado que el fármaco no se afecta con la utilización de solventes en la humectación, ni por los regímenes de temperatura que se utilizan en el secado (50 °C); además, la granulación húmeda puede aumentar la velocidad de disolución de fármacos pobremente soluble mediante el otorgamiento de propiedades hidrofílicas a la superficie de los gránulos.
Es importante destacar como desde el punto de vista tecnológico, los valores de peso promedio en todos los casos se en-cuentran dentro de los límites permitidos (108-132 mg) y muestran también adecuados valores de altura. La reproducibilidad de estos valores mediante cada formulación demuestra que se mantuvo la presión de compresión prácticamente invariable. Los resultados del porcentaje de pérdida de masa por friabilidad (menor del 3 %) y abrasividad (menor del 5 %) se mantuvieron dentro de los límites, trayendo consigo valores de HFR (Hardeness and Friability Relation) muy por encima de 1,5. Esto habla muy favorablemente de la resistencia mecánica de las tabletas, lo cual no afectó en lo absoluto la biodisponibilidad, pues se obtienen valores de desintegración muy por debajo de los 30 min establecidos y valores superiores al 65 % establecido para el ensayo de disolución. Además el contenido de AC disuelto a los 30 min de las formulaciones están en correspondencia con los resultados obtenidos para tabletas de este principio activo comerciales reconocidas en el mercado internacional.3 El ensayo de uniformidad de contenido es un indicador fundamental a la hora de evaluar cómo ha transcurrido el proceso tecnológico y la calidad de las tabletas logradas en cuanto a la distribución homogénea del principio activo, por lo que se realizó este ensayo basado en una técnica espectrofotométrica UV desarrollada y validada previamente para este análisis (González L. Estudio tecnológico y analítico de tabletas de acetato de cortisona 25 mg. Tesis en opción al título de Master en Tecnología y Control de los Medicamentos. Universidad de La Habana, 1997).
Los resultados satisfactorios obtenidos en todos los casos demuestran la buena dispersión del AC aun en la formulación C, donde el proceso tecnológico tiene mayor complejidad.
Con el estudio en estante se comprueba el mantenimiento de las propiedades tecnológicas y químicas en el tiempo y así establecer su fecha de vencimiento.14,15 Los corticosteroides se consideran compuestos bastante estables y aun más si se encuentran inmersos en una forma farmacéutica sólida,16,17 además teniendo en cuenta resultados previos obtenidos en un estudio de preestabilidad de este fármaco realizado por González L (González L. Estudio tecnológico y analítico de tabletas de acetato de cortisona 25 mg. Tesis en opción al título de Master en Tecnología y Control de los Medicamentos. Universidad de La Habana, 1997), se debe esperar que las formulaciones propuestas no presenten problemas de inestabilidad de acuerdo con sus componentes, los cuales fueron evaluados en su interacción individual con el AC por calorimetría diferencial de barrido con resultados satisfactorios.
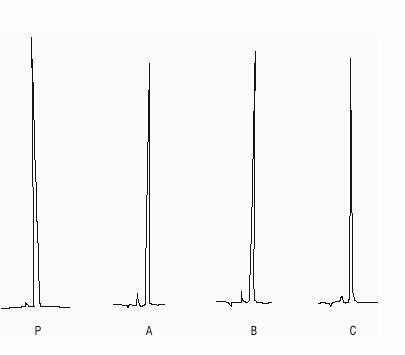
De acuerdo con los resultados, desde el punto de vista tecnológico, solo hay que señalar un aumento de la dureza que puede deberse a la consolidación de la estructura de los comprimidos, mediante ligeras absorciones de humedad ambiental e incre-mento de las fuerzas enlazantes entre gránulos y partículas de la masa sólida que los conforman. Es válido destacar que las tabletas mantuvieron muy buenas propiedades de resistencia mecánica, demostrado por los altos valores de HFR y que aunque aumentaron ligeramente el tiempo de desintegración, este se encuentra aún muy por debajo de los límites establecidos y a su vez no afectó los resultados en el ensayo de disolución del medicamento. El mantenimiento de la integridad del medicamento, desde el punto de vista químico, se evidenció al no tener mancha adicional a la del AC en la CCD (tabla 3). Esto puede corroborarse en los cromatogramas obtenidos en el análisis por CLAR (fig.), donde se obtiene una señal única, correspondiente al AC en todas las formulaciones ensayadas.
Este estudio ha permitido la obtención de 3 variantes diferentes a escala de laboratorio que cumplen con las exigencias internacionales de este medicamento, lo que posibilita el paso a una escala superior de elaboración, con las adecuaciones perti-nentes. Posteriormente se deben evaluar los parámetros anteriores para los lotes elaborados con esta escala, lo que posibilitará la obtención del registro de este medicamento, lo cual garantizará la comercialización de dicho producto.
FIG. Cromatogramas de las formulaciones a los 3 a de estudio. P: estándar de referencia (tiempo de retención tr = 5:923); A: formulación A, tr = 5:268; B: formulación B, t r= 5: 253; C: formulación C, tr = 5:242.
Summary
Three different formulations of cortisone acetate tablets (25 mg) were produced at laboratory scale aimed at obtaining a formulation that fulfills the parameters established by the British Pharmacopoeia (2000), specifically the dissolution parameter that is not fulfilled by the current formulation. In the 3 studied formulations the agglutinant solution of the present formulation (gelatin-starch) was substituted by polyvynilpyrrolidone in alcoholic solution and extragranular disintegrator (acdisol) was added, among other variations. The tablets were analyzed taking into account the technological and analytical characteristics according to the quality specifications of the official pharmacopoeias. The content uniformity trial was also carried out by using a spectrophotometric method previously validated. The physical and chemical stability of the 3 assayed formulations was studied during 3 years. All the formulations met the quality parameters established when they were newly manufactured and during the studied period of useful life, which supports the feasibility for their production at a pilot scale.
Subject headings: CHEMISTRY, PHARMACEUTICAL; QUALITY CONTROL; DRUG STABILITY; CORTISONE/administration & dosage; CORTISONE/ /analysis; ADRENAL CORTEX HORMONES/analysis; TABLETS/analysis; TECHNOLOGY, PHARMACEUTICAL.
Referencias bibliográficas
- Goodman GA, Goodman LS. The pharmacological basis of therapeutic. 7 ed. Editorial Médica Panamericana, 1988:255-67.
- USP. DI. Advice for the patient, drug information in lay language. The United States Pharmacopoeia Convention. 15 ed. Rockville: Mack Printing, 1995;vol 2:1231.
- Shah VP, Konecny JJ, Everett RL. In vitro dissolution profile of water-insoluble drug dosage forms in the presence of surfactants. Pharm Res 1989;16(7):612-8.
- Brittish Pharmacopoeia 2000 v 4.0. Crown Copyright 2000; vol. II. Versión digital.
- United States Pharmacopoeia Convention. USP XXIV. United States Pharmacopoeial. 24 ed. NF 19. Rockville: Mak rinting, 2000: 474.
- Iraizoz A, Bilbao O, Barrios MA. Conferencias de Tecnología Farmacéutica II. La Habana: Editorial EMPES, 1990:211-42.
- Lachman L, Lieberman H. Pharmaceutical dosage forms: tablets. 2 ed. Philadelphia: Lea and Febiger, 1989:5-10, 56-7.
- Remington´s Pharmaceutical Sciences. 18 ed. New York: Mack Publishing, 1990:1435-50.
- Hanson WA. Handbook of dissolution testing. Springfield: Pharmaceutical Technology, 1982:477.
- Allen LV, Yanchick VA, Maees DD. Dissolution rates of corticosteroids utilizing sugar glass dispersions. J Pharm Sci 1977;66(4):494-7.
- Kornblum SS, Hirschorn JO. Dissolution of poorly water soluble drugs I: some physical parameters related to method of micronization and tablet manufacture of a Quinazolinone compound. J Pharm Sci 1970;59(5):606-9.
- Sbarbati de Nudelman NE. Estabilidad de medicamentos. Buenos Aires: Editorial Ateneo, 1975.
- Connors KA, Amidon GL, Kemon L. Chemical stability of pharmaceutical. Toronto: John Wiley, 1979:28-33.
- The Pharmaceutical Codex. Principles and practice of pharmaceutics. 20 ed. London: The Pharmaceutical Press, 1990:520.
- Connors KA, Amidon GL, Stela VJ. Chemical stability of pharmaceuticals. 20 ed. Toronto: The Pharmaceutical Press, 1986:728-32.
Recibido: 13 de noviembre del 2001. Aprobado: 26 de diciembre de 2001.
M.Sc. Lisette González Chávez. Instituto de Farmacia y Alimentos. Universidad de La Habana. Ave. 23 No. 21425 entre 214 y 222, La Coronela, municipio La Lisa, Cuba.
1 Master en Ciencias Farmacéuticas. Especialista en Tecnología y Control de los Medicamentos. Instructor. Instituto de Farmacia y Alimentos (IFAL).
2 Licenciada en Ciencias Farmacéuticas. IFAL.
3 Doctora en Ciencias. Profesora Consultante. IFAL.
4 Técnico Medio. Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
5 Licenciada en Ciencias Farmacéuticas. Empresa de Laboratorios Reinaldo Gutiérrez. 6 Doctor en Ciencias. Profesor Titular. IFAL.