Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.36 n.1 Ciudad de la Habana ene.-abr. 2002
Centro de Investigación y Desarrollo de Medicamentos
Comparación de los parámetros tecnológicos de una suspensión farmacéutica con variación en las técnicas de preparación
Odalys Fernández Valdés,1 Ileana Rodríguez Orjales1 y Yamilka Roberto Cordovés2
Resumen
Se realizó la evaluación de los parámetros tecnológicos de 2 suspensiones farmacéuticas, iguales en composición y con una variación de la técnica de preparación. Los parámetros evaluados fueron: tamaño de partículas presentes en la dispersión, tipo de asociación entre las partículas, propiedades organolépticas, pH, redispersabilidad, índice de sedimentación, viscosidad aparente y comportamiento reológico. Se compararon estadísticamente los resultados obtenidos y se demostró que el paso a través del molino coloidal debía ser la variante tecnológica a elegir, pues posibilitó un mejor cumplimiento de las características generales establecidas para este tipo de forma farmacéutica.
DeCS: QUIMICA FARMACEUTICA; CONTROL DE CALIDAD; SUSPENSIONES/análisis; SUSPENSIONES/administración & dosificación; ESTABILIDAD DE MEDICAMENTOS; REOLOGIA; COMPOSICION DE MEDICAMENTOS/métodos; TECNOLOGIA FARMACEUTICA.
Las suspensiones farmacéuticas son sistemas heterogéneos y termodinámicamente inestables en los que las partículas suspendidas tienden a sedimentar, dando lugar a una forma en la que no existe uniformidad de dosis. En los sistemas dispersos en general y en particular en las suspensiones, la estabilidad se refiere a una situación en la cual las propiedades críticas no cambian moderadamente durante un tiempo determinado. Los parámetros que describen la estabilidad física de las suspensiones se relacionan estrechamente. El tamaño de partícula de la fase dispersa es uno de los más importantes, ya que influye directamente en la velocidad de sedimentación, además de influir en la viscosidad y la capacidad de floculación del sistema, que a su vez se relacionan con el comportamiento de flujo, la sedimentación y la redispersabilidad.1-7
De acuerdo con lo anterior, nos trazamos como objetivo evaluar los parámetros tecnológicos de 2 suspensiones farmacéuticas, iguales en composición y con una variación en la técnica de preparación consistente en el paso de una de ellas a través del molino coloidal; comparar los resultados correspondientes a dichas suspensiones y, finalmente, seleccionar la variante tecnológica que posibilitara el mejor cumplimiento de las características generales establecidas para una suspensión farmacéutica.
Métodos
Se elaboraron y almacenaron a temperatura ambiente 2 suspensiones, A y B, de igual composición y con una variación en la técnica de preparación consistente en el paso de B a través de un molino coloidal PROBST AND CLASS, abertura 1. A los ensayos recién elaborados y transcurridos 30 d se les evaluaron, por triplicado, el tamaño de partícula presente en la dis-persión y el tipo de asociación de las partículas del sistema, mediante la observación de 300 partículas con la utilización de un microscopio óptico de luz polarizada OLYMPUS, modelo BH-2, con ocular 10x y objetivo 100; las propiedades organo-lépticas; el pH, empleando un pHmetro METROHM modelo 691; la redispersabilidad y el índice de sedimentación, medido por 7 d tanto a las suspensiones como a una dispersión del principio activo en agua desionizada. Se midió la viscosidad aparente de las suspensiones recién elaboradas, mediante la utilización de un rotoviscosímetro BROOKFIELD, modelo RVF, husillo No. 2, a 20 r.p.m. y 28 ± 1 °C y se estudió el comportamiento reológico al inicio y luego de 30 d, con el empleo de un rotoviscosímetro HAAKE, modelo RV 20, sensor NVst, velocidad 0-300 s-3, tiempo 2 min y temperatura 20 ± 0,1 °C.
Los resultados de la medición del tamaño de partícula fueron evaluados mediante un ANOVA, clasificación simple, efecto fijo, previa la comprobación de la homogeneidad de varianzas (prueba de Levene). Luego se realizó la prueba de Duncan para comparar las medias obtenidas. Los valores medios de la viscosidad aparente fueron comparados según la prueba t de Student para muestras independientes.8
Resultados
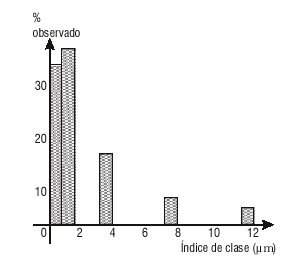
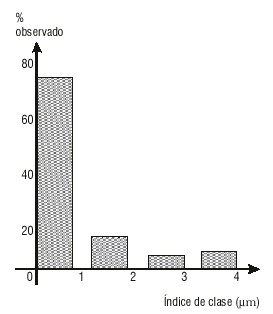
Las figuras 1 y 2 muestran la distribución del tamaño de las partículas en el sólido dispersado en las suspensiones A y B después de 7 d de su elaboración (tiempo inicial). Se aprecia una distribución más homogénea en la suspensión B, en la que alrededor del 75 % de las partículas tienen igual tamaño, mientras en la suspensión A se alcanza solo el 37 % apro-ximadamente. Los diámetros medios obtenidos y los resultados del análisis estadístico son:
- Suspensión A: 2,48 ± 0,11 mm (inicio) y 2,45 ± 0,08 mm (30 d).
FIG. 1. Tamaño de partícula, suspensión A, inicio.
FIG. 2. Tamaño de partícula, suspensión B, inicio.
- Suspensión B: 0,92 ± 0,09 mm (inicio) y 0,91 ± 0,07: mm (30 d).
- Homogeneidad de varianzas: Se comprueba que son homogéneas.
- Análisis de varianza: Se obtienen diferencias entre las medias con nivel de significación del 5 %.
- Prueba de Duncan: No se aprecian diferencias significativas, con 95 % de confiabilidad, entre las medias de la suspensión A en los 2 tiempos. Lo mismo ocurre para la suspensión B. Entre ambas formulaciones sí se observan diferencias significativas al inicio y a los 30 d.
En cuanto al tipo de asociación, en ambas suspensiones se observaron agregados entre las partículas, sin que se fusionaran, sino agrupándose ligeramente.
Ambas suspensiones mostraron color blanco, un sobrenadante translúcido por el empleo de un aceite esencial como saborizante, y una ligera formación de espuma causada por un polímero hidrocoloide que además le imparte viscosidad al medio. Las formulaciones mantuvieron un pH estable de 6,0 ± 1,0 y se redispersaron fácilmente.
Los resultados del índice de sedimentación para A y B fueron similares, 0,71 y 0,73 respectivamente a los 7 d. La dispersión del principio activo en agua desionizada mostró una rápida sedimentación, con un índice de 0,45.
Los valores medios de la viscosidad aparente para los ensayos A y B fueron de 590 mPa´s y 630 mPa´s respectivamente, con desviación estándar igual a 10 en ambos casos. El valor de B resultó ser significativamente superior al de A, con un nivel de significación del 5 %.
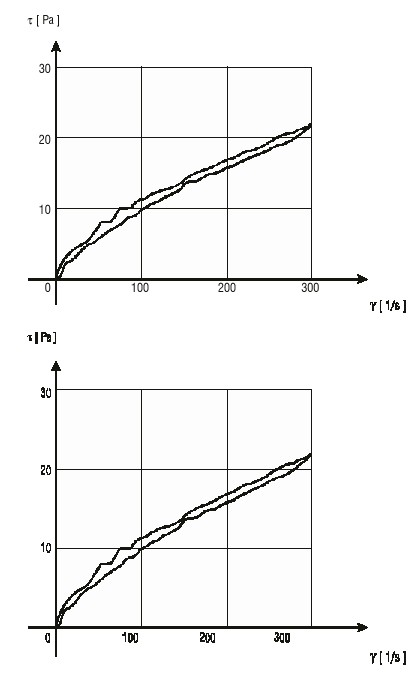
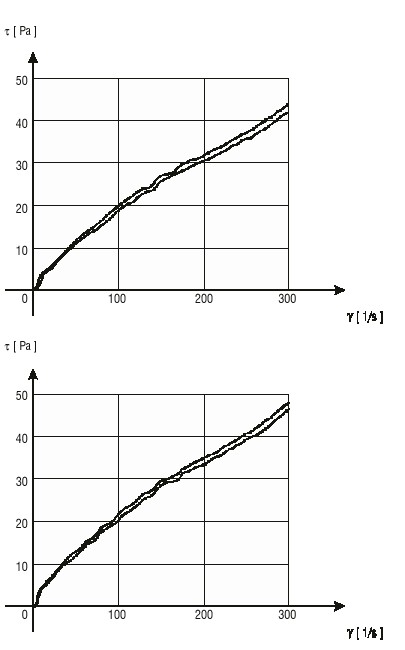
En las figuras 3 y 4 se presentan las curvas de fluidez para A y B. Ambas formulaciones mostraron un comportamiento de flujo no newtoniano de tipo seudoplástico que se mantuvo durante el tiempo estudiado. Se observó un incremento de los valores de tensión de cizalla de la suspensión B con respecto a la A, a iguales valores de velocidad de cizalla.
FIG. 3. Curvas de fluidez para suspensión A al inicio (figura superior) y 30 d (figura inferior).
FIG. 4. Curvas de fluidez para la suspensión B al inicio (figura superior) y 30 d (figura inferior).
Discusión
El tamaño de las partículas en el sólido dispersado en las 2 suspenciones evaluadas no cambió significativamente durante el tiempo de estudio, lo que es una medida de su estabilidad física. Los resultados obtenidos para la suspensión B con respecto a la A demuestran las ventajas del uso del molino coloidal, que asegura la disminución y distribución más homogénea del tamaño de partícula.
La formación de agregados de partículas sin fusión entre estas, indica cierto grado de floculación. Esto facilita la redispersión del sólido, pues evita la formación de torta dura en el tiempo.
El intervalo de pH en que se mantuvieron ambas formulaciones, favorece la absorción por el organismo del principio activo presente en estas suspensiones.9
La fácil redispersión del sólido es importante en el logro de una correcta dosis de administración.
Los valores del índice de sedimentación para A y B resultan adecuados al compararlos con la dispersión del principio activo en agua desionizada. En una suspensión farmacéutica, a menor tamaño de partícula, menor velocidad de sedimentación y el índice de sedimentación se acerca más a 1. Por esto, el valor obtenido debía ser mayor en la suspensión B con respecto a la A. Sin embargo, existen otros factores que influyen en este parámetro, como la formación de flóculos, que produce un sedimento voluminoso, con lo cual aumenta el valor del índice de sedimentación. Esto podría explicar la similitud entre los valores obtenidos para ambas suspensiones a los 7 d.
Los valores de viscosidad aparente para las 2 formulaciones se encuentran dentro del intervalo apropiado para la generalidad de las suspensiones farmacéuticas. El valor B, significativamente superior al de A, es un resultado esperado dada la reducción del tamaño de las partículas del ensayo B al atravesar el molino coloidal, que expone una mayor área superficial al contacto con el medio de suspensión y produce mayor resistencia al flujo, ya que las macromoléculas del polímero suspensor forman una estructura de enrejado que mantiene atrapadas a las partículas del principio activo. El incremento en la viscosidad de la preparación evita la aglomeración de las partículas, al disminuir la frecuencia de las colisiones entre estas y ofrecer una fuerza opuesta a la fuerza gravitacional que causa la sedimentación del sólido.
El comportamiento y tipo de flujo observado para las dos suspensiones favorece la redispersabilidad de la preparación, así como su fluidez desde el recipiente en el momento de su administración. El incremento en los valores de tensión de cizalla de B respecto a A, es resultado del paso de la suspensión B a través del molino coloidal, que provoca un aumento de la viscosidad como se discutió en el punto anterior.
Puede concluirse que el paso a través del molino coloidal contribuyó al mejoramiento de los parámetros tecnológicos de la suspensión, de ahí que deba ser la variante tecnológica a elegir en este caso, teniendo en cuenta que la suspensión B presentó:
– Partículas distribuidas de forma más homogéneas y con un diámetro medio menor desde el punto de vista estadístico.
– Una dispersión más uniforme
– Mayor viscosidad.
Agradecimientos
Al ingeniero Pablo Antonio Pérez por su valiosa ayuda en la confección de las figuras.
Summary
The evaluation of the technological parameters of 2 pharmaceutical suspensions which were equally compounded with a variation of the preparation technique was made. The evaluated parameters were: size of particles present in the dispersion, type of association between the particles, organoleptic properties, pH, redispersiveness, sedimentation index, apparent viscosity and rheologic behavior. The results obtained were statitstically compared and it was demonstrated that the passage through the colloidal mill should be selected as the technological variant, since it made possible a better fulfillment of the general characteristics established for this type of pharmaceutical form.
Subject headings: CHEMISTRY, PHARMACEUTICAL; QUALITY CONTROL; SUSPENSIONS/administration & dosage; DRUG STABILITY; RHEOLOGY; DRUG COMPOUNDING/methods; TECHNOLOGY, PHARMACEUTICAL.
Referencias bibliográficas
- Zografi G, Schott H, Swarbrick J. Disperse systems. En: Remington´s Pharmaceutical Science. 18 ed. Easton: Mack Publishing, 1990:257-8, 282-6, 295-8.
- Voigt R. Tratado de Tecnología Farmacéutica. 3 ed. Zaragoza: Editorial Acribia, 1979:111-6.
- Ugarte R. Suspensiones. En: Tecnología de la producción de preparados farmacéuticos líquidos. La Habana: Editorial Ciencia y Técnica, 1971:86-7.
- The United States Pharmacopeial Convention. General Information. Pharmaceutical Dosage Forms. En: USP 24 NF 19. The United States Pharmacopoeia. The National Formulary. Rockville: Board of Trustees, 1999:2116.
- The United States Pharmacopeial Convention. General Information. Stability considerations in dispensing practice. En: USP 24 NF 19. The United States Pharmacopoeia. The National Formulary. Rockville: Board of Trustees, 1999:2128-30.
- Zatz JL. Physical stability of suspensions. Cosmetic Chemistry 1985;36:393.
- Schott H. Rheology. En: Remington´s Pharmaceutical Science. 18 ed. Easton: Mack Publishing, 1990:313-8.
- Programa computarizado STATISTICA, versión 4.5.
- Pak CYC, Poindexter J, Finlayson B. A model system for assesing physicochemical factors affecting calcium absorbability from the intestinal tract. Bone Mineral Res 1989;4(1):119-27.
Recibido: 25 de septiembre del 2001. Aprobado: 20 de noviembre del 2001.
Lic. Odalys Fernández Valdés. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605 entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, Ciudad de La Habana, CP 10600, Cuba.
1 Licenciada en Ciencias Farmacéuticas. Investigadora Aspirante.
2 Licenciada en Química. Investigadora Aspirante