Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm v.37 n.1 Ciudad de la Habana ene.-abr. 2003
Productos Naturales
Centro de Histoterapia Placentaria
Modelo biológico para evaluar la acción fotoprotectora de un extracto de cordón umbilical humano
Ileana Esperanza Hollands Barca,1 Hilario Gómez-Barry2 y Carlos Manuel Miyares Cao3
Resumen
Se demostró por observación macroscópica e histológica que la aplicación tópica de un extracto de cordón umbilical humano en forma de gel, es capaz de proteger la piel de ratones albinos Balb/C de los efectos perjudiciales producidos por la exposición de estos a una fuente artificial de radiaciones ultravioletas. Se compararon además los resultados obtenidos en este sentido con un fotoprotector de la industria norteamericana, e igualmente se discutieron las posibilidades de usar este modelo biológico para evaluar productos con acción fotoprotectora.
DeCS: CORDON UMBILICAL; ADMINISTRACION TOPICA; GELES; PROTECTORES CONTRA RADIACION; RATONES CONSANGUINEOS BALBC.
Diversos investigadores plantean que el factor extrínseco principal causante del envejecimiento prematuro de la piel con sus distintas alteraciones son las radiaciones ultravioletas (UV).1-5 Por otro lado, las radiaciones UV pueden ser clasificadas según su longitud de onda en 3 tipos: la UVA (320-400 nm), la UVB (280-320 nm) y la UVC (200-280 nm), esta última se considera la más perjudicial para la salud humana.6 Sobre la base de este planteamiento y dado que la exposición a la luz solar tal como llega en las condiciones habituales produce envejecimiento prematuro y demás lesiones de la piel, incluyendo el cáncer, así como el peligro inminente en relación con la disminución de la capa de ozono y las posibilidades cada vez mayores de que este tipo de radiaciones alcancen la superficie de la tierra, conjuntamente con el empleo habitual que existe de lámparas UVC con fines germicidas, se proponen en el presente trabajo los objetivos siguientes:
- Lograr un modelo biológico que permita estudiar las alteraciones de la piel provocadas por este tipo de radiación.
- Utilizar este modelo biológico para determinar la acción fotoprotectora o no, de un gel preparado con un extracto de cordón umbilical humano comercialmente conocido como gel fotoprotector epidérmico, perteneciente a la línea de Amnioterapia Cosmética "Dr. Carlos Miyares Cao" del Centro de Histoterapia Placentaria.
- Proponer una técnica para el control sistemático de la calidad biológica del gel fotoprotector epidérmico elaborado en dicho Centro.
Métodos
Animales. se utilizan 75 ratones albinos machos de la cepa Balb/C con un peso comprendido entre los 24-26 g, los que se distribuyeron en grupos experimentales de cinco. Se separaron en jaulas plásticas independientes, con libre acceso al pienso para ratones y agua. Los animales se mantuvieron en condiciones estables de humedad, temperatura e iluminación, según el centro rector para cría de animales de laboratorio de Cuba (CENPALAB).
Setenta y dos horas antes de iniciar cada ensayo, se les depiló el lomo con un depilador preparado en el Centro de Histoterapia Placentaria.
Fuente lumínica: se utilizó una lámpara Sylvania con un potencial útil de emisión en UV de 8,3 W en la que corresponde el 95 % de la intensidad luminosa a la línea de resonancia del mercurio en 253,7 nm (radiaciones UVC).
La radiación UV (UVC) recibida por los ratones fue de 1,3 mW/cm2 para una dosis única de 23,4 J/cm2.
Diseño experimental: para todos los experimentos se utilizó un número de 5 animales por grupo, los que se dispusieron en jaulas plásticas altas con el libre movimiento todo el tiempo que permanecieron expuestos a la RUV, el cual fue de 30 min, manteniendo 30 cm de distancia entre la lámpara y los animales.
Para cada ensayo se utilizaron 25 ratones y el mismo se repitió en igualdad de condiciones en 3 ocasiones distintas, para un total de 75 animales estudiados.
La distribución de los animales por tratamiento en cada uno de los 3 ensayos realizados fue la siguiente:
Grupo I: animales control solamente depilados.
Grupo II: animales sometidos a la dosis de UVC antes mencionada sin aplicárseles producto alguno.
Grupo III: animales sometidos a la dosis de UVC aplicándoseles tópicamente en lomo y orejas el vehículo del gel fotoprotector epidérmico (placebo).
Grupo IV: animales sometidos a la dosis de UVC aplicándoles en orejas y lomo el gel fotoprotector epidérmico elaborado por el Centro.
Grupo V: animales sometidos a la dosis de UVC aplicándoseles en orejas y lomo un fotoprotector elaborado por UV Daily Defense Lotion for Hands and Body (Chesebrough Ponds USA Connecticut 06830).
Observaciones. Los animales se observaron minuciosamente en 7 momentos: inmediatamente después de transcurrir el tiempo de exposición a la lámpara UVC 1, 2, 3, 4, 5, y 7 días después de la exposición.
Para la evaluación histológica se tomaron orejas y lomos de los animales a fin de procesar dichos tejidos por las técnicas clásicas de hematoxilina-eosina y Verhoeff.7
Resultados
Los resultados de la evaluación clínica se muestran de forma resumida en la tabla.
TABLA. Evaluación clínica. Piel de ratones Balb/C irradiados con UVC
| Grupos Observaciones (días) | I Control | II UVC | III UVC- placebo | IV UVC + Fotoprotector epidérmico | VUVC + Fotoprotector comercial |
| 0 | Piel normal | Ligero eritema | Ligero eritema | Piel normal | Eritema apenas perceptible |
| 1 | Piel normal | Ligero eritema | Ligero eritema | Piel normal | Eritema apenas perceptible |
| 2 | Piel normal | Ligero eritema | Ligero eritema | Piel normal | Eritema apenas perceptible |
| 3 | Piel normal | Intenso eritema orejas y lomos, lesiones costro descamativas orejas y lomos | Intenso eritema orejas y lomos, lesiones costro descamativas orejas y lomos | Piel normal | Ligero eritema orejas y lomo, ligera descamación orejas y lomo |
| 4 | Piel normal | Intenso eritema orejas y lomos, lesiones costro descamativas orejas y lomos | Intenso eritema orejas y lomos, lesiones costro descamativas orejas y lomos | Piel normal | Ligero eritema orejas y lomo, ligera descamación orejas y lomo |
| 5 | Piel normal | Inicio remisión lesiones | Inicio remisión lesiones | Piel normal | Inicio remisión lesiones |
| 7 | Piel normal | Remisión casi total de las lesiones | Remisión casi total de las lesiones | Piel normal | Remisión casi total de las lesiones |
Como se muestra en la tabla en las observaciones realizadas a los animales inmediatamente después de la exposición a la UVC así como 1 y 2 días después, las diferencias encontradas entre los distintos grupos fueron apenas perceptibles, limitándose a un ligero eritema de las orejas en los grupos II y III y más ligero aún, pero algo evidente en los del grupo V.
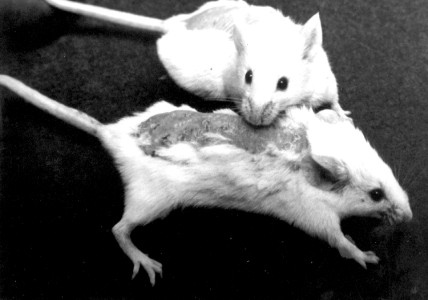
Una situación muy distinta se observó, sin embargo, en el tercer y cuarto día después de ser sometidos los animales a la dosis única de exposición, ya que aparecieron en los grupos II y III intenso eritema de orejas y lomo, así como lesiones costro-descamativas en ambas regiones (fig. 1).
FIG. 1. Resultados clínicos en ratones Balb/C donde se comparan un animal control y uno irradiado sin fotoprotección alguna, en el que se destacan las lesiones costo-descamativas en lomo y orejas.
El grupo IV (gel fotoprotector epidérmico), sin embargo, mantuvo al igual que los controles las características normales de la piel (fig. 2).
FIG. 2. Resultados clínicos en ratones Balb/C, donde se comparan un animal control y otro irradiado con fotoprotector del Centro de Histoterapia Placentaria. Nótese la ausencia de lesiones en el lomo de ambos animales.
Finalmente en relación con el grupo V, se observó un leve eritema de orejas y lomo así como una ligera descamación de lomos en algunos animales, lo cual denota una fotoprotección parcial de estos.
Al quinto día de iniciado el experimento, se observó una remisión parcial de las alteraciones, las cuales fueron desapareciendo de forma gradual hasta resultar prácticamente imperceptibles una semana después.
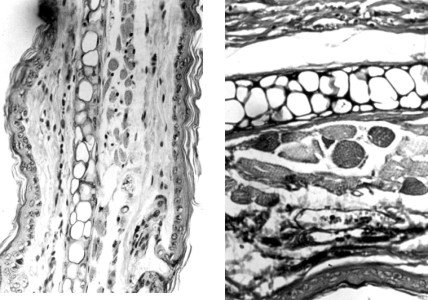
Con respecto a las evaluaciones histológicas en los grupos II y III se detectaron tanto en orejas como en lomos, alteraciones características a las radiaciones UV como, hiperqueratosis con engrosamiento del estrato córneo, acantosis, incremento y desorganización de las bandas de colágeno, incremento de la vascularización, presencia de células inflamatorias e incremento de las fibras elásticas.3,8-11
FIG.3. Cortes histologógicos correspondientes a orejas de animales irradiados sin fotoprotección. A la izquierda hematoxilina-eosina 160 x y a la derecha Verhoeff 400 x, donde se evidencian las alteraciones descritas en el texto.
Sin embargo, tanto en el grupo I (control) como en el IV con el gel fotoprotector epidérmico no se detectaron alteraciones histológicas alguna (fig. 4). Se observaron algunas de las alteraciones antes mencionadas aunque de carácter leve, en dos de los animales del grupo V (hiperqueratosis y alteración del colágeno).
FIG.4. Cortes histológicos correspondientes a orejas de animales irradiados con fotoprotector del Centro de Histoterapia Placentaria. A la izquierda Verhoeff 400 x y a la derecha hematoxilina-eosina 200 x. El tejido en ambas imágenes se presenta completamente normal.
Discusión
Diversos modelos biológicos se han ensayado para analizar los efectos adversos de las RUV sobre la piel: ratones desnudos para estudiar alteraciones provocadas por la UVB y la UVA en dosis agudas o crónicas;12-14 estudios crónicos con UVB en cerdos enanos8 y alteraciones del colágeno provocadas por RUV en ratas Wistar, perros beagles y caballos.15
Sin embargo, fue interés del Centro de Histoterapia Placentaria lograr un método económico a la vez rápido que permitiese valorar el efecto fotoprotector o no de un producto, de ahí que se utilizaran animales de fácil manejo y mantenimiento, como son los ratones Balb/C a diferencia de los otros animales propuestos por los autores antes mencionados. Se demostró tanto macroscópica como microscópicamente, que es posible evaluar la acción fotoprotectora de un producto que contenga filtros solares con este modelo, ya que la disímil respuesta obtenida entre los animales fotoprotegidos o no, es evidente lo mismo desde un punto de vista clínico como histológico.
Finalmente los resultados obtenidos en el grupo V (fotoprotector comercial) de proporcionar una fotoprotección parcial, se explica perfectamente ya que dicho producto contiene como principios activos oxybenzona y ethylhexyl p-methoxinamato, los cuales absorben principalmente en el rango de la UVA el primero y en el de la UVB el segundo,16 siendo posiblemente este último el que colabore en dicha fotoprotección parcial.
Conclusiones
- Es posible utilizar los ratones albinos Balb/C para estudios de fotoprotección.
- El gel fotoprotector epidérmico con extracto de cordón umbilical humano, evita los daños provocados por las radiaciones ultravioletas tipo C sobre la piel.
- Es posible utilizar el modelo propuesto para el control biológico de un fotoprotector.
Summary
It was demonstrated by macroscopic and histological observation that the topical application of an extract from human umbilical cord in the form of gel may protect the skin of Balb/C albine mice from the harmful effect produced by their exposore to an artificial source of ultraviolet radiations. The results were compared with those obtained with a US photoprotector and the possibilities to use this biological model to evaluate products with photoprotective action were discussed.
Subject headings: UMBILICAL CORD; ADMINISTRATION, TOPICAL, GELS; RADIATION-PROTECTIVE AGENTS; MICE, INBRED BALBC.
Referencias bibliográficas
- Young AR. Comulative effects of ultraviolet radiation on the skin cancer and photoaging. Semin Dermatol 1990;9(1):25-31.
- Dalziel KL. Aspects of cutaneous ageing. Clin Exp Dermatol 1991;16(5):315-60.
- Takeuchi T, Vitto J, Bernstein EF. A novel in vivo model for evaluating agents that protect against ultraviolet A induced photoaging. J Invest Dermatol 1998;110(4):343-7.
- Alcaraz MV, Pathak MA; Rius F, Kollias N, González S. An extract of Polypodium leucotomos appears to minimize certain photoaging changes in a hairless albino mouse animal model. A pilot study. Photodermatol Photoimmunol Photomed 1999;15(3-4):120-6.
- Bernstein EF, Kong SK, Brown DB, Kwak BC, Takeuchi T, Gasparro FP, et al. The nitroxide tempol affords protection against ultraviolet radiation in a transgenic murine fibroblast culture model of cutaneous photoaging. Exp Dermatol 2001;10(1):55-61.
- Ohnaka T. Health effects of ultraviolet radiation. Ann Physiol Anthropol 1993;12(1):1-10.
- Humason G. Staining Connective Tissue and Muscle. En: Kennedy D, Park R, eds. Animal Tissue Techniques. San Francisco: WH Freeman; 1972:173-99.
- Fourtanier B, Berrebi C. "Miniature pig as an animal model to study photoaging. Photochem Photobiol 1989;50(6):771-84.
- Moloney SJ, Edmonds SH, Gidden LD, Learn DB. The hairless mouse model of photoaging: evaluation of the relationship between dermal elastin, collagen, skin thickness and wrinkles. Photochem Photobiol 1992;56(5):855.
- Hase T, Shinta K, Murase T, Tokimitsu I, Hattori M, Takimoto R, et al. Histological increase in inflammatory infiltrate in sun-exposed skin of female subjects: the possible involvement of matrix metalloproteinase-1 produced by inflammatory infiltrate on collagen degradation. Br J Dermatol 2000;142(2):267-73.
- Horiki S, Miyauchi-Hashimoto H, Tanaka K, Mikaido P, Horio T. Protective effects of sunscreeming agents on photocarcinogenesis, photoaging, and DNA damage in X PA gene knockout mice. Arch Dermatol Res 2000;292(10):511-8.
- Kiss I, Chen S, Tramposoh KM. The effect of high and low ultraviolet-B dose exposure on the degree of hairless mouse skin wrinkling. Photochem. Photobiol 1991;53(1):109-12.
- Koshiishi I, Mitani H, Sumita T, Imanari T. 1, 25 Dihydroxyvitamin D (3) prevents the conversion of adipose tissue into fibrous tissue in skin exposed to chronic UV irradiation. Toxicol Appl Pharmacol 2001;173(2):99-104.
- Kligman LH. The hairless mouse model for photoaging. Clin Dermatol 1996;14(2):183-95.
- Miksik I, Deyl Z. Change of the harmful of epsilon-mexobyrtysine, UV absorbance and fluorescence of collagen with age in different animal species. J Gerontol 1991;46(3):11-4.
- Nadim A. Encyclopedia of UV absorbers for sunscreen products. Cosmetic Toiletries 1987;102(3):21-36.
Recibido: 11 de octubre de 2002. Aprobado: 22 de noviembre de 2002.
MSc. Ileana Esperanza Hollands Barca. Centro de Histoterapia Placentaria. Calle 18 esquina 43 No. 4302 entre 43 y 47, Miramar, municipio Playa. E-mail:chp@infomed.sld.cu
1 Master en Ciencias. Investigadora Titular.
2 Profesor Titular.
3 Investigador Titular.