Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.38 n.1 Ciudad de la Habana ene.-abr. 2004
Artículos de Revisión
Centro de Investigación y Desarrollo de Medicamentos
Ensayo del lisado de amebocitos del Limulus (LAL)
Resumen
En los últimos años, los principales organismos reguladores de productos farmacéuticos (Farmacopeas) exigen cada vez más en sus monografías la aplicación del método del lisado de amebocitos de Limulus (LAL) para la liberación de pirógenos en productos terminados parenterales. El análisis de pirógenos constituye uno de los principales ensayos en el control de calidad de la fabricación de inyectables por su repercusión en la salud humana, puesto que la presencia y administración de los mismos, es capaz de provocar una serie de respuestas fisiológicas, en su mayoría de carácter perjudicial y en casos extremos, la muerte del paciente. Por las razones anteriores, existe un creciente interés en el conocimiento y dominio de estos métodos. El presente trabajo muestra una revisión bibliográfica del método del LAL, se tratan aspectos como su descubrimiento y estandarización, aparición en la industria farmacéutica y razones para su triunfo, y los basamentos de los principales métodos o variaciones comerciales del LAL (gelificación, turbidimétricos y cromogénicos) que se describen en las Farmacopeas.
Palabras clave: lisado de amebocitos del Limulus:LAL, pirógenos, endotoxinas, lipopolisacáridos: LPS, control de calidad.
Durante la elaboración de productos inyectables hay que tomar todas las medidas concebibles para evitar la contaminación pirogénica, así como disponer de un ensayo confiable de control en el producto terminado. Esencialmente los pirógenos son sustancias que administradas por vía parenteral y en dependencia de la dosis, son capaces de provocar una respuesta febril, shock y muerte. Existe una gran variedad de pirógenos entre los que se encuentran el ácido lipoteicoico, el peptidoglicano, las endotoxinas y ciertos virus, hongos, esteroides y enterotoxinas.1
Por más de 40 años el ensayo de pirógenos mediante la determinación de la respuesta febril en conejos, permaneció prácticamente invariable y su efectividad fue escasamente cuestionada. En la actualidad, para la aprobación y comercialización de gran parte de los productos farmacéuticos y biotecnológicos diseñados para ser administrados por vía parenteral, las principales instituciones reguladoras internacionales exigen el control de pirógenos por el método del lisado de amebocitos de Limulus (LAL). El LAL es un método in vitro que detecta con alta sensibilidad la presencia de endotoxinas bacterianas.
Ante las disposiciones de las Farmacopeas e Instituciones Reguladoras Internacionales, el ensayo del LAL gana cada vez más el interés de la Industria Farmacéutica y Biotecnológica nacional. Teniendo en cuenta además el notable desarrollo que ha alcanzado el método y su importancia para el cumplimiento de las Buenas Prácticas en el proceso de fabricación de inyectables, se presenta la siguiente revisión bibliográfica, que aborda desde la naturaleza y descubrimiento del reactivo LAL y su aparición en la industria farmacéutica, hasta su estandarización y los principales métodos disponibles comercialmente.
El reactivo LAL
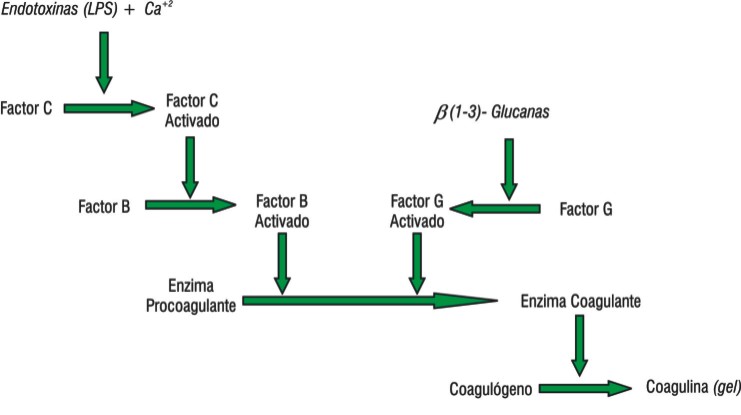
La historia del descubrimiento del reactivo LAL comienza en 1956, cuando el doctor Frederick B. Bang reporta la muerte por coagulación intravascular en el cangrejo herradura americano Limulus polyphemus (fig. 1).2 Bang, junto a Jack Levin, revela en 1964 que las endotoxinas son el vector causante de la coagulación de la hemolinfa del Limulus.3 Cuatro años más tarde, estos investigadores comprueban que los elementos responsables de la coagulación inducida por endotoxinas son de naturaleza enzimática, y se encuentran dentro de los amebocitos, único tipo de células presentes en la hemolinfa azul de los cangrejos herraduras.4 Por lo tanto, el reactivo LAL es un extracto acuoso de los amebocitos, compuesto por una cascada de enzimas serino proteasas tipo tripsina capaz de reaccionar frente a pequeñas cantidades de endotoxinas (fig. 2). La bioquímica de la reacción del LAL se conoce en detalle y el mecanismo en cascada parece ser el responsable de su extraordinaria sensibilidad.5,6
FIG. 1. Limulus polyphemus en la costa del Atlántico durante su época de apareamiento en el verano.
FIG.2. Representación de la reacción en cascada entre el LAL (enzimas proteolíticas tipo tripsina) frente a las endotoxinas y las ß-(1-3) glucanas según el modelo actual.5,6
Además del Limulus el cual habita en algunos puntos de la costa del Atlántico de los Estados Unidos hasta el Golfo de México, existen otras 3 especies de cangrejos herraduras oriundos del continente asiático: el Tachypleus tridentatus, el Carcinoscorpius rotundicauda y el Tachypleus gigas. Estos animales son artrópodos marinos muy conocidos por su récord fósil debido a que evolucionaron muy poco en los últimos 300 millones de años.7,8
Detección de endotoxinas mediante el ensayo del LAL
En tanto que el ensayo de pirógenos en conejos es capaz de detectar cualquier sustancia pirogénica, el ensayo del LAL solo detecta endotoxinas. Las endotoxinas son compuestos químicos complejos que se encuentran exclusivamente en la membrana externa de la pared celular de las bacterias gramnegativas.1,9
Este aspecto a primera vista es, sin lugar a dudas, una desventaja para la implementación del ensayo en la liberación de producto terminado. Sin embargo, los primeros defensores de la aplicación del LAL en la industria farmacéutica plantearon que esta característica no era un inconveniente determinante, debido a que las endotoxinas eran el pirógeno más relevante por las razones que se detallan a continuación. En primer lugar, como las bacterias gramnegativas son tan ubicuas, capaces incluso de colonizar el agua destilada, puede esperarse que ellas y/o sus endotoxinas estén presentes en cierto nivel en la mayoría de los artículos, contaminando comúnmente las materias primas y el equipamiento empleado para la producción de inyectables.10,11 Ellas son el pirógeno que más se ha encontrado entre los lotes contaminados 10,12 y debido a su alta resistencia a la destrucción térmica y química, sobrevive a los métodos ordinarios de esterilización.13 Por último, las endotoxinas se caracterizan sobre todo por su potente actividad biológica, por lo que son capaces de producir profundos cambios fisiológicos cuando son administradas por vía parenteral.1,14 Una dosis de 1-10 ng/kg de endotoxina puede provocar una respuesta febril en el hombre.15
Aparición del LAL en la industria farmacéutica
La primera pregunta sería: ¿por qué sustituir un método que hasta el momento había resultado adecuado por otro? Las primeras respuestas de las ventajas del LAL para la industria farmacéutica aparecen con los trabajos de James F. Cooper y otros a principios de la década de los 70.16-19
Cooper aplica por primera vez el LAL a un parenteral, radiofármacos de corta vida media, los cuales no podían evaluarse por el método en conejos, y reconoce la importancia de la equivalencia entre ambos ensayos.16 Posteriormente demuestra la equivalencia y que el LAL resultó ser al menos 10 veces más sensible. Refiere algunas ventajas del incipiente método como su simplicidad, requiere menos tiempo y volumen de muestra, y es un método de cuantificación.17,18
La alta sensibilidad del LAL es particularmente importante para las drogas intracisternales, pues el método en conejos no es lo suficientemente sensible para la evaluación de pirógenos en estas drogas. Cooper demuestra por primera vez que clínicamente los pirógenos son más tóxicos por vía intracisternal.19 Esta observación se había realizado ya por Bennet y otros,20 quienes establecieron que los efectos tóxicos de la endotoxina administrada por vía intracisternal en perros y conejos son 1 000 veces más potentes para producir fiebre que la vía intravenosa.
Por su efecto farmacológico, ciertos citostáticos, algunos sedativos y anestésicos, corticosteroides, derivados de la fenotiazina y antipiréticos, no son posibles evaluar por el método en conejos, puesto que enmascaran el potencial pirogénico de las muestras.17,19
Los trabajos de Mascoli y Weary describen un monumental número de ensayos de pirógenos en conejos y LAL. Ellos concluyeron que las endotoxinas son el pirógeno principal, que el LAL es mucho más sensible y observaron considerable variabilidad del ensayo en conejos. Sin embargo, nunca observaron un negativo en LAL para un positivo en conejos.21,22
Reconociendo el potencial del ensayo del LAL para la industria farmacéutica, la compañía norteamericana Mallinckrodt, Inc., logró en 1971 la primera producción exitosa de reactivo LAL a gran escala.14
Aunque la Federación para Alimentos y Drogas de los Estados Unidos (Food and Drug Administration, FDA) reconoció tempranamente las múltiples ventajas del ensayo del LAL para la industria farmacéutica, procedió cautelosamente en su oficialización.23 Durante la década de los 70, el Buró de Productos Biológicos de la FDA publicó las primeras regulaciones para el uso del LAL en productos derivados de la sangre y vacunas; simultáneamente, el Buró de Accesorios Médicos lo introdujo en jeringuillas y en otros artículos desechables.24 La FDA realizó numerosos estudios entre los que se cuentan la evaluación de 2 526 productos farmacéuticos a inicios de la decada de los 80.25 Sin embargo, no fue hasta 1983 que oficializó el método mediante el lanzamiento de la primera Guía directiva para la validación del ensayo del LAL en la liberación de producto final de drogas parenterales de uso humano y animal, productos biológicos y accesorios médicos.26
Por otra parte, durante 1975-1980 el Comité de Revisión de la Farmacopea de los Estados Unidos (United State Pharmacopoeia, USP), consideró la sustitución del ensayo de pirógenos en conejo de la USP por el ensayo del LAL. Empleó tiempo y esfuerzos revisando los datos disponibles antes de culminar con la presentación del capítulo Ensayo de endotoxinas bacterianas (Bacterial Endotoxin Test; BET, capítulo 85), que fue publicado en el Forum de la Farmacopea, y luego en la USP XX, oficializada el 1 de julio de 1980.12 La Farmacopea Europea (EP) lo presenta en 1987.
Actualmente, la mayoría de las monografías para inyectables en las principales Farmacopeas exigen el ensayo del LAL para pirógenos en producto terminado. Solo para tener una referencia, la Farmacopea de los Estados Unidos en su edición 24, efectiva en el 2000 pasado, contiene cerca de 650 nuevos productos donde regula el ensayo LAL.27
Métodos del LAL
Existen 3 variaciones básicas del ensayo del LAL en el mercado: método de gelificación o gel-clot, turbidimétricos y cromogénicos. Cada fabricante de juegos de reactivos describe su propia metodología, pero en general la diferencia entre los protocolos es pequeña.24 La correlación entre los métodos se basa en comparar la menor dilución de un producto dado a la cual se elimina la interferencia. En general, existe una correlación moderada entre los métodos cuando el reactivo LAL es producido por el mismo fabricante e incluso mejor si es del mismo lote, mientras que puede ser muy diferente hasta para el mismo método cuando el reactivo se produce por distintos fabricantes.28 Es por esto que uno de los aspectos críticos es la validación del ensayo, con lo cual se garantiza independientemente del método o lote que a una dilución determinada del producto no existan interferencias y por lo tanto, sea confiable la cuantificación de endotoxinas en dicha muestra. Aún subsisten confusiones con respecto a la validación del método, hay que puntualizar que lo que se valida es la muestra o su dilución, no se trata, por ejemplo, de realizar ensayos de linealidad, exactitud o precisión como se describe para la mayoría de los métodos analíticos. La validación del LAL se presenta en detalle en la guía de la FDA.29 Además, para el lector interesado en este aspecto existe literatura donde se suministra información para ejecutar la validación de un producto empleando el método del LAL.27,30-32
Método de gelificación o gel-clot. El método de gel-clot es el ensayo clásico y el más elemental entre los métodos del LAL. La reacción desarrollada en el tubo de ensayo es esencialmente la misma que ocurre in vivo en la hemolinfa del cangrejo herradura frente a las endotoxinas. Es el ensayo menos susceptible a inhibición y requiere de un equipamiento más sencillo y menos costoso.28
La presencia de endotoxinas es determinada por la formación de un gel o coágulo insoluble.10,33 Se puede desarrollar de forma cuantitativa o semicuantitativa (ensayo límite). Produce resultados binarios, positivo (+) o negativo (-). Un tubo es positivo cuando el gel permanece intacto después de que se invierte cuidadosamente un ángulo de 180 º, cualquier otra condición es interpretada como negativa.16,28 El alcance del método está limitado únicamente por la sensibilidad del lisado. El mercado oferta reactivos para gel-clot con sensibilidades de 0,03; 0,06 y 0,12 UE/mL (unidades de endotóxinas por mililitro). Con este método no se podrán cuantificar endotoxinas por debajo del nivel (sensibilidad) al cual se forma un gel sólido.
Métodos turbidimétricos. Estos métodos se fundamentan por el aumento de la turbidez en la mezcla de reacción provocado por el incremento de la concentración de coagulina insoluble, la cual se monitorea espectrofotométricamente. La proporción del aumento de turbidez está relacionada con la concentración de endotoxinas en la muestra. Los métodos turbidimétricos son los más sensibles, capaces de detectar hasta 0,001 UE/mL.28 Existen 2 variaciones del método turbidimétrico:
Turbidimétrico de punto final: Este método fue comercializado por primera vez por Worthington Inc. (está compañía ya no está en el mercado del LAL) y se emplea raramente en la actualidad.24 El principal inconveniente de este ensayo es que requiere un tiempo de incubación y lectura controlado muy cuidadoso, la reacción no se detiene y por lo tanto el desarrollo de turbidez continúa. Las muestras podrán leerse a un tiempo fijo y solo una vez.28
Turbidimétrico cinético: Levin y Bang en 1968 fueron los primeros en proponer un método turbidimétrico cinético para la determinación de endotoxinas con el empleo del reactivo LAL.4 Inicialmente este método era poco empleado debido probablemente a la carencia de equipos capaces de manipular varias muestras al mismo tiempo.34 Se necesitaron varias modificaciones con la finalidad de simplificarlo y elevar su sentido práctico: 1) el empleo de un lector de microplacas de alta resolución dotado de un incubador a 37 ºC, 2) el uso de un software acoplado mediante una interfase a una computadora para la adquisición y procesamiento de los datos y, 3) la disponibilidad de una formulación del lisado o reactivo LAL más sensible.35
El método turbidimétrico cinético posee el más amplio rango de detección entre los métodos conocidos (0,00-100 UE/mL).
Su principal desventaja es que requiere de un equipamiento costoso y de un personal lo suficientemente calificado para el manejo de equipos y el procesamiento de los datos.28
Existen ofertas en el mercado de equipos que automatizan el uso del método, como son el LAL-5000 Serie 2 de Associates of Cape Cod Inc,36 el Toxinometer ET-201,37 y el QCL-1000® de BioWhittaker Inc.24
Métodos cromogénicos. La primera aplicación del método cromogénico del LAL fue descrita por Nakamura y otros en 1977. A partir de aquí han aparecido muchas versiones, por lo que el método cromogénico posee las diferencias más notables en cuanto a los procedimientos descritos entre los distintos fabricantes.24 La compañía japonesa Seikagaku Kogyo Corp. fue la primera en vender el método cromogénico del LAL a inicios de la década de los 80.39
Estos métodos se fundamentan en el empleo de un sustrato cromogénico sintético incoloro. El sustrato está compuesto por un pequeño péptido unido por la arginina C-terminal a una molécula del cromóforo p-nitroanilina (pNA). Una vez activada la cascada del LAL, la enzima coaguladora provoca la liberación de la molécula de pNA de color amarillo. El desarrollo de la coloración amarilla es proporcional a la concentración de endotoxinas en la muestra.24
Estos métodos han sido empleados especialmente para la cuantificación de endotoxinas en muestra de plasma, sangre y otros fluidos biológicos.40,41 Al igual que los métodos turbidimétricos, el equipamiento que requiere es costoso pero de uso variado en el laboratorio. El sustrato cromogénico es el componente más caro e inestable del kit. Cuenta con 2 versiones de punto final y una cinética.24
El uso de sustratos cromogénicos, comparando con el método de gelificación, disminuye el tiempo del ensayo, elimina la posible destrucción accidental del gel durante la incubación o la lectura, y permite una mayor capacidad de procesamiento de muestras.42
Método cromogénico cinético: El principio de este método es muy similar al turbidimétrico cinético, solo que en este caso mide el desarrollo de color en el tiempo. El rango de detección para la cuantificación de endotoxinas es de 0,005-50 UE/mL. Es importante distinguir entre el ensayo pseudocinético y el cinético verdadero. El primero es de 2 pasos. Se sigue el desarrollo de color después de la adición del sustrato cromogénico a una reacción terminada entre la endotoxina y el reactivo LAL, mientras que el cinético verdadero es de un solo paso. En general, este método no reporta ventajas significativas sobre el turbidimétrico cinético.39 En el mercado se oferta un método cromogénico que requiere un solo paso de incubación adaptable tanto para el método cinético verdadero como para el de punto final.43
Método cromogénico de punto final: Este ensayo puede desarrollarse en microplacas de 96 pozuelos o en tubos de ensayos; en el último se requiere el doble del volumen de reactivos. En dependencia del fabricante se puede correr en 1ó 2 pasos de incubación. Por ejemplo, el kit QCL-1000 de BioWhittaker emplea 2 etapas, el primero se incuban a 37 ºC la muestra con el reactivo LAL, luego añaden el sustrato cromogénico y vuelven a incubar a 37 ºC; en cambio, el kit Pyrochrome de Associates of Cape Cod, Inc. emplea un solo paso, la muestra se incuba con la mezcla LAL/sustrato que vienen co-liofilizados en el kit.28
En ambos casos, la reacción puede leerse inmediatamente después de concluida la incubación o puede detenerse mediante la adición de una solución ácida. Hay ventajas y desventajas para cada opción. La adición de la solución ácida elimina cualquier turbidez, disminuye ligeramente la densidad óptica (DO) y puede mejorar la reproducibilidad. Cuando se corre el método en tubos de ensayos, la adición de ácido reduce aun más la DO por dilución. No obstante, se debe emplear la solución ácida en el método en tubos debido al tiempo que toma la transferencia de las soluciones a las cubetas para la lectura. En el lector de microplacas no se observa disminución de la DO debido a que el paso de luz aumenta proporcionalmente con la dilución.39
De forma muy casual, este método puede desarrollarse con fines cualitativos, leyendo las muestras visualmente sin la necesidad de un espectrofotómetro (método en tubos) o un lector de microplacas de 96 pocillos (método en microplacas). Este abordaje suele ser provechoso cuando es alto el contenido de endotoxinas en la muestra.42
El otro método cromogénico de punto final, también conocido como opción diazo, es realmente una extensión del resultado del punto final de la pNA. La pNA libre se derivatiza para formar un diazocompuesto coloreado. El derivado de color magenta brillante conocido como "colorante azo", presenta un espectro de absorción diferente con un pico de absorbancia máxima a 540 nm y un alto coeficiente de extinción. Su principal ventaja reside en que es posible evitar interferencias producidas por muestras de color amarillo, por ejemplo, fluidos corporales y algunos medios para el cultivo de células. Esta opción no es aplicable al modo cinético.44
Estandarización del ensayo del LAL
Después del descubrimiento y optimización del reactivo LAL, posiblemente el aspecto más estudiado y controversial ha sido la estandarización del ensayo. Las endotoxinas difieren entre ellas en su actividad biológica o potencia, es decir, la pirogenicidad o reactividad frente al ensayo del LAL de una endotoxina con determinada masa puede diferir significativamente de otra con igual masa.45,46
Reconociendo este problema, la FDA concluyó que era necesaria una preparación de endotoxinas adecuada para la estandarización del ensayo del LAL. Después de acumular suficientes datos y experiencia con el lote de estándar de referencia primario de endotoxina EC-2, la FDA le asignó arbitrariamente una potencia de 5 000 UE/vial o 5 UE/ng. Por lo tanto, 1 UE equivale a 0,2 ng de EC-2. Esta es una expresión de la actividad de las endotoxinas en el ensayo del LAL.18 La potencia de los lotes de estándar de referencia ulteriores se ha referido a la del lote EC-2. En un estudio en voluntarios sanos se estableció que la dosis pirogénica media capaz de provocar una respuesta febril en humanos era de 5 UE/kg/h.15 Como el método del LAL es cuantitativo, se empleó este valor para la determinación del límite de endotoxinas en cada inyectable o nueva formulación. El límite de endotoxinas de un producto está relacionado con su dosis máxima. En el caso de los productos genéricos aparecen en sus respectivas monografías en las Farmacopeas. La guía directiva de la FDA del 1987 describe el procedimiento para el cálculo del límite de endotoxinas de un producto que no esté reportado o que se emplee en una dosis diferente.29
Afortunadamente se ha logrado la armonización de los distintos estándares de endotoxinas entre la Farmacopeas de los Estados Unidos (USP), la EP, la OMS y la FDA.46 Este estándar se preparó en el Reino Unido por Stanley Poole y contiene 0,1 ng de endotoxinas por vial (10 000 UE),47 está disponible comercialmente a través de estas instituciones como lote G, Tercera Preparación de Referencia Biológica BRP-3, Segundo Estándar Internacional de Endotoxinas y lote EC-6 respectivamente. Independientemente de la diferencia entre los nombres, el contenido de los viales es idéntico. Los europeos y la OMS continúan reportando las unidades de endotoxinas en unidades internacionales, pero gracias a la armonización, 1 UI = 1 UE.46
Summary
During the last years, the main regulating bodies of pharmaceuticals (Pharmacopoeias) have increasingly demanded in their monographies the application of the LAL assay for the release of pyrogens in parenteral finished products. The analysis of pyrogens is one of the fundamental assays in the quality control of the manufacture of injections due to its impact on human health, since their presence and administration may cause a series of physiological responses, which are mostly harmful and, in extreme cases, may produce death. For the above mentioned reasons, there is a rising interest in the throrough knowledge of these methods. The present paper includes a bibliographic review of the LAL method. Aspects such as its discovery and standardization, appearance in the pharmaceutical industry and reasons for its triumph, as well as the foundations of the main methods or commercial variations of LAL (gelification, turbidimetry and chromogenics), which are described in the Pharmacopoeias , are dealt with.
Key words: Lymulus Amebocyte Lysate: LAL, pyrogens, endotoxins, lypolisaccharides: LPS, quality control.
Referencias Bibliográficas
- Pearson FC. Microbial Pyrogen. En: Pearson FC, eds. Endotoxins, LAL Testing, and Depyrogenation. New York: Marcel Dekker; 1985:23-73.
- Bang FB. A bacterial disease of Limulus polyphemus. Bull Johns Hopkins Hosp 1956; 98:325.
- Levin J, Bang FB. The role of endotoxin in the extracellular coagulation of Limulus blood. Bull Johns Hopkins Hosp 1964;115:265-70.
- Levin J, Bang FB. Clottable protein in Limulus: its localization and kinetics of its coagulation by endotoxin. Thromb Diath Haemorrh 1968;19:186-90.
- Iwanaga S. The Limulus clotting reaction. Curr Opin Immunol 1993;5:74-82.
- Iwanaga S. Primitive coagulation systems and their message to modern biology. Thrombosis Haemostasis 1993;70(1):48-55.
- Levin J. The Limulus Amebocyte Lysate Test: Perspectives and Problems. En: Watson SW, Levin J, Novitzky TJ, eds. Detection of Bacterial Endotoxin with the Limulus Amebocyte Lysate Test. New York: Alan R. Liss; 1987. p.1-23.
- Shuster CN. The American horseshoe crab, Limulus polyphemus. En: Prior RB, eds. Clinical applications of the Limulus amoebocyte Lysate test. Boston: CRC Press; 1990:15-25.
- Weary MA, Pearson FC. Manufacture's guide to depyrogenation. Biopharm 1988; April: 24-9.
- Gould MJ. Limulus Amebocyte Lysate assays and filters applications. En: Meltzer TH, Jornitz MW, eds. Filtration in the Biopharmaceutical Industry. New York: Marcel Dekker; 1998: 605-18.
- Weary ME. Understanding and setting endotoxin limits. J Parent Sci Technol 1990;44(1):16-8.
- __________. Pyrogen Testing of Parenteral Products-Status Report. J Parent Sci Technol 1984;38(1):24-9.
- ___________. Depyrogenation. En Pearson FC, eds. Pyrogens: Endotoxins, LAL testing and Depyrogenation. New York: Marcel Dekker; 1985. p.203-18.
- Suffredini AF, O´Grady NP. Pathophysiological responses to endotoxins in humans. En: Brade H, Opal SM, Vogel SN, Morrison DC, eds. Endotoxin in health and disease. New York: Marcel Dekker; 2000. p.817-30.
- Hochstein HD, Fizgerald EA, McMahon FG, Vargas R. Properties of US Standard (EC-5) in human male volunteers. J Endotox Res 1994;1:52-6.
- Cooper JF, Levin J, Wagner HN. New, rapid, in vitro test for pyrogen in short-lived radiopharmaceuticals. J Nucl Med 1970;11:310-3.
- Cooper JF, Levin J, Wagner H. Quantitative comparison of in vitro (Limulus) and in vivo (Rabbit) methods for the detection of endotoxin. J Lab Clin Med 1971;78:138-45.
- Cooper JF, Hochstein HD, Seligmann EB Jr. The Limulus test for endotoxin (Pyrogen) in radiopharmaceuticals and biologicals. Bull Parenter Drug Assoc 1972;26(4):153-62.
- Cooper JF. Principles and Applications of the Limulus test for pyrogen in parenteral drugs. Bull Parenteral Drug Assoc 1975;29(3):122-30.
- Bennet IL, Petersdorf RF, Keene WR. Pathogenesis of fever: evidence for direct cerebral action of bacterial endotoxin. Trans Assoc Am Phy 1957;70:64-9.
- Mascoli CC, Weary ME. Applications and advantages of the Limulus amebocyte lysate (LAL) pyrogen test for parenteral injectable products. Prog Clin Biol Res 1979;29:387-402.
- ____________. Limulus amebocyte lysate (LAL) test for detecting pyrogens in parenteral injectable products and medical devices: advantages to manufacturers and regulatory officials. J Parenter Drug Assoc 1979;33(2):81-95.
- Hochstein HD, Elfin RJ, Cooper JF, Seligman EB Jr, Wolff SM. Further Developments of Limulus Amebocyte Lysate Test. Bull Parenteral Drug Assoc 1973;27(3):139-48.
- Novitsky TJ. Discovery to Commercialization: The blood of the Horseshoe crabs. Oceanus 1991;27(1):13-8.
- Twohy CW, Duran AP, Munson TE. Endotoxin contamination of parenteral drugs and radiopharmaceuticals as determined by the Limulus Amebocyte Lysate Method. J Parenteral Sci Technol 1984;38(5):190-200.
- Guideline on Validation of the Limulus Amebocyte Lysate Test as an End-Product Endotoxin Test for Human and Animal Parenteral Drugs, Biological Products and Medical Devices. U.S. Department of Health and Humasn Services, Public Health Service, Food and Drugs Administration. January, 1983.
- Cooper JF. Validation of Bacterial Endotoxins test methods. LAL Times 1999;6(2):1-7.
- Dawson ME. A Wealth of options. Choosing a LAL test methods. LAL Update 1995;13(3):1-5.
- Guideline on Validation of the Limulus Amebocyte Lysate Test as an End-Product Endotoxin Test for Human and Animal Parenteral Drugs, Biological Products and Medical Devices. U.S. Department of Health and Humans Services, Public Health Service, Food and Drugs Administration. December, 1987.
- Dawson ME. Preliminary Testing. LAL Update 1996;14(1):1-5.
- ________. Inhibition or enhancement testing: Part 1. LAL Update 1996;14(4):2-3.
- ________. Inhibition or enhancement testing: Part 2. LAL Update 1997;15(1):1-4.
- Gould MJ. Performing the LAL gel-clot test in facilities. Nephrology News & Issues 1988; November: 26-9.
- Novitsky TJ, Remillard JF, Loy N. Design criteria and evaluation of the LAL-4000 for kinetic turbidimetric LAL assay. En: Watson SW, Levin J and Novitsky TJ, eds. Detection of Bacterial Endotoxin with the Limulus Amebocyte Lysate Test. New York: Alan R. Liss; 1987: 189-196.
- Remillard JF, Gould MC, Roslansky PF, Novitsky TJ. Quantitation of endotoxin in products using the LAL kinetic turbidimetric assay. Prog Clin Biol Res 1987;231:197-210.
- Chitty NB. LAL-5000 Series 2 Automatic endotoxin detection system. LAL Update 1991;9(1):1-4.
- Cooper JF. Choise of regression analisys for kinetic LAL methods. LAL Times 1997;4(1):1-4.
- Nakamura S, Morita T, Iwanaga S, Niwa M, Takahashi K. A sensitive substrate for the clotting enzyme in horseshoe crab hemocytes. J Biochem 1977;81:1567-9.
- Novitsky TJ. Pyrochrome, A new single-step chromogenic Limulus amebocyte lysate assay. LAL Update 1993;11(3):1-4.
- Nachum R. Detection of Gram negative bacterial meningitis. En: Prior RB, eds. Clinical Applications of the Limulus Test. Boston: CRC Press; 1990:268-78.
- Ketcchum PA, Parsonnet J, Stotts LS, Nocvitsky TJ, Scchlain B, Bates DW. Utilization of a Chromogenic Limulus amebocyte Lysate blood assay in a multicenter study of sepsis. J Endotox Res 1997;4(1):9-16.
- Prior RB. The Limulus Amebocyte Lysate Test. En: Prior RB, eds. Clinical Applications of the Limulus Test. Boston: CRC Press; 1990:28-34.
- Lindsay GK, Rolansky PF, Novitsky TJ. Single-Step, Chromogenic Limulus Amebocyte Lysate Assay for Endotoxin. J Clin Microbiol 1989;27: 947-51.
- Novitsky TJ. Diazo-Coupling Option with Pyrochrome Chromogenic LAL. LAL Update 1998;16(2):1-5.
- Dawson MD. Endotoxin standards and CSE potency. LAL Update 1993;11(4):2-5.
- ___________. Harmonization of endotoxin standards and Units. LAL Update 1997;15(4):2-3.
- Poole S, Dawson P, Gaines RE. Second international Standard for endotoxin: calibration in an international collaborative study. J Endotox Res 1997;4(3):221-31.
Recibido: 27 de octubre de 2003. Aprobado: 28 de noviembre de 2003.
Lic. Rolando Perdomo Morales. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605, entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba. E-mail: rolando.perdomo@infomed.sld.cu