Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm v.38 n.2 Ciudad de la Habana Mayo-ago. 2004
Centro de Investigación y Desarrollo de Medicamentos
Actividad antiulcerosa y toxicidad aguda oral de celulosa microcristalina suspensión al 12 %
Pedro Gilberto Barzaga Fernández,1 Raiza Vega Montalvo,2 Juana Tillán Capó,3 Nilia de la Paz Martín Viaña,4 Carmen Carrillo Domínguez5 e Isbel Guerra Sardiñas6
Resumen
La celulosa microcristalina ha sido usada recientemente en el tratamiento de la gastritis alcalina por reflujo biliar duodenogástrico. Se realizó un estudio toxicológico y se evaluó el efecto antiulceroso de celulosa microcristalina suspensión al 12 % en ratas. La determinación de la toxicidad aguda oral se realizó mediante el ensayo de dosis límite, mediante la administración de una dosis de 2 000 mg/kg a animales de uno y otro sexos. El efecto protector sobre la mucosa gástrica se evaluó sobre lesiones inducidas por taurocolato de sodio y se ensayaron las dosis de 240, 360 y 540 mg/kg de la suspensión. Como resultado en el estudio toxicológico, no se produjo mortalidad para la dosis ensayada, por lo que se clasificó la sustancia como no tóxica. Mientras que las diferentes dosis empleadas para el efecto antiulceroso disminuyeron el número y la intensidad de las lesiones significativamente de manera dosis dependiente. La dosis efectiva media fue de 356,8 mg/kg. Tales hallazgos permiten sugerir que el efecto protector de celulosa microcristalina suspensión al 12 % podría estar dado por una inactivación de los ácidos biliares o por una alteración en la cantidad o composición de la capa de moco que recubre la mucosa gástrica.
Palabras clave: Celulosa microcristalina, ratas, toxicidad, úlceras gástricas, taurocolato de sodio.
La celulosa microcristalina es un derivado del alfacelulosa depolimerizada y purificadada obtenido a partir de plantas fibrosas, entre ellas la caña de azúcar. Es un producto blanco, inodoro, libre de contaminantes orgánicos e inorgánicos, con un contenido no menor al 97 % de celulosa, calculada sobre base seca. Entre sus usos principales figuran la fabricación de cremas y suspensiones sólidas para cosméticos, detergentes y como estabilizador en la elaboración de helados. Tiene gran aplicación en la industria farmacéutica para la preparación de comprimidos, píldoras y cápsulas como agente de compresión.1
En un estudio realizado donde se evaluó la capacidad secuestradora de ácidos biliares de diferentes fibras dietéticas como: la pectina, la fibra de lupina, el almidón de papas y la celulosa, esta última resultó ser la más activa, lo que sugiere que puede actuar como catalizador al promover la esterificación de ácidos biliares hacia una forma inactiva, y así desempeñar una función importante en la prevención del cáncer de colon (Valdés Alonso L, Paniagua Estévez M. Acción de la celulosa microcristalina en la excreción de los ácidos biliares en heces fecales. Tesis de Grado. La Habana. Instituto de Gastroenterología, 1995).
La celulosa microcristalina recientemente también ha sido utilizada en el tratamiento de la gastritis alcalina por reflujo biliar duodenogástrico, basado en la capacidad que posee esta fibra dietética de atrapar ácidos biliares, los cuales tienen la capacidad de producir daño sobre el DNA, mecanismo por el cual se establece la agresión a las células del colon.1
Atendiendo a los hallazgos encontrados con respecto al efecto de esta fibra dietética sobre dicha afección, el Centro de Investigación y Desarrollo de Medicamentos (CIDEM) desarrolló una forma farmacéutica cuyo principio activo es la celulosa microcristalina. El objetivo de este estudio consistió en evaluar la actividad protectora sobre úlceras gástricas inducidas experimentalmente de celulosa microcristalina suspensión al 12 %, así como su toxicidad aguda oral, requisito indispensable para su aplicación en el humano.
Métodos
Las sustancias de ensayo empleados fueron las siguiente:
Celulosa microcristalina suspensiónal 12 %.
Ensayo: 52
Placebo de celulosa microcristalina suspensión al 12 %
Ensayo:53
Ambas formulaciones procedentes del Departamento de Formas Terminadas del CIDEM.
Se utilizaron ratas Wistar de uno y otro sexos con peso corporal de 150-200 g, procedentes de la colonia del Departamento de Investigaciones Biológicas del CIDEM. Los animales se mantuvieron en un cuarto a temperatura controlada de 20 ± 2 °C y humedad de un 50-60 %,con ciclos de luz/oscuridad de 12-12 horas. La alimentación consistió en dieta para ratas, elaborada por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) y agua a voluntad.
Ensayo de toxicidad aguda oral
La determinación de la toxicidad aguda oral se realizó mediante el ensayo de dosis límite establecido en la Norma 401 de la OECD.2 Se confeccionaron 2 grupos de 5 animales cada uno de uno y otro sexos, los que fueron identificados individualmente para la dosificación exacta de acuerdo con su peso corporal, mediante un sistema de marcaje con ácido pícrico.
La celulosa microcristalina suspensión al 12 % se administró a una dosis de 2000 mg/kg por vía oral, con un factor de volumen de 1,66 mL/kg mediante cánula intragástrica, directa del frasco, para lo cual la comida se le retiró a los animales 18 h antes de la administración.
Los animales se observaron constantemente durante las primeras 24 h, lo cual continuó diariamente durante un período de 14 días, registrando cualquier síntoma tóxico. Al finalizar este período, se procedió al sacrificio por asfixia de los animales bajo atmósfera de éter para realizarles la autopsia, y se efectuó un examen macroscópico de órganos como: hígado, corazón, bazo, pulmón, riñones y órganos sexuales.
El peso corporal se controló al inicio, a los 7 días y al final del experimento.
Estudio farmacológico
Ensayo preliminar. Este estudio se realizó con el objetivo de determinar la actividad antiulcerosa de la celulosa microcristalina suspensión al 12 %. La inducción de las úlceras gástricas se efetuó según la metodología seguida por Konturek y otros, 1988,3 modelo experimental que simula el daño que se produce en la gastritis alcalina.
Se confeccionaron 3 grupos de tratamiento de 8 animales cada uno: el primer grupo recibió celulosa microcristalina suspensión al 12 % a una dosis de 360 mg/kg, otro grupo fue administrado con el placebo y un tercer grupo con agua destilada, estos 2 últimos a una dosis de 3 mL/kg.
La administración de cada una de las sustancias de ensayo se realizó por vía oral, mediante cánula intragástrica durante un período de 5 días. En las 24 h previas a la última administración los animales se mantuvieron en ayuna, para lo cual se colocaron en jaulas anticoprofágicas con libre acceso al agua. Una hora después de la administración final, todos los animales recibieron por vía intragástrica 1 mL de una solución de taurocolato de sodio 100 mM disuelto en ácido clorhídrico 0,2 N.
Transcurrida 1 h se sacrificaron los animales bajo atmósfera de éter y se extrajeron los estómagos para el análisis macroscópico de las lesiones, atendiendo al número y severidad de estas como indicadores de daño de la mucosa gástrica.
Determinación de la dosis efectiva media (DE50)
Para la determinación de la DE50 se siguió el diseño experimental realizado en el ensayo preliminar, aunque en este caso el esquema de tratamiento incluyó 7 grupos. Tres grupos fueron administrados con celulosa microcristalina suspensión al 12 % a dosis de 240, 360, 540 mg/kg respectivamente, otros tres se administraron con el placebo a dosis de 2,0; 3,0; 4,5 mL/kg (estos 3 niveles de dosis fueron administrados con el objetivo de determinar si el efecto protector del placebo, encontrado en el ensayo preliminar, mostraba un comportamiento dosis dependiente). Al grupo restante se le administró agua destilada (4,5 mL/kg).
La DE50 fue estimada tomando como único criterio el número de lesiones encontradas, no así la severidad de estas.
Procesamiento estadístico
Los resultados obtenidos se expresaron como la media ± desviación estándar, los cuales fueron procesados estadísticamente por un análisis de varianza de una vía y una prueba de Duncan para la comparación de las medias.
La DE50 fue determinada según el método de los mínimos cuadrados.
Resultados
Ensayo de toxicidad aguda oral
Al administrar la celulosa microcristalina suspensión al 12 % no se observó la presencia de síntomas tóxicos y no se encontró mortalidad en el período de observación. El peso corporal no disminuyó en ninguno de los grupos experimentales, lo que se evidencia en la figura 1 al observar el incremento de peso.
En la autopsia realizada no se encontraron evidencias de alteraciones patológicas en los órganos analizados.
FIG. 1. Comportamiento del peso corporal durante 14 días con celulosa microcristalina suspención al 12 %
(2000 mg/kg, vía oral).
Estudio farmacológico
El taurocolato de sodio 100 mM (disuelto en ácido clorhídrico) produjo un daño gástrico severo. Las lesiones consistieron en áreas alargadas necróticas, localizadas en el cuerpo (porción secretora de ácido), no en el antro ni en el fondo gástrico en correspondencia con lo encontrado en la literatura.4
Ensayo preliminar. Los gráficos que aparecen en la figura 2 a y b muestran el comportamiento de los 2 indicadores del daño, medido sobre la mucosa gástrica (número y severidad de las lesiones) por acción de celulosa microcristalina suspensión al 12 % (360 mg/kg) y su placebo. Ambas sustancias disminuyeron significativamente los valores de estos indicadores con respecto al grupo control (p < 0,01); nótese además que el grupo placebo no difiere significativamente del grupo tratado con la suspensión.
FIG. 2. Efecto de celulosa microcristalina suspensión al 12 % sobre lesiones gástricas inducidas por taurocolato de sodio (100 mM, vía oral. A) Efecto sobre el número de lesiones; b) efecto sobre la severidad de las lesiones.
** Difiere significativamente con respecto a control p <0,01 (n=8).
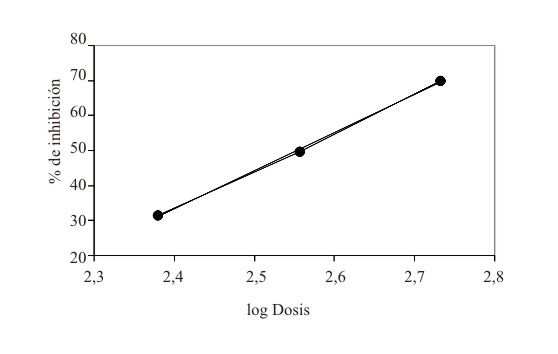
Determinación de las DE50. Los grupos tratados con las diferentes dosis de la celulosa microcristalina suspensión al 12 % mostraron un comportamiento dosis dependiente, lo que se evidencia en la figura 3. Al calcular la DE50 se obtuvo un valor de 356,38 mg/kg, valor este que se corresponde con la dosis que provoca el 50 % de inhibición del número de lesiones. El coeficiente de correlación encontrado fue de 0,9995.
FIG. 3. Curva dosis-efacto de celulosa microcristalina suspensión al 12 % (240-500 mg/kg; vía oral) en lesiones
gástricas inducidas por taurocolato de sodio (100 mM, vía oral) DE50=356,38 mg/kg determinada según método
de mínimos cuadrados.
Las 3 dosis de placebo mostraron un comportamiento antiulceroso dosis dependiente inverso, puesto que al aumentar la dosis se obtuvieron valores de porcentajes de inhibición decrecientes (75,41; 66,55 y 61,19 %).
Discusión
En la evaluación de la toxicidad aguda oral de celulosa microcristalina suspensión al 12 %, no se presentó mortalidad para la dosis de 2 000 mg/kg, la cual se considera límite para los estudios de toxicidad aguda oral. Atendiendo a las clases de toxicidad establecidas por la Comunidad Europea, la suspensión se considera no tóxica ya que presenta una mortalidad mayor a la dosis ensayada entrando en el rango de no clasificado.5
Lo encontrado en el estudio de toxicidad era de esperar debido a que no se ha reportado ningún efecto colateral adverso atribuible a su uso.1
Numerosos han sido los estudios que han demostrado que los efectos perjudiciales de los ácidos biliares sobre la mucosa gástrica conducen a edema, hemorragia y erosiones. Los mecanismos principales involucrados en el daño gástrico causado por los ácidos biliares incluyen:
- ruptura de la barrera mucosa, acompañado de un incremento en la retrodifusión de iones hidrógeno;
- incremento de la permeabilidad de los capilares de la mucosa, lo que causa exudación de fluido y edema;
- formación de erosiones mucosas y sangramiento.4
La acción ejercida por el placebo sobre las lesiones pudieran explicarse por la composición y características físicas de este. Entre los componentes del vehículo viscoso se encuentra el sorbitol al 15 % y se ha comprobado que en el desarrollo de lesiones gástricas por ácido clorhídrico 0,6 N en ratas, el número y la severidad de las lesiones fueron significativamente mayores en los animales ayunados 24 ó 48 h, que en los alimentados con glucosa al 20 % durante igual período (Morón F. Gastric cytoprotection. Experimental and clinic studies. Tesis para optar por el grado de Candidato a Doctor en Ciencias Médicas. Péc, Hungría, 1983). Por otro lado, la consistencia viscosa de la solución podría facilitar que esta se adhiera y permanezca por más tiempo en contacto con la mucosa, lo que también podría ser un factor contribuyente a la relativa protección de la mucosa observada en los grupos que recibieron placebo.
Las fibras dietéticas tienen la facultad de unirse y atrapar a los ácidos biliares, y de tal forma reducen su presencia en la luz gástrica y por consiguiente sus efectos nocivos sobre la mucosa. La celulosa es capaz de inactivar los ácidos biliares, lo que fue demostrado por los estudios de Cheah y Bernstein,6 quienes utilizaron la celulosa para pretratar los ácidos biliares y demostraron que estos perdían su capacidad agresiva sobre el DNA celular, lo cual sugiere que esta puede actuar también como catalizador al promover la poliesterificación de ácidos biliares hacia una forma inactiva.
Además, una estimulación en la secreción de moco tras la administración de la celulosa pudiese también explicar su efecto protector sobre la mucosa. Se ha sugerido que el moco actúa de soporte para la secreción alcalina. Esta se concentra en el moco, en contacto con la superficie mucosa, y mejora su rendimiento neutralizante.7 Por todo esto la capa de moco se ha postulado como la primera barrera de defensa.
Adicionalmente, se conoce que el gel mucoso secretado por la mucosa gástrica contiene numerosos fosfolípidos, lo que le confiere una naturaleza altamente hidrofóbica a esta capa de la superficie gástrica luminal brindándole protección contra agentes dañinos.8 Esta hidrofobicidad de la superficie gástrica puede ser eliminada por agentes destructores de la barrera mucosa como los ácidos biliares9 que son capaces de formar un complejo químico con los fosfolípidos de dicha capa hidrofóbica.
La celulosa microcristalina suspensión al 12 % protegió la mucosa gástrica, significativamente y de manera dosis dependiente, del daño inducido por taurocolato de sodio, efecto que puede estar relacionado con una inactivación de los ácidos biliares o una alteración en la cantidad o composición de la capa de moco que recubre la mucosa gástrica.
Summary
The microcrystalline cellulose has been used recently in the treatment of alkaline gastritis due to duodenogastric biliary reflux. A toxicological study was conducted and the antiulcer effect of microcrystalline cellulose suspension 12 % was evaluated in rats. Acute oral toxicity was determined by the limited dose test through the administration of a dose of 2 000 mg/kg to animals of both sexes. The protective effect over the gastric mucosa was evaluated in the injuries induced by sodium taurocholate. Doses of 240, 360 and 540 mg/kg of the suspension were tested. As a result, no mortality was reported for the tested dose in the toxicological study. Therefore, the substance was clasiffied as non toxic. The different doses used for the antiulcer effect reduced significantly the number and intensity of the injuries depending on the dose. The mean effective dose was 356.8 mg/kg. These findings allowed to suggest that the protective effect microcrystalline cellulose suspension 12 % could be given by an inactivation of the biliary acids or by an alteration in the quantity or composition of the layer of mucus covering the gastric mucosa.
Key words: Microcrystalline cellulose; rats; toxicity; gastric ulcers, sodium taurocholate.
Referencias Bibliográficas
- Paniagua M, Piñol F. Nueva terapéutica de la gastritis alcalina. La Habana: Ed Academia; 1999. p.5-20.
- OECD GUIDELINE FOR TESTING OF CHEMICAL.Acute oral Toxicity. 401 Adopted 24 February 1987.
- Konturek SJ, Brzozowski T, Drozdowicz D, Beck G. Role of leukotrienes in acute gastric lesions induced by ethanol, taurocholate, aspirin, platelet-activating factor and stress in rats. Dig Dis Sci 1988;33:806-13.
- Chaudhury TK, Robert A. Prevention by mild irritants of gastric necrosis produced in rats by sodium taurocholate. Dig Dis Sci 1980;25:830-6.
- Commission of the European Communities (1992 a) Annex to Commission Directive 92/69/EEC of 31 July 1992 adapting to technical progress for the seventeenth time Council Directive 67/548/EEC on the approximation of laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances. B. 1 Acute toxicity (oral). Off J Eur Comm (L383A) 35: 110-2.
- Cheah PY, Bernstein H. Colon cancer and dietary fiber: Celulose inhibits the DNA-damaging ability of bile acids. Nutr Cancer 1990;13:51-7.
- Kao YC, Lichtenberger L. Effect of 16,16 dimethyl prostaglandin E2 on the lipidic organelles of rat gastric surface mucous cells. Gastroenterology 1993;104:103-13.
- Goddard PJ, Kao Y-C, Lichtenberger LM. Lumenal surface hydrophobicity of canine gastric mucosa is dependent on a surface mucus gel. Gastroenterology 1990;98:361-70.
- Hills BA. Gastric surfactant and the hydrophobic mucosal barrier. Gut 1996;39:621-4.
Recibido: 8 de enero de 2004. Aprobado: 13 de febrero de 2004.
Lic. Pedro Gilberto Barzaga Fernández. Centro de Investigación y Desarrollo de Medicamentos. Calle 17 No. 6208 e/ 62 y 64 Playa, Ciudad de La Habana, Cuba. E-mail: cidem@infomed.sld.cu
1 Licenciado en Ciencias Farmacéuticas. Investigador Aspirante.
2 Master en Toxicología Experimental. Investigadora Agregada.
3 Doctora en Ciencias Veterinarias. Investigadora Auxiliar.
4 Master en Tecnología de Medicamentos. Investigadora Agregada.
5 Técnica en Farmacia.
6 Técnico en Química.