Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.39 n.1 Ciudad de la Habana ene.-abr. 2005
Centro de Investigación y Desarrollo de Medicamentos
Desarrollo y validación de una metodología para la limpieza de áreas de producción de tabletas de penicilamina
Nuria García Díaz,1 Alejandro Padrón Yaquis,2 Liliana Mateu1 e Ivonne Albertus Jiménez3
Resumen
Se desarrolló una metodología de limpieza para aplicar en áreas de producción y desarrollo donde se trabaje con penicilamina, un compuesto altamente contaminante y tóxico. Se validó un método por cromatografía líquida de alta eficiencia que fue seleccionado por la versatilidad de este tipo de técnicas para la detección de trazas. El método resultó específico, lineal, exacto y preciso en el rango de concentraciones de trabajo. Se determinaron los límites de detección y cuantificación. Se utilizó el método de muestreo por hisopado, con el que se obtuvieron resultados satisfactorios y se concluyó que los procedimientos de limpieza resultaron efectivos para el peor de los escenarios.
Palabras clave: Penicilamina, validación, validación de limpieza.
El concepto de validación de limpieza ha recibido una creciente atención en los últimos años. Esto comenzó con la edición de la Guía de inspección de validación de limpieza de la FDA en julio de 1993.1 (FDA. Guide to Inspection of validation of clearing processes. Division of Field Investigations. Office fo Regional Operations. Office of Regulatory Affaire. July, 1993).
Los esfuerzos de validación de limpieza en instalaciones farmacéuticas ya se han descrito en la literatura.2-5
La limpieza de las áreas escogidas incluye los equipos, teniendo en cuenta que los procedimientos son específicos para el compuesto y para cada formulación farmacéutica. En todos los casos deben establecerse los límites del compuesto así como los métodos de control.1-6
El desarrollo de esta metodología posibilita intercambiar experiencias y enriquecer tanto nuestro trabajo y el de la Industria Médico Farmacéutica cubana. La necesidad de disminuir los límites de residuos de una producción a otra constituye el punto crítico para aquellos que se dediquen a la producción e investigación de medicamentos.
El objetivo de nuestro trabajo está encaminado a presentar una metodología de limpieza utilizada en el cambio de campaña de un producto altamente contaminante y tóxico derivado de la penicilina, la penicilamina (fig. 1), en un área de desarrollo de tecnologías del Centro de Investigación y Desarrollo de Medicamentos.
FIG. 1. Estructura química de la penicilamina.
Métodos
Aspectos a tener en cuenta:
- Seleccionar método de control.
- Seleccionar puntos críticos.
- Seleccionar método de muestreo.
- Seleccionar metodología de limpieza.
- Realizar cálculos de límites de residuos.
El método de prueba escogido fue la cromatografía líquida de alta eficiencia, los análisis se realizaron en un equipo KNAUER con detector Ultravioleta-Visible, bomba de doble pistón reciprocante KNAUER y un microprocesador de datos SHIMADSU ajustando las condiciones cromatográficas siguientes:
Columna Lichrosorb RP-18 de 10 µm (100 x 4mm)
Fase móvil: buffer fosfato de sodio monobásico (0,06 M) que contiene hexanosulfonato de sodio 0,20 g/L, pH 3,0 ± 0,1.
Longitud de onda (l): 200 nm.
Flujo: 1 mL/min.
Volumen de inyección: 20 µL.
Todos los reactivos utilizados para los análisis fueron calidad analítica.
Se determinaron los parámetros de desempeño que comprenden linealidad, especificidad, precisión, exactitud y rango incluyendo límite de detección y de cuantificación por la metodología establecida para la validación de métodos de análisis. La especificidad se realizó teniendo en cuenta los componentes de la formulación así como los contaminantes potenciales de las muestras en el área de trabajo como, por ejemplo, excipientes, componentes del detergente y las soluciones que se utilizaron en los procedimientos de limpieza así como también el placebo y el principio activo del producto a fabricar con posterioridad.
La linealidad, la exactitud y el rango se estudiaron de forma simultanea, para esto se prepararon muestras con diferentes niveles de penicilamina las que contenían 500, 250, 125, 60, y 30 mg, y se realizaron los análisis por triplicado.
La precisión se evaluó teniendo en cuenta los parámetros de repetibilidad y precisión intermedia, se realizó el análisis por quintuplicado de una muestra homogénea común por diferentes analistas, días y equipos.
Los límites de detección y cuantificación se estimaron por extrapolación a cero en la curva de regresión considerando concentraciones bajas del analito.
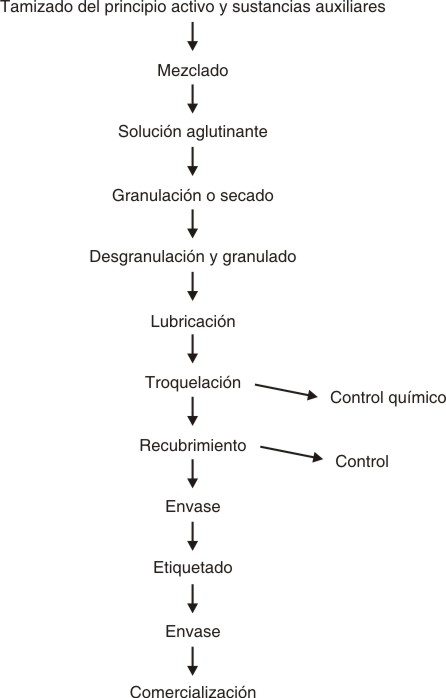
Sobre la base del flujo tecnológico (fig. 2) se seleccionaron los puntos críticos, que fueron potencialmente los puntos de muestreo, para ello se escogieron lugares de difícil acceso para la limpieza que fueron debidamente identificados.
Se realizaron 5 limpiezas y los muestreos se efectuaron después de la segunda, cuarta y quinta limpiezas, efectuándose en la segunda limpieza un análisis total de las muestras mientras que en las restantes los análisis se realizaron de forma aleatoria.
FIG. 2. Flujo tecnológico del proceso de producción de la penicilamina.
El método de muestreo escogido fue el hisopado con algodón comercial humedecido en agua por la gran solubilidad del principio activo. Para retirar los residuo de penicilamina de las superficies. el hisopado se aplicó en el sitio de muestreo (25 cm2) realizando cierta presión para retirar el fármaco, a continuación se frotó con otro hisopo seco con el fin de retirar cualquier remanente de fármaco en la superficie. Ambos hisopados se combinaron y se analizaron por el método de control.
El recobrado para el método de muestreo se evaluó adicionando cantidades conocidas de penicilamina a una superficie previamente definida (25 cm2) y posteriormente evaluando el recobrado por el método de control.
La limpieza de los equipos se efectuó de la manera siguiente:
- Se retiraron los residuos gruesos de las formulaciones de las superficies con una aspiradora (NILFISK GS 80 ).
- Se realizó un lavado con gasa húmeda en H2O por la alta solubilidad del principio activo con el fin de eliminar la mayor cantidad posible de este.
- Se aplicó un primer lavado con agua a presión.
- Se aplicó un lavado con agua corriente más detergente industrial.
- Se aplicó un segundo lavado con agua corriente a presión.
- Se realizó un frotado con alcohol al 70,0 % por toda la superficie.
En el caso de las áreas la limpieza:
- Se retiraron los residuos gruesos de las formulaciones de las superficies con una aspiradora (NILFISK GS 80).
- Se aplicó un primer lavado con agua corriente a presión.
- Se aplicó un lavado con agua corriente más detergente industrial.
- Se aplicó un segundo lavado con agua corriente a presión.
Los límites de residuos se calcularon sobre la base de 3 criterios:1,6
- Límite relacionado con la dosis: Establece que no más del 0,001 % de la dosis de cualquier producto puede aparecer en la dosis diaria máxima del otro.
- Límite relacionado con la salud:
ARL(µg/hisopo) = ADI/MDD x DUB/SSA x M x REC
ARL: límite de residuo permitido.
ADI: ingesta diaria permisible de penicilamina (producto A).
MDD: número máximo de la dosis de producto B tomadas por día.
DUB: número de unidades B fabricadas.
SSA: área superficial del equipo compartida.
M: área superficial por hisopo.
Rec: recuperación remanente de las muestras.
Producto B: es el que se fabricará luego de la limpieza.
3. Límite relacionado con la adulteración:
ARL(µg/hisopo)= UAL x MBS/SSA x M x REC
UAL: límite de aceptación superior (10 mg/kg de producto B).
MBS: tamaño mínimo del lote del producto B en kg.
SSA: área superficial del equipo compartida.
M: área superficial por hisopo.
Rec: recuperación remanente de las muestras.
Todos los criterios fueron evaluados y se escogió el de menor valor como límite de residuos para nuestro producto.
Una vez terminada la limpieza se realizaron pruebas del producto B y se analizaron por el método de control.
Resultados
Se estableció una metodología de limpieza que resultó efectiva para los equipos y las áreas implicadas en la producción de la penicilamina.
Los límites de residuos calculados para todos los casos fueron mayores que el límite de detección del método de prueba; se demostró que este es lo suficiente confiable para la detección de trazas de penicilamina y se estableció una metodología para los cálculos de límites de residuos, además de crear las bases para el diseño de los procedimientos de limpieza de equipos y de áreas involucradas en la producción de este producto.
La metodología de limpieza desarrollada puede aplicarse en cualquier área de características similares para la limpieza intermedia o el cambio de campaña cuando se está trabajando con penicilamina.
El método de control resultó ser específico, lineal y preciso en el intervalo de concentraciones escogidos. Los resultados del estudio de linealidad y y exactitud se muestran en la tabla 1 y 2.
TABLA 1. Resultados del estudio de linealidad
| Linealidad | Y = a + bX | r | Sbrelativa | a ± tSa |
| -5720,032 + 8396,95X | 0,9999 | 0,5585 % | 5720,032 ± 27185,38 |
TABLA 2. Resultados del estudio de linealidad
| Exactitud | Y = a + bX | r | Recobrado | a ± tSa | b ± tSb |
| -0,00727 + 0,99995X | 0,99999 | 99,87 % | 0,00727 ± 1,60 | 0,99995 ± 0,0062 |
Discusión
El estudio de especificidad para el método de control demostró que no existen interferencias en la zona de elusión del pico de interés con los componentes de la formulación ni los contaminantes potenciales que pudieran estar presentes en el área a la hora de realizar las limpiezas, también se tuvo en cuenta la no interferencia del compuesto B.
Los estudios de linealidad y exactitud (tablas 1 y 2) cumplieron con los requisitos establecidos; los coeficientes de correlación en ambos casos son mayores de 0,99. En el caso de la linealidad la desviación estándar relativa (Sbrelativa) fue menor que el 2,0 % y el intervalo de confianza del intercepto incluye el valor cero, lo que demuestra que el método es lineal en el intervalo estudiado. Los resultados encontrados en el estudio de exactitud comprueban que los porcentajes de recobro se encuentran entre 98,0 y 102,0 %. La prueba del intercepto y la pendiente resultaron no significativos, lo que demuestra que el método es exacto.
En el caso del estudio de precisión se encontró que no existieron diferencias significativas entre las precisiones ni entre las medias alcanzadas por diferentes analistas; el coeficiente de variación resultó menor que 2,0 %, por lo que se puede afirmar que el método de control es preciso.
Los resultados del estudio demostraron que el método es lineal, exacto, específico en el rango de concentraciones de trabajo.
El método es sensible, los límites de detección y cuantificación resultaron 1 y 3 ng respectivamente.
El método de muestreo seleccionado no presentó interferencias con el método de control y los recobrados obtenidos para estos fue en todos los casos superior al 90,0 %, los que se encuentran dentro del rango de valores esperados.
La metodología de limpieza empleada tanto para las áreas como para los equipos resultaron efectivas, después de realizar 5 limpiezas para el cambio de campaña, lo que confirma la alta contaminación del producto en las áreas estudiadas (tabla 3).
TABLA 3. Resultados del análisis de las muestras
| Puntos de muestreo | Resultados del análisis de las muestras (µg/cm2) | ||
| Segunda limpieza | Cuarta limpieza | Quinta limpieza | |
| Techo de la consola | 0,89 | 15,59 | No detectable |
| Techo de la encapsuladora | 4,42 | 1,36 | No detectable |
| Armario de troqueles | 3,62 | 1,99 | No detectable |
| Pared derecha del área de producción | 0,397 | 17,04 | No detectable |
| Micronizador | 1,39 | 10,96 | No detectable |
| Techo del Gladd | 11,12 | 8,26 | No detectable |
| Techo del VIani | 35,95 | 18,92 | No detectable |
| Mezcladora | 7,87 | 2,14 | No detectable |
| Mezcladora intrínseca | 112,77 | 4,36 | No detectable |
| Pared trasera del lecho del Viani | 16,16 | - | No detectable |
| Debajo del Viani | 110,52 | - | No detectable |
| Dentro del Viani | 78,78 | - | No detectable |
| Mangueras del Viani | 34,78 | - | No detectable |
| Canasto del Viani | 112,46 | - | No detectable |
| Troqueladora de un punzón | 90,73 | - | No detectable |
| Debajo de la balanza | 126,13 | 0,24 | No detectable |
| Aire acondicionado | 145,43 | - | No detectable |
| Granulador | 46,39 | - | No detectable |
| Pared derecha de la balanza | 772,11 | - | No detectable |
| Determinador de humedad | 107,05 | - | No detectable |
| Troqueladora Vianchi | 41,80 | - | No detectable |
| Troqueladora Manesty (techo) | 0,56 | - | No detectable |
| Carrito de troquelación | 43,11 | No detectable | No detectable |
| Troqueladora Manesty (dentro) | 591,26 | 0,12 | No detectable |
| Pared izquierda de la troqueladora | 23,01 | No detectable | No detectable |
| Pared derecha de la troqueladora | 12,68 | No detectable | No detectable |
| Debajo de la troqueladora Manesty | 92,80 | 0,06 | No detectable |
| Debajo del agitador | 0,80 | 0,19 | No detectable |
| Debajo del desintegrador | 10,15 | - | No detectable |
Una vez analizados los placebos de la formulación del producto B, se demostró la no presencia de trazas de penicilamina, indicativo de la efectividad de la metodología de limpieza en este caso.
Al realizar los cálculos se pudo comprobar que los valores de los límites permisibles obtenidos se encontraban por encima del valor del límite de detección del método de prueba; el menor valor de los calculados, fue el criterio relacionado con la salud, lo que demuestra que el método de prueba es lo suficientemente confiable para la detección de trazas de penicilamina durante el proceso de limpieza.
Summary
Development and validation of a methodology for cleaning areas of production of penicillamine tablets
A cleaning methodology was developed to be used in production and development areas, where work with penicillamine is done. It is a highly contaminating and toxic compound. A method was validated by high performance liquid chromatography that was selected due to the versatility of this type of techniques for detecting traces. The method proved to be specific, lineal, accurate and precise in the range of working concentrations. The limits of detection and quantification were determined. The sampling method by brushing was used and satisfactory results were attained. It was concluded that the cleaning procedures were effective for the worst of the settings.
Key words: Penicillamine, validation, cleaning validation
Referencias Bibliográficas
1. Forsyth RJ, Haynes DV. Validación de limpieza de uma instalación de investigación farmacéutica. Pharm Technol. 1998;22(1):33-9.
2. Jenkins KM, Vanderwirlen AJ. Clearing validation: an overall perspective. Pharm Technol. 1994;18 (4):33-9.
3. Agalloco J. Points to consider in the validation of equipment cleaning procedures. J Parenteral Sci Technol. 1992;46(5):163-8.
4. Forman GL, Mullen MV. Determining cleaning validation acceptance limits for pharmaceutical manufacturing operations. Pharm Technol. 1993;17(4):54-60.
5. Romanach R, Garcia S F, Vollanieva O, Pérez F. Esfuerzos combinados para la limpieza de equipos en instalaciones de equipos farmacéuticos. Pharm Technol. 1999;19(1):12-21.
6. Destin A. Establecimiento de los criterios de aceptación científicamente justificados para la validación de limpieza de productos farmacéuticos terminados. Pharm Technol. 1999;19 (2):33-8.
Recibido:3 de enero de 2005. Aprobado: 31 de enero de 2005.
MSc. Nuria García Díaz. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605 entre Boyeros y Calzada de Puentes Grandes, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1Licenciado en Ciencias Farmacéuticas.
2Master en Ciencias.
3Técnico en Química Industrial.