Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.39 n.1 Ciudad de la Habana ene.-abr. 2005
Centro de Investigación y Desarrollo de Medicamentos
Reformulación de tabletas de clorpromazina clorhidrato 25 mg
Iverlis Díaz Polanco,1 Madeleine Penichet,1 Liliana Mateu López,2 Evangelina Uribarri,3 Jorge Rodríguez Chanfrau,4 Daysi Pérez-Velazco4 y Teresa Alfaro5
Resumen
Se realizó la reformulación de clorpromazina clorhidrato 25 mg en forma de tabletas revestidas. Se diseñó el proceso tecnológico, desde la elaboración de los núcleos hasta la formulación de revestimiento en sistema acuoso, factible para su introducción a escala piloto. Las tabletas obtenidas poseen buena estabilidad física y química en el tiempo, y mantienen su potencia dentro de los límites terapéuticos por un período de 2 años.
Palabras clave: Clorpromazina, tabletas, reformulación.
La clorpromazina es un agente neuroléptico, antipsicótico y ansiolítico del grupo de las fenotiazinas, tiene acción depresora del sistema nervioso central (SNC), constituye un bloqueador beta-adrenérgico y posee débil acción anticolinérgica.1-5 La acción antipsicótica se produce por bloqueo de receptores postsinápticos dopaminérgicos y mesolímbicos en el cerebro.
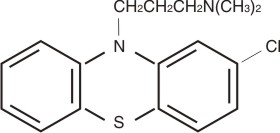
La clorpromazina es inestable en solución alcalina, por lo que generalmente se utiliza en forma de sales para preparaciones farmacéuticas. Dentro de los que se emplean el clorhidrato de clorpromazina (fig.), es menos susceptible al ácido que la base libre y de ahí que sea más estable en el fluido gástrico.3,4
FIG. Estructura química de la sal de clorhidrato de clorpromacina.
Es conocido que la clorpromazina se degrada en presencia de la luz por oxidación fotoquímica, por lo que una forma de protegerla frente a agentes externos es desarrollar una formulación en forma de tabletas revestidas.2,6,7
Se expende internacionalmente en forma de cápsulas y comprimidos.2,8 En Cuba este medicamento no se importa, pues se dispensa en esta última forma farmacéutica tabletas revestidas (con solventes orgánicos), tecnología con la que se cuenta a escala industrial.
Por la necesidad imperiosa de garantizar una adecuada seguridad tanto al operario como al medio ambiente, así como la protección de la capa de ozono, se decidió introducir a escala industrial el revestimiento de película en sistema acuoso, comenzando por la reformulación de productos en forma de tabletas revestidas con suspensiones en solventes orgánicos por suspensiones acuosas, en tal sentido se abordó la reformulación de las tabletas de clorpromazina clorhidrato 25 mg.
El estudio de formulación, la evaluación de su estabilidad físico-química y química, su evaluación microbiológica y su posterior introducción a escala piloto, constituyen los objetivos del presente trabajo.
Métodos
En el presente trabajo se diseñaron diferentes formulaciones que contenían 25 mg/tableta del clorhidrato de clorpromazina y se emplearon sustancias auxiliares de uso común en la Industria Farmacéutica para la elaboración de sólidos orales (tabla 1).
TABLA 1. Composición básica de los núcleos
| Componente | Formulación B % w/w | Formulación anterior % w/w |
| Clorpromazina clorhidrato | 21 | 21 |
| Almidón de maíz | 14,6 | 32 |
| Lactosa monohidratada | 32 | 14,6 |
| Carbonato de calcio | 14 | 14 |
| Celulosa microcristalina pH 101 | 5 | 10 |
| Croscarmelosa sódica | 3 | 6 |
| Polivinilpirrolidona K-25 | 0,9 | 0,9 |
| Estearato de magnesio | 1 | 1 |
| Talco | 0,5 | 0,5 |
Los granulados se fabricaron por el método de granulación húmeda con la utilización de un lecho fluidizado marca VIANI.
Las tabletas o núcleos a cubrir deben de reunir determinadas características físicas como, por ejemplo, una elevada resistencia mecánica, para que sean capaces de soportar los constantes choques y la elevada abrasión a que serán sometidos durante el proceso de revestimiento (Antonio Iraizos C. Conferencias de Tecnología Farmacéutica II. Departamento de Tecnología y Control de Medicamentos. Universidad de la Habana, La Habana, 1990. p. 164-83). Para lograr esto se sustituyó como agente de relleno el almidón de maíz por la lactosa monohidratada. La formulación contiene además agentes desintegrantes, suspensores y antiadhesivos en proporciones adecuadas.
Para la protección del principio activo del medio ambiente y evitar la contaminación, se sustituyó el revestimiento fílmico orgánico de goma laca en solución con alcohol y acetona por un revestimiento tipo película en sistema acuoso con policoat 2 blanco, preparado comercial que contiene como ingredientes: polímero, plastificantes, humectantes, opacantes, etc., el cual no resulta agresivo al individuo ni al medio ambiente y brinda elegancia al producto final permitiendo su identificación y presentación para su posterior comercialización. La suspensión de recubrimiento se coloreó con una mezcla de colorantes insolubles existentes en la industria para la fabricación de sólidos orales: azul No.1 lake (indigotina) y amarillo No.5 lake (tartrazina) en diferentes proporciones, con el objetivo de mantener la misma tonalidad de color entre las tabletas recubiertas con la formulación orgánica existente y la formulación desarrollada en sistema acuoso.
Para el revestimiento de los núcleos se empleó un bombo Osteria Grande GS Italia con capacidad máxima de 10 kg, para atomizar la suspensión se usó una boquilla de 1,4 mm de diámetro del orificio, con una tapa 03 y una presión de 2 bar. El recubrimiento desarrollado solo incrementa un 3 % el peso del núcleo. En la tabla 2 se muestran las formulaciones ensayadas.
TABLA 2. Composición de las formulaciones de recubrimiento fílmico para el producto terminado
| Componente | Formulación A %w/w | Formulación B %w/w | Formulación Anterior % w/w |
| Goma laca al 10 % | _ | _ | 4,5 |
| Polietilenglicol 20000 | _ | _ | 0,45 |
| Mezcla talco-titanio | _ | _ | 7,5 |
| Policoat 2 blanco | 2,325 | 2,85 | _ |
| Azul No. 5 lake | 0,225 | 0,05 | 0,225 |
| Amarillo tartrazina No. 5 lake | 0,45 | 0,1 | 0,45 |
El escalado piloto se realizó en los Laboratorios MedSol, con vistas a comprobar la reproducibilidad a mayor escala del método de elaboración empleado y entre los lotes del producto terminado.
Las determinaciones del principio activo en el control de calidad y en los estudios de estabilidad acelerada y por vida de estante emplearon la técnica descrita en la Farmacopea Británica BP 93,9 para lo cual se cumplieron con los parámetros exigidos para este tipo de método.
Para el estudio de estabilidad acelerada, las muestras se colocaron a temperaturas de 40, 50, 60 y 70 °C durante 9 meses y se realizaron valoraciones del principio activo a diferentes intervalos de tiempo. Por otra parte, se realizaron estudios de influencia de la luz y de la humedad a 75, 84 y 92 % de humedad relativa a temperatura ambiente durante 8 meses.
El control microbiológico se realizó mediante la técnica que establece los límites de contenido microbiano para las tabletas de clorpromazina clorhidrato, según lo reportado en la Farmacopea de los Estados Unidos 23.5
Resultados
Como resultado de la evaluación de la influencia de diferentes excipientes de relleno en la resistencia mecánica de las tabletas, se obtuvo que al reducirse en tal porcentaje el almidón de maíz y sustituirse por lactosa monohidratada se incrementó la dureza de 4 a 7 kgf a iguales fuerzas de compresión.
El ensayo B de revestimiento resultó ser el mejor; porque permitió obtener tabletas de mayor, calidad superficial y con una tonalidad de color más similar a las obtenidas con la formulación de revestimiento orgánico.
El escalado piloto de 3 lotes, de 10 kg cada uno, de este medicamento se realizó en los Laboratorios MedSol y resultó satisfactorio. A pesar de que durante el proceso de revestimiento el tiempo (3 h) fue superior al del revestimiento de tipo orgánico (1 h), la suspensión resultó más estable físicamente.
Todos los lotes fabricados satisfacen el control microbiológico establecido para productos no estériles.
Las tabletas obtenidas presentaron buenas características organolépticas y adecuados parámetros físico-mecánicos y tecnológicos, según los límites establecidos.
Los parámetros analíticos estudiados en el control de calidad para cada uno de los lotes, como son: descripción, identificación, sustancias relacionadas, desintegración y valoración cumplen con los límites establecidos para este producto2 (tabla 3).
TABLA 3. Resultados del control de calidad de los lotes pilotos
| Denominación | L-6001 | L-7002 | L-7003 | Límites |
| Descripción | Responde | Responde | Responde | Tabletas revestidas biconvexas de color verde |
| Identificación | Responde | Responde | Responde | La mancha obtenida para la solución 1 corresponde en posición, fluorescencia y color con la 2 |
| Sustancias relacionadas | Responde | Responde | Responde | El área de intensidad de las manchas de la solución muestra no son mayores que la de la solución estándar |
| Desintegración | 6´28´´ | 6´00´´ | 6´25´´ | Menos de 30 min en agua desionizada a 37 ± 2 °C. |
| Valoración | 98,0 % | 100,1 % | 98,8 % | De 92,5-107,5 % |
Los estudios de estabilidad acelerada a diferentes temperaturas, mostraron que al cabo de los 9 meses el producto no sufre variación significativa de las características organolépticas, igualmente no se observó una variación significativa en la concentración del principio activo. No se observaron manchas adicionales, ni disminuyó la intensidad de las manchas correspondientes al principio activo con respecto al estándar al cromatografiarse en placa delgada. El ensayo de las sustancias relacionadas respondió a las exigencias de la farmacopea.9
Por otro lado, los resultados analíticos demostraron que en las tabletas recubiertas el principio activo no se afecta por la luz, aunque organolépticamente sufren alguna variación, al disminuir muy levemente la intensidad del color, lo que se debe a la baja estabilidad física de los colorantes. Lo mismo ocurre con las muestras sometidas al estudio de influencia de la humedad donde además pudo observarse que el recubrimiento ofrece buena protección al vapor de agua, ya que las tabletas conservan su integridad, incluso en las cámaras de elevada humedad.
Los resultados alcanzados en el estudio de estabilidad por el método de vida de estante, indican que al cabo de los 24 meses, todos los parámetros analíticos estudiados, como son: descripción, sustancias relacionadas, valoración, desintegración y disolución, cumplen con los límites establecidos.9 En la tabla 3 se muestran los resultados obtenidos en el tiempo de estudio, para los últimos 3 parámetros antes mencionados, al ser estos los que fundamentalmente pudieran afectarse con el recubrimiento.
Discusión
El incremento de la dureza de los núcleos al cambiar el agente de relleno se debe a que la lactosa está formada por cristales plásticos que se deforman bajo presión, lo que los hace compresibles y cohesivos, por lo cual ofrece mayor cohesión y fortaleza al grano formado, a diferencia del almidón no modificado que no comprime bien y tiende a incrementar la friabilidad de la tableta y la laminación si es usado en altas concentraciones (32 %).10
El proceso de revestimiento resultó fácil teniendo en cuenta que la preparación de la suspensión es muy rápida y sencilla al contar esta con una poca variedad de componentes (policoat, colorante y agua), y por ende verse facilitada la mezcla entre la suspensión de policoat y los colorantes.
Con la formulación B se obtuvieron tabletas de similar color a las ya existentes, debido a que la suspensión de policoat requiere menor cantidad de colorantes para producir similar tonalidad de color, con respecto a la obtenida con la mezcla talco:dióxido de titanio y los colorantes, empleada en la formulación con revestimiento orgánico. Tal comportamiento puede estar sustentado en la poca variedad de componentes que posee la formulación de revestimiento con policoat, con respecto a la formulación con goma laca, y la elevada concentración (7,5 % w/w) de la mezcla de opacantes empleadas en dicha formulación.
Al realizarse el escalado piloto de este medicamento con resultados satisfactorios, se propició una adecuada reproducibilidad del método de elaboración a una mayor escala de producción y del producto terminado entre los distintos lotes fabricados.
La elevada estabilidad física de la suspensión de revestimiento acuoso se debe al alto grado de viscosidad de esta, con respecto al de la suspensión de revestimiento orgánico.
A partir de los estudios de estabilidad acelerada no pudo predecirse una fecha de vencimiento del medicamento, debido a que el principio activo no disminuyó significativamente su valoración y no pudo aplicarse el procesamiento matemático establecido.
Los resultados del estudio de influencia de la luz y la humedad en las tabletas recubiertas, son indicativo de que el recubrimiento de película en sistema acuoso garantizó una adecuada estabilidad física y química de las tabletas ante la influencia de los factores externos antes mencionados.
Como puede observarse en la tabla 4, el recubrimiento de película en sistema acuoso garantizó una adecuada estabilidad química del principio activo, específicamente de los parámetros antes mencionados, lo que permite predecir que la clorpromazina clorhidrato en forma de tabletas recubiertas mantiene su estabilidad por un período de 2 años, envasada en frascos plásticos opaco de polietileno de baja densidad a temperatura ambiente.
TABLA 4. Resultados del estudio de estabilidad en vida de estante
| Denominación | Valoración (%) | Desintegración (min) | Valor medio de disolución (%) | ||||||
| Lote | 6001 | 7001 | 7002 | 6001 | 7001 | 7002 | 6001 | 7001 | 7002 |
| Inicial | 98,0 | 100,1 | 98,8 | 6'28" | 6' | 6'25" | 100,1 | 96,76 | 100,3 |
| 6 meses | 99,9 | 98,6 | 98,9 | 6'45" | 6'20" | 6'37" | - | - | - |
| 9 meses | - | - | - | 7'10" | 7'00" | 6'45" | - | - | - |
| 12 meses | 98,7 | 96,3 | 98,1 | 7'20" | 7'50" | 7'00" | - | - | - |
| 24 meses | 97,1 | 101,6 | 103,1 | 8'39" | 8'34" | 8'40" | 97,89 | 93,00 | 97,85 |
| Límites | 92,5-107,5 % | Menos de 30 min en agua a 37 ± 2 °C | Q> 80 % en 30 min | ||||||
No obstante, puede observarse en la tabla 4 que se produjo un ligero incremento en el tiempo de desintegración con la consecuente ligera disminución de la disolución, lo que pudo deberse al uso de lactosa como agente de relleno en vez de almidón de maíz, el empleo de croscarmelosa sódica como agente desintegrante solo intragranularmente y/o la adición de agentes lubricantes hidrófobos como el talco y el estearato de magnesio, lo cual provoca una disminución gradual de la humedad en las tabletas y por consiguiente, un ligero incremento de la resistencia mecánica de estas en el tiempo.
Summary
Reformulation of chlorpromazine hydrochloride tablets 25 mg
The reformulation of chlorpromazine hydrochloride 25 mg in the form of coated tablets was carried out. The technological process was designed from the making of the nuclei to the coating formulation in aqueous system that is feasible for its introduction at a pilot scale. The tablets obtained have a physical and chemical stability in the course of time and keep its potency within the therapeutic limits for 2 years.
Key words: Chlorpromazine, tablets, reformulation.
Referencias Bibliográficas
1. Drugs Facts and Comparison. St Louis: Facts and Comparisons Division; 1990. p. 1159.
2. Phisicians Desk Reference. 46 ed. New Jersey: Medical Economics Company; 1992. p. 1050.
3. The Merck Index. 11 ed. Rahway: Merck; 1989. p. 338.
4. The Pharmaceutical Codex. 11 ed. London: The Pharmaceutical Press; 1979. p. 184, 1013.
5. United States Pharmacopoeia. 23 ed. Rockville: Convention; 1995. p. 356.
6. Martindale W. The Complete Drug Reference. 32 ed. London: Pharmaceutical Press; 1999. p. 649-51.
7. USP DI. Drug Information. 13 ed. Rockville: Convention; 1993. p. 1121.
8. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. 7 ed. Buenos Aires: Médica Panamericana; 1998. p. 383, 393, 400.
9. British Pharmacopoeia. London: Her Majesty´s Stationery Office; 1993. p. 833. Vol 2.
10. Handbook of Pharmaceutical Excipients. London: High Street; 1990. p. 293.
Recibido:3 de enero de 2005. Aprobado: 31 de enero de 2005.
Lic. Iverlis Díaz Polanco. Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
Ave 26 No. 1605, entre Boyeros y Puentes Grandes, CP 10 600, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1Investigador Aspirante. Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
2Reserva Científica. CIDEM
3Investigador Auxiliar. Laboratorios MedSol.
4Investigador Agregado. CIDEM.
5Especialista A en Control de Medicamentos. CIDEM.