Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm v.39 n.2 Ciudad de la Habana Mayo-ago. 2005
Centro de Ingeniería Genética y Biotecnología
Establecimiento de un material de referencia para interferón gamma humano recombinante
Maribel Vega,1 Susset Valderrama,2 Galina Moya,1 Joel Ferrero,1 Mirta Castiñeira4 y Marisel Quintana5
Resumen
Se caracterizó el lote de interferón gamma utilizado como material de referencia por diferentes técnicas analíticas y se demostró mediante los diferentes análisis de varianza realizados para cada una de las técnicas ensayadas, que el lote cumple con lo aceptado para ser usado como material de referencia. El estudio de homogeneidad realizado por la técnica de cromatografía líquida de alta eficacia en fase reversa demostró que el material de referencia posee el grado de homogeneidad requerido para su uso. El lote es estable por 2 años a – 70 °C, según estudios previos realizados a los lotes de producción de materia prima activa de interferón gamma humano recombinante.
Palabras clave: Material de referencia, interferón gamma, material de referencia, material de referencia de trabajo.
El interferón gamma es una proteína producida por células T activadas y células NK que presentan entre sus diversas funciones propiedades antivirales y una función importante en la regulación de las infecciones bacterianas y procesos inflamatorios, entre otras.1-3 Esta proteína se producice en el Centro de Ingeniería Genética y Biotecnología (CIGB) por vía recombinante; se expresa en E. coli de forma insoluble4 y se emplea en la formulación del Heberon gamma R.
Los productos obtenidos por los actuales métodos de recombinación genética exigen la disponibilidad de materiales de referencia (MR) que le ofrezcan a los usuarios un medio para asegurar la precisión y veracidad de los métodos de medición que estos empleen, con el fin de garantizar un mejor control de la calidad de las producciones.5,6
El propósito de este trabajo es la preparación del MR para su uso en las técnicas de control de calidad del interferón gamma humano recombinante que se produce en el CIGB.
Métodos
Como material de origen para preparar el MR se utilizó un lote de producción de materia prima activa (IFA) de interferón gamma humano recombinante obtenido en el CIGB, evaluado por la Dirección de Calidad, el cual cumple con las especificaciones establecidas para este producto.
El material fue envasado en viales de cristal estériles a razón de 200 µL por vial para conformar el MR codificado como IFNG-01-0497. Al MR preparado se le realizaron estudios de caracterización y homogeneidad para evaluar la posibilidad de ser empleado en las técnicas de pureza por electroforesis y cromatografía líquida en fase reversa, así como en la determinación del contenido de contaminantes de E. coli.
Caracterización
El material se distribuyó en viales con volúmenes adecuados para las técnicas analíticas. Esto evita sucesivas congelaciones y descongelaciones que pudieran afectar los valores de las propiedades de interés.
Independientemente del uso al que será destinado el MR, para su caracterización el lote fue sometido a análisis diferentes:
- Pureza por electroforesis en gel de poliacrilamida (SDS-PAGE.7
- Pureza por cromatografía líquida de alta eficacia en fase reversa (RP-HPLC).8
- Determinación del contenido de contaminantes de E.coli por inmuno-dot.9
- Determinación de la concentración total de proteínas por el método de Lowry.10
- Determinación de la actividad antiviral por el método de inhibición del efecto citopatogénico. Para calibrar el ensayo, se empleó una preparación de referencia internacional (Gxg 01-902-535, del NIH; Instituto Nacional de Salud de los Estados Unidos).
Para cada análisis, diferentes viales fueron escogidos al azar y divididos en 2 porciones de ensayo antes de ser congelados.
En el caso de la electroforesis en gel de poliacrilamida (SDS-PAGE), el inmuno-dot y la actividad antiviral, fueron ensayadas 3 muestras con 2 determinaciones cada una. Para la determinación de la concentración total de proteínas se ensayaron 7 muestras. Las determinaciones de pureza por electroforesis en gel de poliacrilamida se realizaron en 2 laboratorios.
Se realizó un análisis de varianza de una sola vía para evaluar las diferentes fuentes de variación. En el caso de la concentración total de proteínas se evaluó la diferencia entre bulbos y para la electroforesis en gel de poliacrilamida, la diferencia entre ensayos y entre laboratorios.
Los resultados de la caracterización por RP-HPLC fueron empleados en el estudio de homogeneidad.
Homogeneidad
Este estudio se realizó en 5 viales, cada uno de los cuales se dividió en 2 porciones de ensayo para un total de 10 muestras que fueron analizadas por RP-HPLC. Los viales se muestrearon de forma sistemática durante la operación de llenado del lote.
Se seleccionó la técnica de RP-HPLC para realizar el estudio de homogeneidad ya que es más sensible, exacta y precisa dentro de las técnicas que se van a evaluar, lo que garantiza la homogeneidad entre esta y el resto de las técnicas analíticas.11,12
El diseño del experimento se basó en determinar la pureza de las diferentes porciones, que fueron ordenadas aleatoriamente para el análisis. Se evaluó la variabilidad entre viales mediante un análisis de varianza (ANOVA), con el empleo del estadígrafo F de Fischer.
Estabilidad
Se realizó un estudio de estabilidad acelerado para el cual se sometieron diferentes muestras del MR a 37, 45, y 58 ºC hasta 30 días. Luego del calentamiento se evaluó la actividad biológica de las muestras tomando como referencia una de ellas que no fue sometida al tratamiento térmico. Con los valores relativos de actividad biológica se predice la pérdida de actividad que puede sufrir el material en condiciones de refrigeración.
Métodos de ensayo
Pureza por electroforesis en gel de poliacrilamida (SDS-PAGE). Se realizó en geles de poliacrilamida al 12,5 % en presencia de SDS. Las muestras se trataron con tampón de tratamiento calentándose durante 5 min a 75 °C. En todos los casos se aplicaron alrededor de 20 µg de proteína en geles que posteriormente se tiñeron con Coomassie y 10 µg de proteína en geles para la tinción con plata. La cantidad porcentual de cada especie en las muestras se determinó por densitometría a través del Imaging Densitometer Model GS-700 de la BIORAD y con la utilización del SoftWare Molecular Analyst.
Pureza por cromatografía líquida de alta eficacia en fase reversa (RP-HPLC). Se aplicaron 60 µg de cada muestra a una columna (Octyl, Baker, USA) de 4,6 x 100 mm, 5 µm, con un flujo de 0,8 mL/min.,con la utilización de un sistema HPLC Pharmacia. La elusión se realizó con un gradiente de acetonitrilo en presencia de ácido trifluoroacético del 15 al 60 % en 40 min. La detección fue a 226 nm.
Determinación del contenido de contaminantes de E. coli por inmuno-dot. Esta técnica permitió determinar las proteínas contaminantes de E. coli provenientes de la célula hospedera, mediante la semicuantificación de estas a través de la identificación inmunológica (dot-blot) con antisueros específicos dirigidos contra el patrón de estas proteínas provenientes de la célula hospedera.
Determinación de la concentración total de proteínas por el método de Lowry. El método empleado está basado en la reacción con el reactivo alcalino de Biuret, el cual tiene iones cúpricos, que forman un complejo con los enlaces peptídicos reduciendo el Cu2+ a Cu1+, en los sitios de acomplejación dentro de la molécula de proteína y la intensificación del color del complejo proteína-cobre, por residuos de tirosina y triptofano a azul-púrpura cuando el reactivo fenolado Folin-Ciocalteau (ácido fosfomolíbdico-fosfotungstico) es adicionado.
Determinación de la actividad antiviral por el método de inhibición del efecto citopatogénico. Este método se basa en la capacidad del interferón gamma recombinante para prevenir la infección y destrucción de células Hep-2 (carcinoma laríngeo humano, APCC No. ccL-23) por el virus Mengo, así como la multiplicación de dicho virus. La cuantificación se realizó mediante el método de absorción del colorante a las células. Se utilizó para la determinación de las unidades internacionales un material de referencia secundario de interferón gamma recombinante (L-1) con una actividad biológica de 11 825 UI/mL. Para asignarle las unidades a este material de referencia secundario, se utilizó un estándar internacional para interferón gamma recombinante (Gxg 01-902-535) con una potencia de 70 000 UI.
Resultados
Caracterización
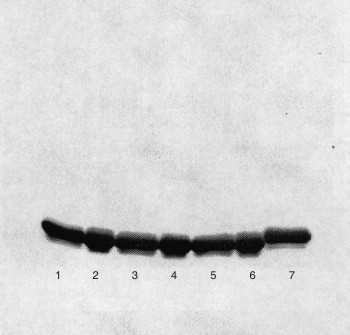
Para el análisis de los resultados de la pureza por la técnica de SDS-PAGE,se estudió primeramente la variación entre ensayos. Luego se analizó la variación entre laboratorios. En ambos casos se hizo un análisis de varianza de una vía; no hubo diferencias entre los 2 ensayos realizados por un laboratorio ni entre los laboratorios. El valor de la propiedad se calculó como la media aritmética de todos los resultados individuales; la pureza obtenida fue del 98,80 % con un intervalo de confianza entre el 97,89 y 99,71 %, para un nivel de significación de 0,05 (tabla ). El resultado del análisis de uno de los viales se presenta en la figura 1.
TABLA . Propiedades de interés y su incertidumbre
| Propiedad | Unidades | Valor | Incertidumbre | Método | |
| Límite bajo | Límite alto | ||||
| Conc. total de prot. | (mg/mL) | 0,912 | 0,888 | 0,937 | Lowry |
| Pureza | (%) | 98,80 | 97,89 | 99,71 | SDS-PAGE |
| Pureza | (%) | 99,08 | 98,97 | 99,19 | RP-HPLC |
| Actividad antiviral | (UI/mL) | 6,48 x 106 | 5,54 x 106 | 7,58 x 106 | Inhibición del efecto citopatogénico |
| Contaminantes de E. coli | (µg/mL) | £ 1,78 | Inmuno-dot | ||
Conc. total de prot. (método de Lowry): concentración total de proteínas; pureza (método SDS-PAGE): se refiere a la cantidad relativa proporción que representa la banda correspondiente al interferón gamma con respecto al resto de las bandas de la muestra, al evaluar el gel de poliacrilamida por densitometría; pureza (método RP-HPLC): se refiere a la cantidad relativa que representa el área bajo el pico correspondiente al interferón gamma con respecto al área total de las especies encontradas; actividad antiviral (método de inhibición del efecto citopatogénico): actividad antiviral de la preparación evaluada contra el MR. Internacional: Gxg 01-902-535, del NIH (Instituto Nacional de Salud de los Estados Unidos); contaminantes de E. coli (inmuno-dot): contaminantes provenientes de la cepa hospedera (E. coli) evaluados contra un patrón de trabajo de proteínas de esta cepa por un ensayo inmunoenzimático.
1, 3, y 5: muestras de IFNG-01-0497 reducidas con β-mercaptoetanol para el análisis por electroforesis; 2, 4, y 6: muestras de IFNG-01-0497 en condiciones no reducidas; 7: muestra del MR de IFN alfa, codificado como IFNα2-02-0294, en condiciones reducidas.
La banda correspondiente al MR de IFN gamma se encuentra a la altura de 18 kDa. Se puede comparar con la banda que corresponde al interferón alfa recombinante que tiene un peso molecular de 19 kDa.
FIG. 1. Análisis electroforético del MR codificado como IFNG-01-0497.
En el ensayo de determinación de proteínas contaminantes por inmuno-dot todos los bulbos analizados tuvieron £ de 1,78 μg/mL (tabla 1).
El valor de determinación de la concentración total de proteínas se calculó como la media aritmética de los 14 resultados individuales;esta fue de 0,912 mg/mL y los límites de confianza se encontraron entre 0,937 y 0,888 mg/mL13 para el 95 % de probabilidad de la media. (tabla 1).
El valor de la actividad antiviral se determinó como la media geométrica sopesada de las 6 determinaciones realizadas. El resultado obtenido es de 6.48 X 106 UI/mL y el intervalo de confianza de la media se extendió desde 5.54 X 106 hasta 7,58 X 106 UI/mL para un nivel de significación de 0,05 (tabla ). De acuerdo con los valores promedio de concentración de proteína y de actividad antiviral obtenidos para este MR, su actividad específica fue de 7,1 x 106 UI/mg.
El valor de pureza por RP-HPLC se calculó como la media aritmética de los 10 resultados individuales obtenidos; el valor de esta propiedad es del 99,08 % y los límites de confianza oscilan entre el 98,97 y 99,19 %14,15(tabla ).
Homogeneidad
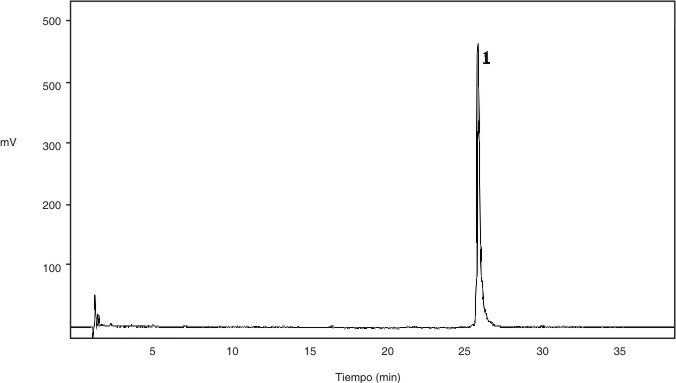
Se realizó un varianza de los resultados de pureza obtenidos mediante la técnica de RP-HPLC para evaluar las diferencias entre los viales. El perfil cromatográfico típico de las muestras ensayadas se muestra en la figura 2. No se encontraron tendencias de variación entre los viales en función del orden de llenado.
Pico 1: corresponde al IFN gamma recombinante.
FIG. 2. Perfil cromatográfico típico del MR codificado como IFNG-01-0497.
Estabilidad
La actividad biológica relativa de las muestras calentadas fue entre el 90 y 110 % de la actividad de la muestra de referencia, dado lo cual se considera que se mantienen estables en las diferentes condiciones de almacenamiento.
Discusión
En el estudio de caracterización por electroforesis, como no se encontraron diferencias significativas entre los 2 ensayos realizados por cada laboratorio ni entre los laboratorios, el valor de la propiedad se calculó como la media aritmética de todos los resultados individuales.
En resultado del ensayo de determinación de proteínas contaminantes por inmuno-dot demostró que es posible el empleo del material como control negativo en este análisis, ya que presenta un nivel inferior al que se acepta para el interferón gamma humano recombinante. El valor obtenido representa el 0,2 % de contaminantes y el límite de aceptación es del 0,8 % según lo establecido por la Dirección de Calidad.
No hubo diferencias significativas entre los bulbos en el caso de la determinación de la concentración total de proteínas. Aunque el MR no se emplea como tal en el ensayo de determinación de la concentración de proteínas, la caracterización por este método es necesaria para su uso en las restantes técnicas analíticas establecidas como control de calidad y otras que se realizan de modo experimental.
La actividad específica fue ligeramente inferior a la que se ha reportado para el interferón gamma humano recombinante en la literatura, que oscila entre 1 y 3 x 107 UI/mg.16-19 En ocasiones otras fuentes brindan otros rangos entre 0,5 y 2 x 107 UI/mg20 para este parámetro. La actividad específica obtenida para el MR se encuentra dentro del rango del valor histórico para los lotes producidos en el CIGB. Por esta razón y considerando que este MR no está destinado para ser utilizado para la técnica de determinación de actividad antiviral, es que se acepta su uso. La elevada pureza del MR avala su utilización en las técnicas cromatográficas y electroforética.
El estudio de homogeneidad se realiza para demostrar que no existe diferencia entre los viales que componen el MR. El muestreo sistemático utilizado para esta prueba ayudó a detectar las tendencias de variación en el lote. El análisis de varianza de los resultados de pureza obtenidos mediante la técnica de RP-HPLC demostró que no existen diferencias entre los viales. Esto unido a que no existe tendencia de variación entre los viales en función del orden de llenado, hace que se considere que el MR posee el grado de homogeneidad requerido para su uso.
En el estudio de estabilidad acelerado no se encontró afectación del material por el almacenamiento a temperaturas elevadas, lo cual indica su estabilidad. Debido a esto no se pudo hacer una predicción mediante la ecuación de Arrhenius. Sobre la base de estos resultados se declara que el MR presenta una adecuada estabilidad.
Según los resultados mostrados en este trabajo, el MR obtenido puede emplearse también en el establecimiento de un sistema ELISA para la cuantificación de interferón gamma. Además puede ser adaptado para su empleo en técnicas cuantitativas de determinación de contaminantes, por ejemplo, en la sustitución del inmuno-dot por un ensayo inmunoenzimático tipo ELISA.
Teniendo en cuenta los valores de cada propiedad, el grado de homogeneidad del material y los estudios de estabilidad realizados, se concluye que el MR preparado puede utilizarse para los análisis físico-químicos en el Control de Calidad de los lotes de interferón gamma humano recombinante producidos en el CIGB, lo que garantiza la liberación de los lotes de MPA.
Agradecimientos
Los autores de este trabajo agradecen a los compañeros Gustavo Furrazola y Rebeca Bouyon, quienes obtuvieron, en las instalaciones productivas del CIGB, el interferón gamma que se utilizó como material de partida para preparar el MR. Además, a los compañeros Makis Torres, Raudel Sosa y Marisol Cruz por la contribución realizada en la obtención de los resultados analíticos. El presente trabajo no hubiera sido posible sin el dedicado trabajo de todos ellos.
Summary
Establishment of a reference material for human recombinant gamma interferon
A production batch of human recombinant gamma interferon was characterized as reference material for different analytical techniques, and it was demonstrated by the different varianze analyses made for each of the assayed techniques that the batch fulfills the requirements to be used as reference material. The homogeneity study conducted by High Performance Liquid Chromatography technique in reverse phase showed that the reference material has the homogeneity required for its use. The batch is stable for 2 years stored at -70 °C, according to previous studies conducted in the production batches of active raw material of human recombinant gamma interferon.
Key words: Reference material, gamma interferon, working reference material.
Referencias Bibliográficas
1. Knop J. Immunologic effects of interferon. J Invest Dermatol. 1990;95:725-45.
2. Czarniecki CW, Sonnenfeld G. Interferon gamma and resistance to bacterial infections. APMIS. 1993;101:1-17.
3. Billiau A, Dijkmans R. Interferon gamma: Mechanism of action and therapeutic potentials. Biochem. Pharmacol. 1990;40:1433-9.
4. Pérez L, Vega JL, Chuay C, Menéndez A, Ubieta R, Montero M, et al. Production and characterization of human gamma interferon from E. coli. Appl Microbiol Biotechnol. 1990;33:429-34.
5. Federici MM, Garnick RL. A Perspective on Reference Standard and Reference Material Requirements in Biotechnology-derived Pharmaceutical Protein Products. Pharmacopeial Forum, 1991. p. 2683-7.
6. International Standard Organization. ISO-Guide 35. Certification of Reference Materials. General and Statistical Principles. 2nd ed. 1989.
7. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227:680-5.
8. Gómez A. BioCrom. Sistema automatizado de Cromatografía líquida (Manual de Usuario). Versión 2.1. 1992
9. Griego MG, Novoa LI, Estrada M, Santos A, Herrera L. Técnica de Inmunodot para proteínas insolubles. Memorias III Seminario Cubano e Internacional sobre Interferón, II Seminario Cubano e Internacional sobre Biotecnología y I Congreso Iberoamericano sobre Biotecnología, 1989, Abril 17-22, La Habana, Cuba.
10. Lowry OH, Rosebrough NJ, Farr AL. Randall RJ. Protein measurement with the Folin-Phenol reagent. J Biol Chem. 1951;193:265-75.
11. Setting Standards in Analytical Science. Guidelines for the In-House Production of Reference Materials. Version 2. 1998.
12. Susannah B. Schiller. Standard Reference Materials: Statistical Aspects of the Certification of Chemical Batch SRMs. NIST SPECIAL Publication. 1996. p. 260-5.
13. Marchandise H. New Reference Materials improvement of methods of measurement. Ed. Commission of the European Communities. Community Bureau of Reference; 1985. p. 81-6.
14. IUPAC. The International Harmonized Protocol for the Proficiency Testing of Chemical Analytical Laboratories (Technical Report). Pure Appl Chem 1993;9(65):2123-44.
15. Sigarroa, A. Biometría y diseño experimental. La Habana: Editorial Pueblo y Educación; 1985.
16. Van Schie Rob CAA, Verstraten RGG, Van de Winkel JGJ, Tax WJM, de Mulder PHM. Effect on recombinant IFN-Gamma (rIFN-γ) on the mechanism of human macrophage IgG FcRI- mediated cytotoxicity. J Immunol.1992;148(1):169-76.
17. Yan X, Wong JYC, Esteban JM, Kuhn JA, Beatty BG, Beatty JD, et al. Effect of recombinant human γ interferon on carcinoembryonic antigen expression of human colon cancer cells. J Inmunother. 1992;11:77-84.
18. Vlachoyiannopoulos PG, Tsifetaki N, Dimitriov I, Galaris D, Papiris SA., Moutsopoulos HM. Safety and efficacy of recombinant γ interferon in the treatment of systemic sclerosis. Ann Reum Dis. 1996;55:761-8.
19. Waschutza G, Li V, Schafer T, Schomburg D, Villmann C, Zakaria H and Otto B. Engineered disulfide bonds in recombinant human interferon-γ: The impact of the N-terminal helix A and the AB-loop on protein stability. Protein Engineering. 1996;9(10):905-12.
20. Wulfson AN, Tikhonov RV, Pechenov SE, Klyushnichenko VE, Miroshnikov AI. Methods of preparation of recombinant cytokine protein. II. An efficient method for Isolation, Purification and Renaturation of human recombinant g interferon. Russian J Biorganic Chem. 1997;23(9):653-8.
Recibido: 10 de febrero de 2005. Aprobado: 10 de marzo de 2005.
MC. Maribel Vega. Centro de Ingeniería Genética y Biotecnología. Ave. 31 entre 158 y 190, Cubanacán, municipio Playa, Apartado Postal 6162, CP 10 600, Ciudad de La Habana, Cuba.
1Master en Ciencias.
2Licenciada en Bioquímica. Investigadora Agregada.
3Doctora en Ciencias. Profesora Titular. Facultad de Farmacia y Alimentos, Universidad de la Habana.
4Doctora en Ciencias. Profesora Auxiliar.
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons