Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.40 n.2 Ciudad de la Habana Mayo-ago. 2006
Laboratorio Farmacéutico Líquidos Orales Bayamo
Validación de un método analítico para la determinación cuantitativa de parabenos en el gel de hidróxido de aluminio
Ernesto Benítez Hechavarría,1 Ciro Labrada Estrada,2 Enriqueta Martínez Martínez,3 Odalis Tamayo Fuentes3 y Esther Díaz Pérez3
Resumen
Se realizó la valoración prospectiva de un método desarrollado para la cuantificación de metil y de propil parabeno en el gel de hidróxido de aluminio mediante cromatografía líquida de alta resolución en fase reversa, con columna RP18 (25* 0,4 cm) y detector UV-Visible a 254 nm. Se evaluaron los parámetros especificidad, linealidad, precisión, exactitud, y adecuación cromatográfica. Los resultados obtenidos mostraron que el método cumple con las especificaciones establecidas para cada parámetro evaluado, lo cual indicó que es un método rápido, seguro y confiable para la determinación cuantitativa de los parabenos en este gel.
Palabras clave: Parabenos, cromatografía líquida de alta resolución (HPLC), suspensión.
El gel de hidróxido de aluminio es una suspensión de acción antiácida, absorbente y neutralizante; de administración por vía oral, usada en los casos de: hiperacidez gástrica, ulcera péptica y en caso de pirosis.1 Debido a su excelente actividad antimicrobiana y baja toxicidad,2 los ésteres del ácido 4-hidroxi-benzoico (parabenos), son usados como estabilizadores de esta suspensión1 donde se utiliza una mezcla de metil y de propil parabeno.
Las farmacopeas (BP,3 USP4) describen un método para la determinación cuantitativa de parabenos que consiste en una hidrólisis básica de estos seguido de una valoración potenciométrica del hidróxido de sodio residual. Este método no es específico para la cuantificación de parabenos en esta suspensión debido a que el alto contenido de hidróxido de aluminio presente en ella interfiere en los resultados. En el Laboratorio Líquidos Orales de Bayamo (MEDILIP) se ha desarrollado un método alternativo para la determinación cuantitativa de estos parabenos mediante cromatografía líquida de alta resolución en fase reversa (RP-HPLC). El presente trabajo se propone la validación prospectiva de dicho método sobre la base del criterio de clasificación reportado.5,6
Métodos
Cuantificación de parabenos por RP-HPLC
En un vaso de precipitado se pesaron 0,7 mL de gel de hidróxido de aluminio utilizando balanza analítica Sartorius (0,1 mg), se añadieron 15 mL de metanol absoluto para la precipitación de la carboximetil-celulosa (CMC). Luego se filtró al vacío a través de embudos filtrantes de porosidad 4 (DURAN) para la eliminación del precipitado de CMC y del hidróxido de aluminio (ambos insolubles en metanol). El filtrado se trasvasó a un matraz aforado de 25 mL y se completó a volumen con la solución utilizada como fase móvil en la RP-HPLC. De esta disolución se inyectaron 20 µL a una columna de fase reversa (KROMASIL 100 C18, 10 µm, 25 cm* 0,4 cm, precolumna C18) acoplada a un cromatógrafo líquido de alta resolución (KNAUER S martline) con detector UV-Vis a longitud de onda de 254 nm. Las separaciones se realizaron en sistema isocrático con fase móvil: metanol-H2 O-ácido acético (50:50:1) y un caudal de 1 mL/min; los resultados se procesaron en software ChromGate.7
Validación del método de cuantificación de parabenos por RP-HPLC5,6,8
Especificidad. Se realizó el procedimiento de cuantificación de parabenos por RP-HPLC a un placebo (formulación de gel de hidróxido de aluminio que no contenía parabenos) recién preparado y a placebos sometidos a los siguientes ensayos de degradación artificial: oxidación (por calentamiento a reflujo con gotas de H2 O2 50 % (m/v), durante 30 min), termólisis (por calentamiento a 80 ºC durante 8 h) e hidrólisis ácida y básica (por calentamiento a reflujo con soluciones de HCl 1 N y NaOH 1 N respectivamente, durante 15, 30 y 60 min). A partir del placebo se prepararon 2 soluciones, una de metil (A) y otra de propil parabeno (B), donde se adicionaron las cantidades reportadas para estos preservos en la formulación del Gel. A estas soluciones se les realizaron los mismos ensayos de degradación artificial indicados para el placebo y se procedió al análisis por RP-HPLC. También se prepararon soluciones puras de metil (C) y de propil parabeno (D) a la misma concentración que las anteriores para comparar las respuestas obtenidas. Se realizó una prueba de significación de t para determinar si existieron diferencias significativas entre estas respuestas.5,9 Los valores de t se compararon con el tabulado: ttab (p= 0,05; grados de libertad (g.l.) = n 1 + n2 - 2, n1 = 5, n2 = 5)= 2,306.
Linealidad. A partir del placebo se prepararon 7 soluciones de metil y de propil parabeno (incluyeron del 50 al 150 % de los valores reportados para estos preservos en el gel). A las soluciones preparadas se les realizó (por triplicado) el procedimiento para la cuantificación de parabenos descrito con anterioridad. Se determinaron los coeficientes de regresión lineal y de determinación.5 Para verificar la linealidad se determinaron los coeficientes de variación de los factores de respuesta (CvFR ) y de la pendiente de la línea de regresión (Cvb), también se determinaron los límites de confianza de esta pendiente donde t (p= 0,05; g.l.= n-2, n= 7)= 2,571.5 Se realizó un ensayo de proporcionalidad donde se determinaron los límites de confianza del intercepto en el eje de las ordenadas donde t (p= 0,05; g.l.= n-2, n= 7)= 2,571.5
Precisión. Para el ensayo de repetibilidad del método se tomó una muestra de gel de hidróxido de aluminio (lote de producción 05173) y se le realizó, 7 veces, el procedimiento descrito.5 Se determinó el valor promedio y el coeficiente de variación (Cv). Para la precisión intermedia: de las soluciones preparadas para el ensayo de linealidad se tomaron las correspondientes al 80, 100 y 120 % del valor declarado para cada uno de los parabenos en el gel.6 Dos analistas le realizaron la determinación de los parabenos a estas 3 soluciones donde cada determinación se realizó por triplicado. Todas estas determinaciones se repitieron en 3 días diferentes. Se determinaron los coeficientes de variación de los resultados obtenidos por cada analista. Se realizaron pruebas de significación de F y de t para determinar si existieron diferencias significativas entre la precisión y las medias obtenidas por los analistas, respectivamente.9 Los valores experimentales de F se compararon con el tabulado: F tab (p= 0,05; g.l.= n1 -1 y n2 - 1, n1 = 9, n2 = 9)= 3,45 y los de t se compararon con el tabulado: ttab (p= 0,05; g.l.=n1 + n2 - 2, n1 = 9, n2 = 9)= 2,12. Finalmente se calcularon los límites de confianza par cada valor de concentración 9, donde se utilizó t (p= 0,05; g.l.= n - 1, n= 18)= 2,11.
Exactitud. Para este estudio se utilizaron los resultados obtenidos en un día, por uno de los analistas, en el ensayo de precisión intermedia. Se realizó una prueba de significación t para determinar si la exactitud del método fue aceptable.6,9 Los resultados se expresaron en forma de porcentaje de recuperación y los valores experimentales de t se compararon con el tabulado: t (p= 0,05; g.l. =n - 1, n= 9)= 2,306. Se utilizó la prueba de Cochran de igualdad de varianzas para determinar si el factor concentración tiene influencia en los resultados 5. Los valores experimentales de G se compararon con el tabulado: G tab (p= 0,05; K= 3; n= 3 y g.l.= n - 2)= 0,797.
Parámetros de adecuación cromatográfica. Utilizando el software ChromGate7 se procesaron los cromatogramas obtenidos en Precisión: ensayo de repetibilidad del método calculándose los parámetros cromatográficos siguientes: resolución (R), altura equivalente del plato teórico reducida (HEPTred), capacidad (K) y factor de cola (T).
Para todas las preparaciones de metil (MP) y de propil parabeno (PP) se utilizaron estándares secundarios del Centro de Investigación y Desarrollo de Medicamentos (CIDEM): 05012 para MP y 03042 para PP, los cuales estuvieron referidos a estándares primarios USP. Todos los solventes y reactivos utilizados fueron de calidad HPLC. Los resultados obtenidos fueron evaluados estadísticamente con el auxilio del programa Microsoft Excel para Windows.
Resultados
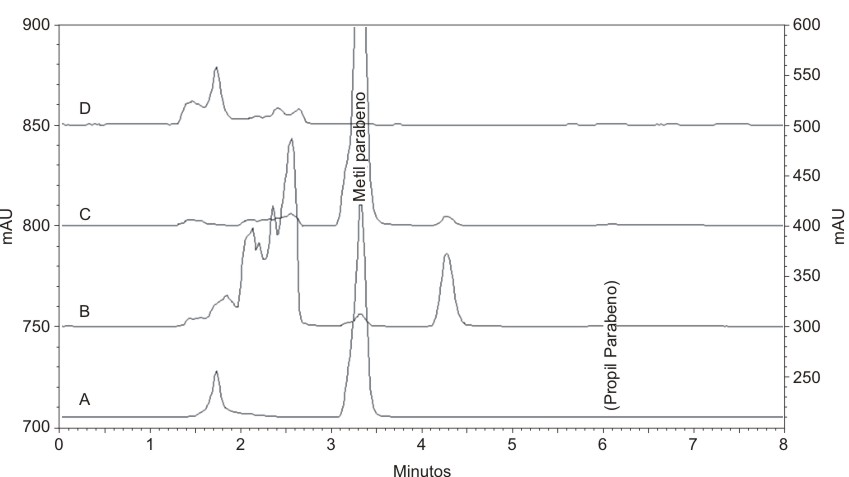
En el ensayo de la especificidad ni los placebos recién preparados ni los sometidos a ensayos de degradación artificial presentaron señal en las zonas del cromatograma correspondiente a los parabenos. Todos los ensayos de degradación artificial realizados a las soluciones A y B provocaron disminución en la concentración de metil y de propil parabeno y generación de diferentes productos de degradación. Ninguno de los productos de la degradación artificial de la solución A eluyó con un tiempo de retención igual o similar al correspondiente al pico de propil parabeno (fig. 1). De igual modo, los productos de la degradación de la solución B no presentaron señal en la zona del metil parabeno. No existieron diferencias significativas entre las concentraciones de metil parabeno de las soluciones A y C y las de propil parabeno de las soluciones C y D. En ambos casos los valores de t experimental (0,73 y 0,65) fueron menores que el tabulado.
Solución A sometida a: oxidación (A); hidrólisis básica por 15 min (B); hidrólisis ácida por 60 min (C); placebo sometido a termólisis (D). Nótese cuan susceptible es el metil parabeno a ser degrado por hidrólisis básica y la ausencia de señal en la zona correspondiente al propil parabeno en A, B, C.
Fig. 1. Cromatogramas de varios ensayos de degradación artificial del estudio de la especificidad.
En las tablas 1, 2 y 3 se resumen los resultados de los ensayos de la linealidad, la precisión y la exactitud respectivamente. En la tabla 4 se muestran los parámetros cromatográficos obtenidos.
Tabla 1. Linealidad del método cromatográfico
|
| MP | PP |
| Rango Lineal (mg/mL ) | 0,6-2,7 | 0,5-1,6 |
| Curva de regresión | Y= 3 169 883 X + 27971 | Y=2 764 962 X + 41144 |
| Coeficiente de correlación, r | 0,9985 | 0,9991 |
| Coeficiente de determinación, r2 | 0,9970 | 0,9982 |
| Coeficientes de variación de los factores de respuesta, CvFR | 2,0880 | 1,8061 |
| Desviación típica de la pendiente, Sb | 78 238 | 52 310 |
| Coeficiente de variación de la pendiente, Cvb | 2,4682 | 1,8919 |
| Intervalo de confianza de la pendiente, b ± ttab Sb | 3 169 883 ± 157650 | 2 764 962 ± 105 405 |
| Desviación típica del intercepto, Sa | 112 105 | 57 664 |
| Intervalo de confianza del intercepto, a ± ttab Sa | 27 971 ± 225 893 | 41 144 ± 116 192 |
Tabla 2. Precisión del método cromatográfico
|
| Repetibilidad |
| Precisión intermedia | ||||||
| (Lote 05173) | 80 % | 100 % | 120 % | ||||||
| Ensayo o criterio | MP | PP | MP | PP | MP | PP | MP | PP | |
| CP (mg/mL) | 1,80 | 1,01 | 1- | 1,43 | 0,79 0,80 | 1,84 1,85 | 1,03 1.00 | 2,22 2,24 | 1,25 1,25 |
| Cv | 0,98 | 1,17 | 1- | 1,44 | 2,02 1,94 | 1,59 1,62 | 1,80 1,60 | 1,68 1,57 | 1,80 1,87 |
| F (calculado) | - | - |
| 1,18 | 1,10 | 1,03 | 1,27 | 1,12 | 1,03 |
| t (calculado) | - | - |
| 2,09 | 0,39 | 0,32 | 1,01 | 0,74 | 0,59 |
| Límites de confianza (mg/mL) |
|
|
| 1,43± 0,02 | 0,80 ± 0,01 | 1,82 ± 0,02 | 1,02 ± 0,01 | 2,20 ± 0,02 | 1,22± 0,01 |
CP: concentración promedio; 1: analista 1; 2: analista 2.
Tabla 3. Exactitud del método cromatográfico
| Criterio | MP | PP |
| Rango estudiado | 80-120 | 80-120 |
| Promedio (%) | 100,8 | 101,44 |
| Cv | 1,33 | 1,63 |
| t calculado | 1,89 | 1,38 |
| G calculado | 0,55 | 0,45 |
Tabla 4. Parámetros cromatográficos
| Parámetro | MP | PP |
| R (entre MP-PP) | 10,32 | 10,32 |
| T | 1,08 | 1,17 |
| HEPTred | 4,9 | 4,5 |
| K | 2,3 | 5 |
Discusión
Los resultados del ensayo de especificidad indican que los componentes presentes en el placebo no interfieren en la determinación de los parabenos. De igual modo, y dada la variedad de ensayos de degradación artificial realizados al placebo, parece indicar que los productos de la degradación de los componentes del placebo tampoco interfieren en la cuantificación de estos preservantes; nótese en la figura 1 (D) la ausencia de señal en las zonas correspondientes a los parabenos. Por otro lado, los productos de la degradación del metil (fig. 1) y del propil parabeno no son interferencias para la cuantificación de estos parabenos por el método propuesto. Finalmente, las concentraciones de los parabenos en el placebo (soluciones A y B) fueron concordantes con las concentraciones de las soluciones puras de parabenos (C y D), lo cual corrobora que los componentes del placebo no interfieren en la cuantificación de los parabenos.
Los resultados del estudio de linealidad (tabla 1) muestran, para ambos preservantes, coeficientes de regresión y de determinación superiores a los exigidos:8 0,99 y 0,98 respectivamente; también para ambos los CvFR y los Cvb fueron inferiores al normado como máximo para estos indicadores: 5 %.8 El intervalo de confianza del intercepto incluye al cero, lo que permite excluir la significación del error del intercepto.5
En el ensayo de precisión, tanto en la repetibilidad como en la precisión intermedia, los valores de Cv no excedieron el valor límite permitido de 2 %.8 Los cocientes repetibilidad/precisión intermedia se encontraron comprendidos, para ambos parabenos, dentro del rango establecido:10 1,5-2. En la precisión intermedia l os valores calculados de F fueron inferiores al tabulado, esto indica que existió homocidasticidad entre los resultados obtenidos por ambos analistas. Tampoco existieron diferencias significativas entre las medias obtenidas por estos analistas para ninguna concentración (en todos los casos los valores de t calculados fueron inferiores al tabulado no encontrándose ninguno en la región de rechazo de la hipótesis nula que plantea la igualdad entre las medias). Por último, se presentaron los intervalos dentro de los cuales se encontraron los valores verdaderos de cada concentración (límites de confianza), con una certeza del 95 %.
En el estudio de exactitud el valor de t experimental fue menor que el tabulado lo que señala que el método es exacto, con una certeza del 95 %, para la cuantificación de ambos parabenos y que no existieron desviaciones por exceso o por defecto. Tampoco el factor concentración influyó en la variabilidad de los resultados pues los valores de Gexp (tabla 3) fueron menores que el tabulado.
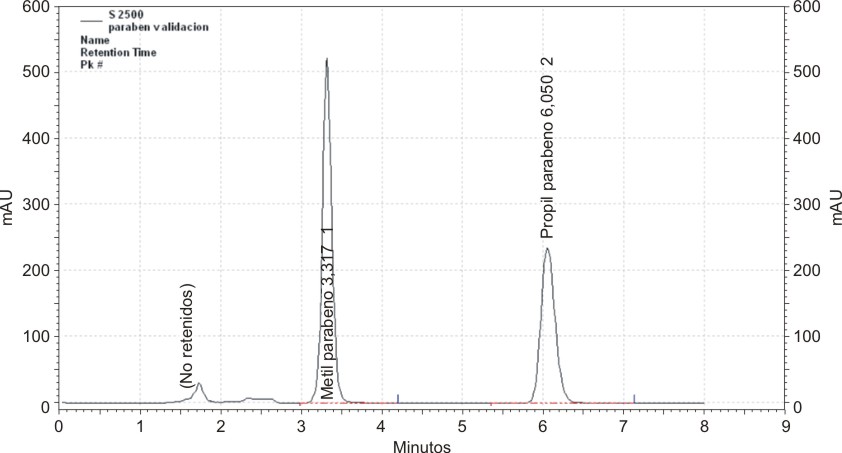
El objetivo primario de la cromatografía es la separación de los componentes de una mezcla y el grado de separación se mide por la resolución; esta, entre dos picos, debe ser superior a 1,5 10 para una completa separación de los mismos. En el ensayo de adecuación cromatográfica (tabla 4), el valor de resolución entre el MP y el PP estuvo muy por encima de este valor, obteniéndose ambos compuestos bien separados (fig. 2). También los valores de K fueron apropiados, encontrándose dentro de los límites recomendados (entre 2 y 6) para sistemas simples.10 Por otra parte, para obtener resultados cuantitativamente válidos es necesario trabajar sobre picos simétricos y el factor de cola es una medida de esta simetría. Los picos de ambos parabenos resultaron simétricos ya que presentaron valores de T (tabla 4) dentro del intervalo considerado normal: 0,85-1,5.10 Finalmente la eficiencia de la columna fue aceptable pues los valores de HEPT red se encontraron dentro de 4 y 5 veces el diámetro de partícula del material de relleno de la columna.10
FIG. 2. Corrida cromatográfica tipo del ensayo de repetibilidad.
Según los resultados obtenidos, el método desarrollado para la cuantificación de parabenos por RP-HPLC es válido, en el intervalo analizado, para obtener resultados seguros y confiables. Así lo demuestran los ensayos de especificidad, linealidad, precisión, exactitud, y adecuación cromatográfica realizados. Es un método sencillo y rápido (corrida cromatográfica de 8 min) que puede ser aplicado para el control rutinario de la calidad de este medicamento.
Summary
Validation of an analytical method for the quantitative determination of parabens in aluminum hydroxide gel
The prospective assessment of a method developed for the quantification of methyl/propyl paraben in aluminum hydroxide gel by reverse-stage high resolution liquid chromatography on RP18 column (25*0.4 cm), and with UV detector visible at 254 nm, was made. The specificity, lineality, accuracy, exactness and chromatographic adequacy were evaluated The results obtained showed that the method meets the specifications established for each evaluated parameter, which indicates that it is a rapid, safe and reliable method for the quantitative determination of the parabens in this gel.
Key words: Parabens, high resolution liquid chromatography (HRLC), suspension.
Referencias bibliográficas
1. Norma Cubana NC 26/25. Comité Estatal de Normalización. Ministerio de Salud Pública, La Habana, noviembre, 1981. p. 1-18.
2. Haag T, Lancrini DF. Esters of para-hidroxibenzoic acid. Cosmet Sci Technol Ser. 1984; 1:63-77.
3. British Pharmacopoeia. Versión 4.0 en CD-Rom. 2000.
4. United States Pharmacopoeia USP XXVII. Pharmacopoeial Forum. 2004;29(5):1599-600.
5. Norma Cubana NC proyecto 2001. Guía para la validación de métodos de ensayos químicos para alimentos. Ministerio de Salud Pública, La Habana, junio, 2001. p. 1-23.
6. United States Pharmacopeial Convention. USP XXIII. Validation of compendial methods. 23 ed. Rockville : Mack Printing; 1995. p. 1982-4.
7. Knauer H, editor. ChromGate Reference Manual. Revision 3.1. Berlin : Advanced Scientific Instrument; 2003.
8. Calpena AC, Escribano E, Fernández C. Validación de los métodos analíticos. Farm Clin. 1990;7(9):749-58.
9. Sigarroa A. Biometría y diseño experimental. La Habana: Editorial Pueblo y Revolución; 1985. p. 192-209.
10. Quattrocchi OA, Abelaira de Andrizzi SI, Laba RF. Introducción a la HPLC, Aplicación y práctica. Buenos Aires: Artes Gráficas Farro SA; 1992. p. 298-327.
Recibido: 22 de diciembre de 2005. Aprobado: 30 de enero de 2006.
M. Ernesto Benítez Hechavarría. Edif. 37 apto. 7, Jesús Menéndez, Bayamo, Granma, Cuba.
1Master en Bioquímica de las Proteínas y Biotecnología.
2Especialista en Ensayos Físico-químicos y Mecánicos.
3Especialista en Metrología, Normación y Control de la Calidad.