My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515On-line version ISSN 1561-2988
Rev Cubana Farm vol.41 no.2 Ciudad de la Habana May-Aug. 2007
Instituto de Farmacia y Alimentos, Universidad de La Habana
La eritropoyetina un neuroprotector potencial
Alain Valdivia Acosta1 y Gregorio Martínez Sánchez2
Resumen
La importante función fisiológica de la hormona eritropoyetina en el proceso eritropoyético se descubrió hace alrededor de un siglo. Mas recientemente se ha trabajado en su obtención por vía recombinante para su aplicación en pacientes con anemias agudas o crónicas, causadas por diferentes afecciones. Esta terapia mejora, sin lugar a duda, la calidad de vida de estos pacientes. A partir del año 1998, se reportaron por primera vez las propiedades neuroprotectoras de la eritropoyetina y se realizaron estudios que así lo corroboraron con el empleo de modelos de daño cerebral, tanto in vitro como in vivo. Los estudios actuales consisten en dilucidar a profundidad los mecanismos de acción por los cuales la eritropoyetina muestra sus propiedades neuroprotectoras y en obtener una adecuada biodisponibildad de la molécula para su aplicación segura en la terapéutica de afecciones del cerebro. El presente trabajo recopila información actualizada sobre la eritropoyetina como agente neuroprotector y refiere la continuidad de estudios para su aplicación en la clínica.
Palabras clave: Daño cerebral, eritropoyetina, neuroprotector, clínica.
Ha transcurrido un siglo desde que Carnot y Deflandre1 postularon que un factor humoral que ellos llamaron “hemopoietine”, regulaba la producción de células rojas de la sangre. Sus primeros estudios fueron realizados en conejos. A partir de aquí, varios investigadores confirmaron los experimentos de Carnot y Deflandre.1 Paulatinamente se fueron realizando de forma continuada un gran número de investigaciones encaminadas al estudio de la localización de los sitios anatómicos de producción, factores que influyen directamente en su síntesis, separación, purificación, obtención, y posibles usos terapéuticos de este factor.1
La historia del descubrimiento y caracterización de este factor posteriormente denominado “eritropoyetina” (Ep), ha sido resumida por Fisher.1 El aislamiento, la purificación y el conocimiento de la secuencia aminoacídica de la molécula de la Ep facilitó la identificación del gen responsable de su síntesis. El gen de la Ep humana está presente como una copia simple en el cromosoma 7, en la región q-11 y q-22 del genoma humano. Este gen posee 5 intrones y 4 exones, y codifica una proteína de 193 aminoácidos, de los cuales 27 representan la secuencia hidrofóbica líder, y los 166 restantes, la proteína madura.2 Existe una homología entre el gen de la Ep del mono (90 %) y del ratón (80 %) con el gen humano.1,2
Actualmente, se conoce que la Ep es una hormona de estructura glicoproteica de 34 kDa y constituye un factor de crecimiento hematopoyético que se encuentra involucrado en la proliferación, diferenciación y maduración de los eritrocitos y otras células hematopoyéticas,2 mediante la unión con receptores específicos de membrana en la médula ósea. Desempeña una importante función en la regulación del número de eritrocitos, lo cual influye en la capacidad de transportar oxígeno a los tejidos.3
En adultos, el riñón es la principal fuente de producción de la Ep sistémica, aunque también existen otros sitios extrarrenales de producción de la Ep, como el útero, el hígado fetal y adulto –este último con un menor porcentaje de producción– y más recientemente, el cerebro.4
El principal estímulo que incrementa la producción de la Ep es el bajo contenido de oxígeno en los tejidos (hipoxia). Este efecto es regulado, en parte, por el factor-1 inducible por hipoxia (HIF-1α),1,5,6 que estimula la síntesis de la Ep.1,7
El presente artículo tiene como objetivo, ofrecer una revisión actualizada sobre la Ep como extraordinario agente neuroprotector en el campo preclínico y resaltar la continuidad de estudios para evaluar su nueva propiedad en la clínica.
La búsqueda y localización de la información incluyó una revisión de artículos científicos en la Base Datos MEDLINE, entre los años 2000-2006, con la utilización de los descriptores: daño cerebral, eritropoyetina, neuroproteción. A partir de los resúmenes de los artículos más significativos se procedió a localizar las fuentes de información primaria (artículos originales). La búsqueda bibliográfica incluyó artículos científicos de revisión y de resultados experimentales. Algunos artículos seleccionados estaban relacionados con los conocidos antecedentes de la Ep y el resto mayoritariamente, con evidencias preclínicas de las nuevas propiedades neuroprotectoras de esta, hasta ahora estudiadas.
Aplicaciones de la eritropoyetina en la clínica
La disminución de la producción de la Ep por el riñón en pacientes con insuficiencia renal terminal o pacientes con enfermedades crónicas que comprometan la producción de la Ep, puede derivar en anemia.8 La introducción de la Ep humana recombinante (rHuEp) en la clínica ha proporcionado un gran avance en el tratamiento seguro y eficaz de pacientes con anemia y falla renal.9,10
La rHuEp evita efectivamente las transfusiones de sangre y mejora la calidad de vida en pacientes que requieren diálisis.10 En pacientes con cáncer, la Ep reduce el riesgo de transfusiones de sangre y el número de unidades transfundidas.11,12 Es utilizada también para el tratamiento de anemias en infantes prematuros13 y en pacientes anémicos, infectados con el VIH-SIDA, debido al tratamiento con Zidovudina.9
A todas las evidencias anteriores que demuestran la importante función de la Ep en el proceso de hematopoyesis y su aplicación para tratar múltiples afecciones, se puede añadir el reciente descubrimiento del potencial neuroprotector de esta hormona y su influencia en el neurodesarrollo, el cual ha ampliado y abierto nuevos caminos terapéuticos en el tratamiento de diversas enfermedades cerebrales. Prácticamente todas las células del cerebro son capaces de producir, liberar y expresar la Ep y su receptor (Epr),10 frente a un daño cerebral.
En 1998, se reportan por primera vez las propiedades neuroprotectoras de la rHuEp frente al daño isquémico in vivo.14 El desarrollo de estudios del efecto neuroprotector de la Ep en diferentes modelos de isquemia cerebral,15,16 se ha visto estimulado por la observación de que la Ep/Epr son expresados en el cerebro y regulados por el HIF-1α, el cual estimula la síntesis de la Ep17 y es activado por una amplia variedad de generadores de estrés, incluida la hipoxia.
La presencia de la Ep/Epr durante el desarrollo del cerebro y en el cerebro maduro, indica que desempeñan una función fundamental en el neurodesarrollo y la homeostasis cerebral.4 Por otra parte, varias investigaciones demuestran que la Ep también actúa en el sistema nervioso central (SNC) como un factor neurotrófico4,14,18 e influye en la liberación (por estimulación o inhibición) de neurotransmisores.4,14 Queda probada así su importancia en la plasticidad sináptica en el cerebro adulto y su posible utilidad en el tratamiento de enfermedades crónicas.19
Sitios de producción y expresión de Ep/Epr extra e intracerebral
Se conoce que las células productoras de la Ep en el riñón son las células intersticiales peritubulares localizadas por fuera de la membrana basal de los túbulos renales, específicamente en la corteza renal y la parte más externa de la médula renal.1,2 El ARNm nuclear correspondiente a la Ep en las células peritubulares, se incrementa de forma marcada, rápida y proporcional, por el estímulo anémico hipóxico aplicado. Otros estudios refieren otras células renales como posibles sitios de elaboración de la Ep: células glomerulares, epiteliales, tubulares, mesangiales en los glomérulos, y otras.2 Por otro lado, han sido encontrados receptores funcionales para la Ep en líneas celulares sanguíneas no eritroides, como células mieloides, linfoides y megakariocitos.4
En cuanto a los sitios de expresión extra-renal de la Ep, se ha demostrado en pacientes anéfricos y en varios animales de experimentación con nefrectomía bilateral total, que existe un bajo porcentaje de producción de la Ep: entre un 10-15 % de la producción normal.2 El hígado es el órgano principal en la producción extra-renal de la Ep.2 Durante la vida fetal es el principal órgano de producción de la Ep, capacidad que se conserva en la vida adulta, pero solo se pone de manifiesto ante la falta de producción renal. La producción de la Ep ha sido también demostrada en algunos extractos de tejidos, particularmente extractos de glándulas submaxilares2 y sus receptores en células no hematopoyéticas, como células endoteliales, mesangiales, del miocardio y células de fibras musculares lisas y de origen neural.1 En útero y cerebro, la expresión de la Ep parece estar regulada de una manera específica.4
La observación de que la Ep/Epr están expresados en tejidos cerebrales de roedores y humanos,18,20,21 en neuronas cultivadas,10,18 astrocitos,10 oligodendrocitos,22 microglia23 y células endoteliales,10,14,21 evidencia no solo la importante función de la Ep en el SNC, sino que cumple también funciones biológicas más allá de la hematopoyesis.24,25
El hecho de que la Ep sea producida por estas células y se establezca el enlace a su receptor en células adyacentes, indica que la Ep puede afectar neuronas de un modo paracrino y autocrino, independientemente del sistema eritropoyético. Los receptores de la Ep se expresan en el cerebro de los ratones en estado embrionario y en el cordón espinal10,26-28 del SNC humano en desarrollo.10 Además, la Ep fue detectada en el fluido cerebro-espinal humano de adultos29 y neonatos.30
La expresión de la Ep/Epr cambia de forma notable según las diferentes etapas del desarrollo cerebral: su producción en el SNC humano se eleva durante la gestación y disminuye después del parto.18 En el cerebro adulto normal la expresión de la Ep/Epr es baja,4,21 pero una vez que existe un daño de tipo isquémico en el SNC, la expresión es significativamente alta.18
La Ep es inducible también por hipoxia en el SNC,4,10,18 similar a su regulación fuera de él. Otras alteraciones metabólicas como la hipoglicemia o una fuerte despolarización neuronal, que generan especies reactivas de oxígeno mitocondriales, incrementan la expresión de la Ep por medio del HIF-1α.1 Todos estos estudios han fomentado la investigación de los mecanismos reguladores de la expresión de la Ep/Epr y sus implicaciones en la función fisiológica del cerebro.
Propiedades y función fisiológica del sistema Ep/Epr en el cerebro
Recientemente se han realizado varios estudios con la finalidad de esclarecer el impacto de la expresión de la Ep/Epr en el cerebro durante la vida fetal y adulta.14 La expresión del sistema Ep/Epr varía de manera significativa durante el desarrollo del cerebro: de forma creciente en sus inicios a diferencia de las etapas finales, en las que disminuye. Ello indica la importancia de este sistema en el neurodesarrollo y la hematopoyesis cerebral.4
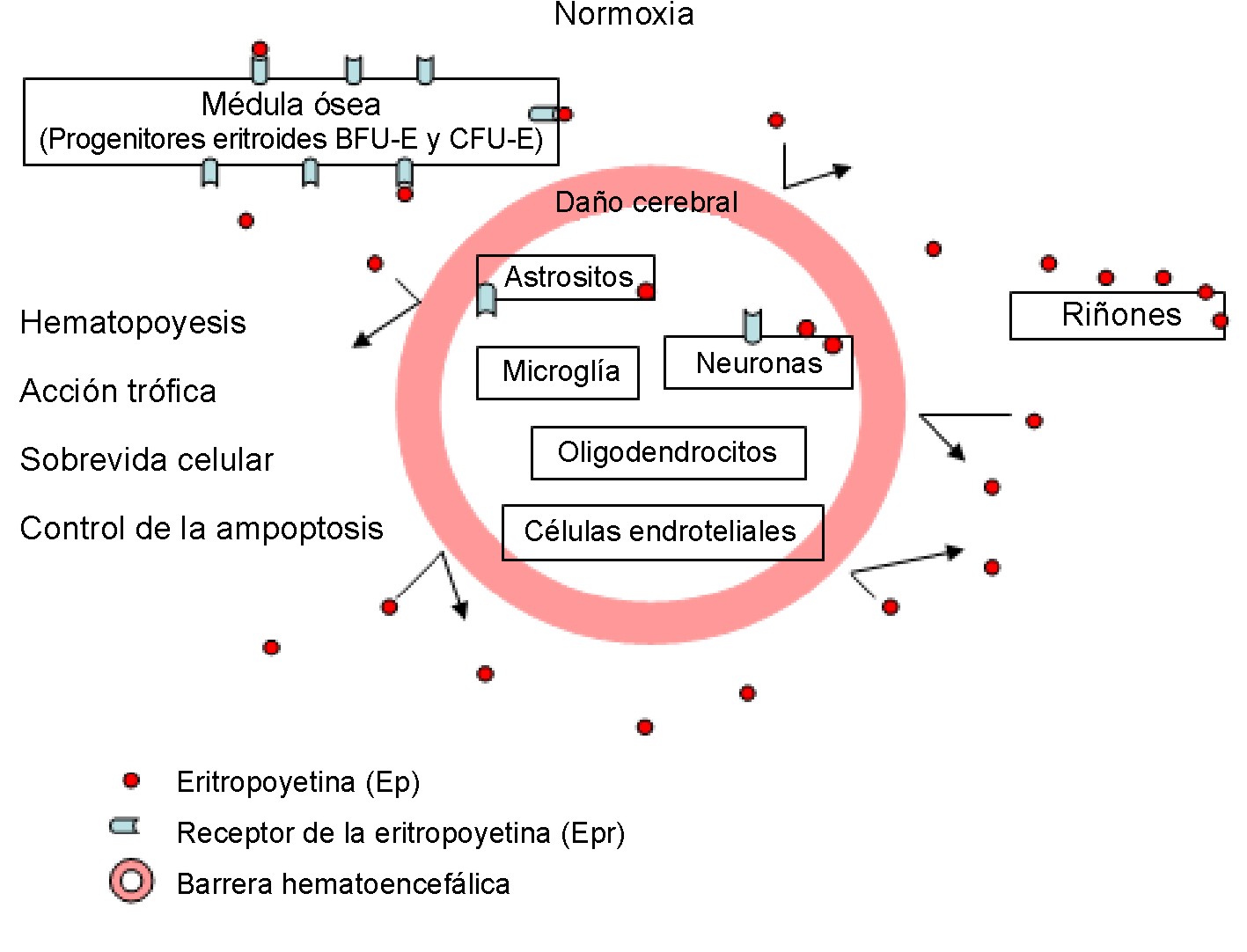
En el cerebro adulto normal la débil inmunoreactividad de la Ep y su receptor; o sea, su expresión basal, es fundamentalmente neuronal y astrocítica21 (fig. 1), que comparada con la expresión de la Ep/Epr durante el cerebro en desarrollo o frente a condiciones hipóxicas, prácticamente no es de destacar. Luego de un amplio daño isquémico agudo del cerebro adulto humano, la expresión del receptor del Epr está sobre-expresada en las células endoteliales cerebrales, neuronas y astrositos, y se mantiene elevada en la glía reactiva de infartos isquémicos más antiguos (18 días después del infarto).18
Fig. 1. Papel fisiológico de la Ep.
Por otra parte, la producción y expresión de la Ep/Epr en respuesta a la hipoxia muestran que pueden actuar como un factor neurotrófico4,14,31 y neuroprotector15,32,33 después de un daño cerebral. Finalmente, la liberación de neurotransmisores por la Ep inducida, indica que la hormona puede influir directamente o indirectamente en la neurotransmisión, lo cual constituye una prueba de su importancia en la plasticidad sináptica (fig. 2).4,14,34
Fig. 2. Función de la Ep frente a un daño cerebral de tipo isquémico.
Neuroprotección
La neuroprotección involucra mecanismos mediante los cuales se induce un intento por mantener la más alta integridad posible de interacciones celulares en el cerebro; o sea, la protección de la función neural.35 La neuroprotección es un propósito esencial en el tratamiento de condiciones neurológicas agudas: daño isquémico y neurotrauma, así como en enfermedades neuroinflamatorias y neurodegenerativas. Existen muchos reportes recientes donde se señala que la Ep protege frente a un daño neurológico en varios modelos experimentales tanto in vitro como in vivo.19
Efectos neuroprotectores de la eritropoyetina en modelos in vitro
Se ha demostrado que la Ep protege a las células neuronales de estímulos nocivos: por ejemplo, la hipoxia (< 1 % O2 15 h de exposición).10,36 Protege las células del hipocampo y las neuronas corticales en cultivo, de la toxicidad del glutamato,10,14 así como a las neuronas del hipocampo en cultivo, de la muerte inducida por hipoxia. También inhibe la apoptosis de neuronas cultivadas, inducida por ácido kainico.31
Además, la Ep atenúa el daño neuronal causado por hipoxia química (inducida por rotenona y 2-deoxiglucosa) a concentraciones más bajas que lo considerado previamente.37 En fecha reciente, se ha reportado que la Ep protege las neuronas cerebro-corticales del daño inducido por la proteína viral gp-120 del virus de la inmunodeficiencia humana (VIH/gp120).38 Por otra parte, ha sido demostrado que la Ep promueve la maduración y diferenciación de oligodendrocitos y la proliferación de astrocitos in vitro,22 lo cual podría garantizar de forma indirecta la neuroprotección por el aumento de la probabilidad de expresión del sistema Ep/Epr. También se ha comprobado que este es un sistema endógeno que puede proteger a las células del cerebro de un daño causado por episodios intermitentes de hipoxia (pre-condicionamiento isquémico). Igualmente, ha sido probado que en modelos de pre-condicionamiento isquémico in vitro, la liberación de la Ep por inducción de hipoxia en los astrocitos, inhibe la apoptosis en neuronas.39
Efectos neuroprotectores de la eritropoyetina en modelos in vivo
La Ep tiene efectos neuroprotectores en modelos experimentales in vivo que incluyen la isquemia cerebral inducida por diferentes vías: trauma, encefalitis autoinmune experimental y excitotoxicidad cerebral. Esta hormona previno el daño letal isquémico en un modelo de isquemia global en Gerbil, donde la Ep fue administrada de forma directa en el ventrículo lateral. La microscopia electrónica mostró un incremento en el número de sinapsis en la región CA1 del hipocampo, comparado con el grupo control.14 Asimismo, la inyección intracerebro-ventricular de la Ep ofreció una significativa protección del tejido neuronal en un modelo de isquemia cerebral focal en ratones y ratas.10,14
El efecto protector de la Ep en modelos de isquemia cerebral se confirmó más tarde en varios estudios in vivo.14,29 La administración sistémica de la Ep (5 000 U/kg= 42 μg/kg, intraperitoneal) redujo considerablemente el volumen de infarto por oclusión de la arteria cerebral media en ratas.29 Se ha demostrado también que la Ep contribuye a la reducción del daño isquémico en modelos in vivo de isquemia o pre-condicionamiento hipóxico.39,40-43
El efecto neuroprotector de la Ep durante la isquemia y sus efectos sobre la supervivencia de neuronas colinérgicas y liberación de dopamina conduce a la hipótesis de que la Ep puede tener efectos beneficiosos en la enfermedad de Parkinson. Los resultados con respecto a los efectos beneficiosos de la Ep en un modelo experimental de Parkinson en ratones, evidenciaron un mejoramiento en la actividad locomotora, que contrarresta la pérdida de neuronas dopaminérgicas.44
Los efectos beneficiosos de la Ep han sido observados en modelos animales de hemorragia subaracnoidea,10,45 hemorragia intracerebral,46 daño cerebral traumático39,47-49 y daño en el cordón espinal.50,51 Además, la Ep reduce el daño neuronal y mejora la función cerebral en modelos animales, de esclerosis múltiple,39,52-54 neuropatía diabética,55 isquemia retinal32,33,56 y epilepsia.39 Adicionalmente la Ep ejerció un efecto antiinflamatorio en un modelo experimental de encefalomielitis autoinmune por retardo en el incremento de las citocinas proinflamatorias: factor de necrosis tumoral (TNF) y IL-6.57
Como consecuencia de todos los estudios realizados y sus efectos, ya probados, la Ep es candidata a cumplir con los requisitos que se postulan para un neuroprotector ideal:58
- Actuar por mecanismos múltiples
- Elevado acceso al SNC por una ruta de administración no invasiva
- Ventana terapéutica de entre 4h a 12 h después de la isquemia
- Baja incidencia de efectos secundarios
- No interacción con anti-trombolíticos
- No Interacción con otros neuroprotectores
- No manifestar neurotoxicidad
En la actualidad, los mecanismos de acción de la Ep en relación con sus efectos neuroprotectores no están totalmente esclarecidos. Existen varias evidencias que apuntan a estos efectos y muchas han sido las teorías propuestas con el objetivo de dilucidar su mecanismo de acción. El efecto protector de la Ep o variantes con actividad neuroprotectora y no hematopoyética reclama de estudios de seguridad, dosis óptima, ventana terapéutica, toxicidad y duración del tratamiento.
Agradecimientos
Agradecemos a los profesores del Diplomado: Balance antioxidante pro-oxidante/ salud y enfermedad, del Instituto de Farmacia y Alimentos de la Universidad de La Habana por su contribución a nuestra formación y a sus orientaciones en la confección del presente trabajo. Agradecemos al M.C. Michel García del CEIEB y a la Lic. Zuzel López, editora de Casa de las Américas la revisión crítica del manuscrito y sus orientaciones.
Summary
Erythropoietin: A potential neuroreceptor
A century ago, significant physiolgical function of Erithropoietin was discovered. More recently, it has been working on its obtention by a recombinant via for application in patients presenting with acute and chronic anemia, from different afections. This type of therapy improves undoubtedly, life quality of these patients. From 1998, neuroprotective properties of Erythropoietin were retorted for the first time, and we performed studies corroborating it b y means of use of bran damage model, both, in vitro and in vivo. Present studies are designed to elucidate deeply action mechanisms by which Erythropoietin shows its neuroprotective properties and to obtain a appropriate bioavailability of molecule for a accurate application in therapeutics of bran afections. Present paper collets updated information on Erythropoietin as a neuroprotective agent, and refers to continuity of studies for its application in clinic.
Key words: Brain damage, Erythropoietin, neuroprotective agent, clinic.
Referencias bibliográficas
1. Fisher JW. Erythropoietin: physiology and pharmacology update. Exp Biol Med. 2003;228:1-14.
2. Malgor LA, Valsecia ME. Farmacología médica. Volumen 4. Farmacología de la hematopoyesis, farmacología gástrica, farmacología del dolor: AINES y opioides, anestésicos locales y generales y bloqueantes neuromusculares. 2000. [citado 3 de abril de 2002]. Disponible en: http://med.unne.edu.ar/catedras/farmacologia/temas_farma/indice_v4.htm
3. Jelkmann W. Molecular biology of erythropoietin. Intern Med. 2004;43: 649-59.
4. Buemi M, Caballaro E, Floccari F, Sturiale A, Aloisi C, Trimarch M, et al. Erythropoietin and the brain: from neurodevelopment to neuroprotection. Clin Sci. 2002;103:275-82.
5. Zhu H, Bunn HF. How do cells sense oxygen? Science 2001;292:449-51.
6. Ivan M, Kondo K, Yang H, Kim W, Valiando J, Ohh M, et al. HIF-targeted for VHLmediated destruction by proline hydroxylation: implications for O2 sensing. Science. 2001;292:464–8.
7. Haddad JJ. Oxygen-sensing mechanisms and the regulation of redox-responsive transcription factors in development and pathophysiology. Respir Res. 2002;3(1):26.
8. Weiss G, Goodnough LT. Anemia of chronic disease. [serial on the Internet) N Engl J Med. 2005 March; [cited 2006 Nov. 4]; 352(10). Available from: http://content.nejm.org/cgi/content/full/352/10/1011.
9. Marsden TJ. Erythropoietin –measurement and clinical applications. Ann Clin Biochem. 2006;43:97-104.
10. Hasselblatt M, Ehrenreich H, Sirén AL. The brain erythropoietin system and its potential for therapeutic exploitation in brain disease. J Neurosurg Anesthesiol. 2006;18:132-8.
11. Bohlius J, Langensiepen S, Schwarzer G, Seidenfeld J, Piper M, Bennett C. Recombinant human erythropoietin and overall survival in cancer patients: results of a comprehensive meta-analysis. J Natl Cancer Inst. 2005;362:1255-60.
12. Henke M, Laszig R, Rube C, Schafer U, Haase KD, Schilcher B, et al. Erythropoietin to treat head and neck cancer patients with anaemia undergoing radiotherapy: randomised, double-blind, placebo-controlled trial. Lancet. 2003;62:1255-60.
13. Ohls RK. Human recombinant erythropoietin in the prevention and treatment of anaemia of prematurity. Paediatr Drugs. 2004;4:111-21.
14. Marti HH. Erythropoietin and the hypoxic brain. Exp Biology J. 2004; 207:3233-42.
15. Kalialis LV, Olsen NV. Erythropoietin –a new therapy in cerebral ischemia? 2003 June 9 [cited 2006 Sept. 29]; 165(24). Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=pubmed
16. Eid T, Brines M. Recombinant human erythropoietin for neuroprotection: What is the evidence? Clin Breast Cancer. 2002;3(3):109-15.
17. Digicaylioglu M, Garden G, Timberlake S, Fletcher L, Lipton, S. A. Acute neuroprotective synergy of erythropoietin and insulin-like growth factor I. Proc Natl Acad Sci USA. 2004;101(26):9855-60.
18. Sola A, Wen TC, Hamrick EG, Ferriero DM. Protection and Repair Following Injury to the Developing Brain: A Role for Erythropoietin? Pediatr Res. 2005;57:110 R-117R.
19. Grasso G. Erythropoietin: A new Paradigm for Neuroprotrection. J Neurosurg Anesthesiol. 2006;18:91-2.
20. Chin K, Yu X, Beleslin-Cokic B, Liu C, Shen K, Mohrenweiser HW. Production and processing of erythropoietin receptor transcripts in brain. Brain Res Mol Brain Res. 2000;81:29-42.
21. Sirén AL, Knerlich F, Poser W, Gleiter CH, Bruck W, Ehrenreich H. Erythropoietin and erythropoietin receptor in human ischemic/hypoxic brain. Acta Neuropathol. 2001;101:271-6.
22. Sugawa M, Sakurai Y, Ishikawa-Ieda Y, Suzuki H and Asou H. Effects of erythropoietin on glial cell development; oligodendrocyte maturation and astrocyte proliferation. Neurosci Res. 2002;44:391-403.
23. Nagai A, Nakagawa E, Choi HB, Hatori K, Kobayashi S, Kim SU. Erythropoietin and erythropoietin receptors in human CNS neurons, astrocytes, microglia, and oligodendrocytes grown in culture. J Neuropathol Exp Neurol. 2001;60:386-92.
24. Brines M, Cerami A. Emerging biological roles for erythropoietin in the nervous system. Nat Rev Neurosci. 2005;6:484-94.
25. Sirén AL, Ehrenreich H. Erytropoietin a novel concept for neuroprotection. Eur Arch Psychiatry Clin Neurosci. 2001;251:179-84.
26. Knabe W, Knerlich F, Washausen S, Wisniewski HM. Expression patterns of erythropoietin and its receptor in the developing midbrain. Anat Embryol. 2004;207:503-12.
27. Ehrenreich H, Hasselblatt M, Knerlich F. A hemapoietic growth factor, thrombopoietin, has a proapoptotic role in the brain. Proc Natl Acad Sci USA. 2005;102:862-7.
28. Knabe W, Sirén AL, Ehrenreich H, Kunh HJ. Expression patterns of erythropoietin and its receptor in the developing spinal cord and dorsal root ganglia. Anat Embryol. 2005;210:209-19.
29. Erbayraktar S, Grasso G, Sfacteria A, Qiao-wen Xie, Coleman T, Krtellagaard M, et al. Asialoerythropoietin is a nonerythropoietic cytokine with broad neuroprotective activity in vivo. PNAS Med Sci. 2003;100(11):6741-6.
30. Wang L, Zhang Z, Zhang R, Hafner MS, Wong HK, Jiao Z, et al. Erythropoietin up-regulates SOCS2 in neuronal progenitor cells derived from SVZ of adult rat. Neuroreport. 2004;15:1225-9.
31. Shingo T, Sorokan ST, Shimazaki T, Weiss S. Erythropoietin regulates the in vitro and in vivo production of neuronal progenitors by mammalian forebrain neural stem cells. J Neurosci. 2001;21,9733-43.
32. Junk AK, Mammis A, Savitz SI, Singh M, Roth S, Malhotra S, et al. Erythropoietin administration protects retinal neurons from acute ischemia-reperfusion injury. Proc Natl Acad Sci USA. 2002;99:10659-64.
33. Grimm C, Wenzel A, Groszer M, Mayser H, Seeliger M, Samardzija M, et al. HIF- 1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nat Med. 2002;8:718-24.
34. Weber A, Maier RF, Hoffmann U, Grips M, Hoppenz M, Aktas AG, et al. Erythropoietin improves synaptic transmission during and following ischemia in rat hippocampal slice cultures. Brain Res. 2002;958:305-11.
35. Ehrenreich H and Siren AL. Neuroprotection –what does it mean? What means do we have? Eur Arch Psyc Clin Neurosci. 2001;251:149-51.
36. Siren A L, Fratelli M, Brines M, Goemans C, Casagrande S, Lewczuk P, et al. Erythropoietin prevents neuronal apoptosis after cerebral ischemiaand metabolic stress. Proc Natl Acad Sci USA. 2001a;98:4044-9.
37. Wen TC, Sadamoto Y, Tanaka J, Zhu PX, Nakata K, Ma YJ et al. Erythropoietin protects neurons against chemical hypoxia and cerebral ischemic injury by up-regulating Bcl-xL expression. J Neurosci Res. 2002;67:795-803.
38. Digicaylioglu M, Kaul M, Fletcher L, Dowen R, Lipton SA. Erythropoietin protects cerebrocortical neurons from HIV-1/gp120-induced damage. Neuroreport. 2004;15:761-3.
39. Ruscher K, Freyer D, Karsch M, Isaev N, Megow D, Sawitzki B, et al. Erythropoietin is a paracrine mediator of ischemic tolerance in the brain: evidence from an in vitro model. J Neurosci. 2002;22:10291-301.
40. Bernaudin M, Nedelec AS, Divoux D. Normobaric hypoxia induces tolerance to focal permanent cerebral ischemia in association with an increased expression of hypoxia-inducible factor-1 and its target genes, erythropoietin and VEGF, in the adult mouse brain. J Cereb Blood Flow Metab. 2002;22:393-403.
41. Dirnagl U, Simon RP, Hallebeck JM. Ischemic tolerance and endogenous neuroprotection. Trends Neurosci. 2003;26:248-54.
42. Liu J, Narasimbhan P, Yu F, Chang PH. Neuroprotection by hypoxia preconditioning involves oxidative stress-mediated expression of hypoxia- inducible factor and erythropoietin. Stroke. 2005;36:1264-9.
43. Prass K, Ruscher K, Karsch M, Isaev N, Megow D, Priller J, et al. Desferrioxamine induces delayed tolerance against cerebral ischemia in vivo and in vitro. J Cereb Blood Flow Metab. 2002;22:520-5.
44. Genc S, Kuralay F, Genc K, Akhisaroglu M, Fadiloglu S, Yorukoglu K, et al. Erythropoietin exerts neuroprotection in 1 methyl-4-phenyl-1,2,3,6-tetrahydropyridine-treated C57/BL mice via increasing nitric oxide production. Neurosci Lett. 2001;298:139-41.
45. Grasso G, Buemi M, Alfaci C, Sfacteria A, Passalacqua M, Sturiale A, et al. Beneficial effects of systemic administration of recombinant human erythropoietin in rabbits subjected to subarachnoid hemorrhage. Proc Natl Acad Sci USA. 2002;99:5627-31.
46. Sinn D, Chu K, Lee S. Erythropoietin has neuroprotective effects with functional recovery in experimental intracerebral hemorrhage. 57th Ann Meeting Am Acad Neurol. 2005;S48.00. Available from: /www.abstracts2view.com/aan/
47. Sola A, Rogido M, Lee B, Genetta T, Wen TC. Erythropoietin after focal cerebral ischemia activates the Jak-Stat signaling pathway and improves brain injury in postnatal day-7 rats. Pediatr Res. 2005;57:481-7.
48. Yatsiv I, Grigoriadis N, Simeonidou C, Stahel PF, Schmidt OI, Alexandrovitch AG, et al. Erythropoietin is a neuroprotective, improves functional recovery and reduces neuronal apoptosis and inflammation in a rodent model of experimental closed head injury. FASEB J. 2005; 19(12):1701-3.
49. Lu D, Mahmood A, Qu C. Erythropoietin enhances neurogenesis and restores spatial memory in rats after traumatic brain injury. J Neurotrauma. 2005;22:1011-7.
50. Celik M, Gokmen N, Erbayraktar, Akhisaroglu M, Konake S, Ulukus C, et al. Erythropoietin prevents motor neuron apoptosis and neurologic disability in experimental spinal cord ischemic injury. Proc Natl Acada Sci USA. 2002;99:2258-63.
51. Gorio A, Gokmen N, Erbayraktar S, Yilmaz O, Madaschi L, Cichetti C, et al. Recombinant human erythropoietin counteracts secondary injury and markedly enhances neurological recovery from experimental spinal cord trauma. Proc Natl Acad Sci USA. 2002;99:9450–5.
52. Li W, Maeda Y, Yuan RR. Elkabes S, Cook S, Dowling P. Beneficial effect of erythropoietin on experimental allergic encephalomyelitis. Ann Neurol. 2004;56:767-77.
53. Sattler MB, Merkler D, Maier K. Neuroprotective effects and intracellular signalling pathways of erythropoietin in a rat model of multiple sclerosis. Cell Death Differ. 2004;11(2):S181-S92.
54. Diem R, Sattler MB, Merkler D, Demmer I, Maier K, Stadelmann C, et al. Combined therapy with methylprednisolone and erythropoietin in a model of multiple sclerosis. Brain. 2005;128:375-85.
55. Bianchi R, Buyukakilli B, Brines M, Savino C, Cavaletti G, Oggioni N, et al. Erythropoietin both protects from and reverses experimental diabetic neuropathy. Proc Natl Acad Sci USA. 2004;101:823-8.
56. Becerra SP, Amaral J. Erythropoietin-an endogenous retinal survival factor. N Engl J Med. 2002;347:1968-70.
57. Agnello D, Bigini P, Villa P, Mennini T, Cerami A, Brines M, Ghezzi P. Erythropoietin exert an anti-inflammatory effect on the CNS in a model of experimental autoimmune encephalomyelitis. Brain Res. 2002;952,128-34.
58. Sosa TI, García SJD, Subirós N, González C, Rodríguez Y, García RJC. Alternativa terapéutica en la isquemia cerebral empleando la Eritropoyetina humana recombinante (rHu-EPO) como neuroprotector. Rev CNIC Cienc Biol. 2006;36(No. Especial):CB-49.
Recibido: 8 de enero de 2007. Aprobado: 9 de febrero de 2007.
Lic. Alain Valdivia Acosta. Instituto de Farmacia y Alimentos. Universidad de La Habana. San Lázaro y L, La Habana, Cuba. Correo electrónico: armando@cieb.sld.cu
1 Licenciado en Ciencias Farmacéuticas.
2 Doctor en Ciencias Farmacéuticas. Investigador Auxiliar.