Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.42 n.2 Ciudad de la Habana Mayo-ago. 2008
ARTÍCULOS ORIGINALES
Desarrollo y validación de un método analítico aplicable al control de la calidad del picosulfato de sodio gotas orales
Development and validation of an analytical method applicable to the quality control of sodium picosulphate oral drops
María Teresa Herrera SantiI; Caridad Margarita García PeñaII; Gladys Méndez JorrínII
I Ingeniera Química. Empresa Laboratorio Farmacéutico "Saúl Delgado". La Habana, Cuba.
II Master en Ciencias, Tecnología y Control de Medicamentos. Centro de Investigación y Desarrollo de Medicamentos. La Habana, Cuba.
RESUMEN
Se desarrolló y validó un método analítico, fácil y económico, aplicable al control de la calidad del picosulfato de sodio 0,75 %, gotas orales. Se evaluaron los parámetros de especificidad, linealidad, exactitud y precisión. Los resultados obtenidos mediante los parámetros analizados en la validación del método se encontraron dentro de los límites establecidos. El método analítico desarrollado resultó lineal, preciso, específico y exacto en el rango de concentraciones estudiadas.
Palabras clave: Picosulfato de sodio, espectrofotometría ultravioleta.
ABSTRACT
An analytical, easy and economic method applicable to the quality control of sodium picosulphate oral drops 0.75 % was developed and validated. The parameters of specificity, lineality, exactness and precision were evaluated. The results attained by parameters analyzed in the validation of the method were within the established limits. The applied analytical method proved to be lineal, precise, specific and exact in the range of the studied concentrations.
Key words: Sodium picosulphate, ultraviolet spectrophotometry.
INTRODUCCIÓN
El picosulfato de sodio se indica como tratamiento del estreñimiento agudo y crónico en pacientes de todas las edades, inclusive lactantes. Se puede emplear por tiempo prolongado en estreñimiento crónico o en estreñimiento producido por cambios de dietas o modificaciones en el régimen de vida. Se utiliza como laxante en el manejo pre y posoperatorio, embarazo, posparto, en geriatría y en aquellos pacientes que se van a someter a estudios radiológicos y endoscópicos, que requieran eliminar sombras por material fecal o gases. Además, se usa en cirugía proctológica y en todos aquellos pacientes en quienes es necesario disminuir el esfuerzo de la defecación, por infarto del miocardio, insuficiencia cardiaca o respiratoria, hernias o hipertensión arterial, también en presencia de fisuras anales o hemorroides. En los niños se usa durante la constipación de la lactancia, durante los cambios en la dieta y como coadyuvante en el tratamiento antiparasitario.1
La espectrofotometría ultravioleta es un poderoso instrumento en una variedad de problemas analíticos. Sin embargo, en muchas oportunidades tiene el inconveniente de la falta de especificidad, debido a la interferencia con los productos de degradación, los cuales en ocasiones pueden presentar un espectro idéntico al componente sin degradar. En otras las concentraciones a determinar son muy pequeñas y están por debajo del límite de sensibilidad del método o dentro de su error experimental.2
La validación es el proceso establecido para la obtención de pruebas documentadas de que el método es lo suficientemente fiable para producir el resultado esperado.3-5
Los parámetros analíticos que pueden ser considerados en la validación de un método analítico, según se expresa en la United States Pharmacopoeia (USP 26, USP 27), son exactitud, precisión, especificidad, límite de detección, límite de cuantificación, linealidad, rango, tolerancia y robustez.
No existen reportes de métodos espectrofotométricos para el control de la calidad del producto terminado.
El presente trabajo tiene como objetivo desarrollar un método analítico espectrofotométrico, para el control de la calidad del picosulfato de sodio gotas orales y su validación.
MÉTODOS
Las muestras del picosulfato de sodio gotas orales, utilizadas para el desarrollo de este trabajo, fueron identificadas como lote 1, fabricado en la Empresa Farmacéutica "Saúl Delgado".
La sustancia de referencia química de picosulfato de sodio fue suministrada por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
Todos los reactivos utilizados fueron de calidad analítica.
Se pesaron 75 mg de picosulfato de sodio con un error máximo de 0,1 mg. Se trasvasaron a un matraz aforado de 100 mL y se disolvieron con agua destilada; se llevó a volumen con el mismo solvente y se homogeneizó (RI). Se tomó una alícuota de 2,0 mL de la solución RI y se transfirieron a un matraz aforado de 50 mL. Se completó volumen con agua destilada y se homogeneizó (RII).
Posteriormente, a 2,0 mL de la muestra de ensayo, depositados en un embudo separador de capacidad adecuada, le añadieron 20 mL de solución de ácido clorhídrico al 10 % y se realizaron 3 extracciones de 25 mL cada una con éter dietílico. Se reunieron las fases etéreas en un mismo embudo separador y la fase acuosa se trasvasó hacia un volumétrico de 100 mL. Se lavaron las fases etéreas reunidas con 2 porciones de 25 y 15 mL de solución de ácido clorhídrico al 10 %, y se pasaron hacia el volumétrico que contenía la fase acuosa inicial. Se completó volumen con agua hasta el enrase (MI). Se tomaron 10,0 mL de esta solución y se trasvasaron a un segundo volumétrico de 50 mL; se completó a volumen con agua. (MII).
Se determinaron las absorbancias de ambas soluciones (MII y RII) a 263 nm con el empleo de agua como blanco.
Para el estudio de la especificidad, de la técnica de espectrofotometría UV, se evaluó la influencia de los excipientes, con el empleo de un placebo y se realizó un barrido de 200 a 500 nm.
En el estudio de la linealidad se preparó una curva de calibración con soluciones patrón de picosulfato de sodio en un intervalo de concentraciones desde 4,5 hasta 10,5 mg/mL, que representan del 60 al 140 % de la concentración teórica del principio activo en la solución. Se realizó el modelo de 3 determinaciones para 5 concentraciones diferentes, según lo establecido en la Farmacopea de los Estados Unidos (USP 29).
Para el estudio de la exactitud se empleó el método de recuperación, para lo cual se prepararon placebos cargados con diferentes niveles de picosulfato de sodio. Se realizó el modelo de 3 réplicas para 3 concentraciones diferentes: 80, 100 y 120 %, y se determinó el porcentaje de recuperación, la desviación estándar y el coeficiente de variación. Se determinó además la prueba de Gochran con vistas a comprobar si la variación de la concentración produce diferencias significativas en los resultados y la prueba de la t de Student para determinar diferencias significativas entre la recuperación media y el 100 %.
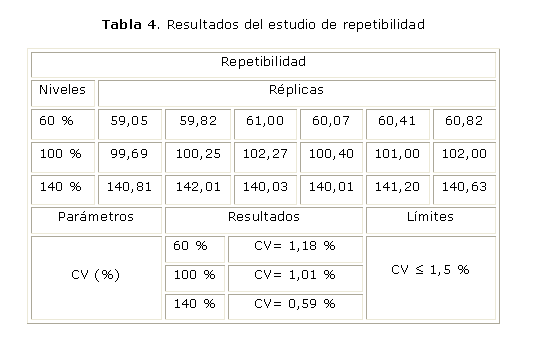
La repetibilidad se estudió sobre la base de 6 determinaciones a 3 concentraciones que representan el 60, 100 y 140 % de la cantidad teórica declarada. Se determinó el coeficiente de variación.
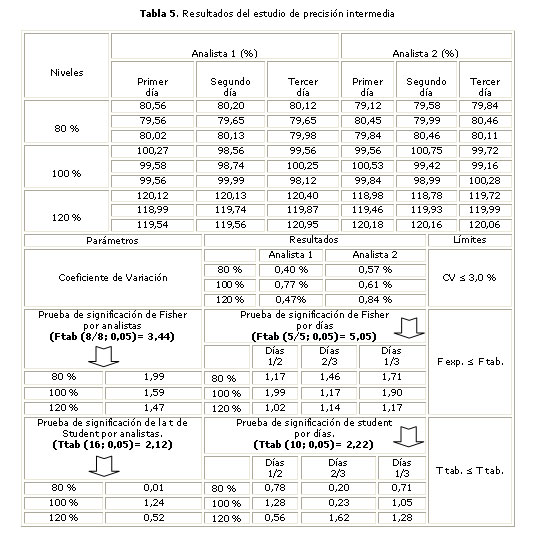
El estudio de precisión intermedia se realizó por dos analistas, en tres días diferentes, a 3 niveles de concentración (que representan el 80, 100, 120 % de la concentración teórica), con la aplicación de la prueba de Fisher y de la t de Student para determinar si existen diferencias significativas entre los resultados al variar las condiciones de análisis
El procedimiento de los datos se realizó mediante el programa Origin versión 5.0.
RESULTADOS
Los resultados obtenidos en el estudio de especificidad del método realizado a 263 nm, empleando el placebo, la sustancia de referencia química, y las gotas orales se muestran en la tabla 1.

En las tablas 2 y 3 se reportan los resultados del estudio de la linealidad del sistema y la exactitud, mientras que los resultados correspondientes a la repetibilidad y precisión intermedia aparecen en las tablas 4 y 5, respectivamente.
DISCUSIÓN
Los resultados obtenidos en el estudio de especifidad del método espectrofotométrico (tabla 1), indican que los excipientes no interfieren en la determinación del principio activo, lo que demuestra la especificidad del método para el control de la calidad ya que la absorbancia del placebo a la longitud de onda máxima del principio activo es menor del 1 %.
La curva de calibración resultó ser lineal en el rango analizado; el coeficiente de correlación y el coeficiente de determinación cumplen con los criterios de aceptación, lo cual indica buena linealidad. Al aplicar la prueba de Linealidad, se obtuvo que los factores de respuestas son semejantes entre sí y cercanos al valor de la pendiente, por esto se puede tomar el coeficiente de variación de los factores de respuestas (CVf) como expresión de linealidad, que es menor del 5 % por lo que cumple con los parámetros establecidos. Además, el valor de Sb rel (%) fue menor del 2 %, lo que demuestra la adecuada linealidad. Al aplicar la prueba de proporcionalidad se obtiene que el error sistemático del método es pequeño, sus límites de confianza incluyen el cero. En la prueba de significación estadística de la varianza del intercepto, se obtuvo una t calculada menor que la t tabulada por lo que se cumple la condición de proporcionalidad.
En el rango seleccionado para el estudio de exactitud, los valores de porcentaje de recobro están dentro de los límites establecidos para los métodos espectofotométricos (98-102 %) y el valor del coeficiente de variación, fue menor que el 3 %. En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud mediante la prueba de Cochran se obtuvo que G calculada fue menor que la G tabulada para una probabilidad de 0,05, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes, lo cual indica que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, se obtuvo una t calculada menor que la t tabulada, lo que confirma la buena exactitud del método pues el recobrado medio no difiere significativamente del 100 %.
En el estudio de la repetibilidad realizado a 3 niveles de concentración, por el mismo analista, el mismo día, a través de 6 réplicas, se alcanzaron coeficientes de variación adecuados en todos los niveles de concentración, lo que demuestra la buena precisión del método ya que cumple con el límite establecido de CV £ 1,5 %.
Los valores obtenidos en la prueba de Fischer para el estudio de la precisión intermedia demuestran que no existen diferencias significativas entre las precisiones alcanzadas por los analistas ni entre las precisiones alcanzadas en los diferentes días, para una probabilidad de 0,05 %, ya que el valor de F calculada es menor que la F tabulada. Al realizar la prueba de la t de Student el valor calculado resultó menor que el tabulado para una probabilidad de 0,05, lo cual demuestra que no existen diferencias significativas entre las medias alcanzadas, con un nivel de significación de un 5 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Martindale W. The extra Pharmacopoeia 28th ed. London: Pharmaceutical Press; 1989. p. 1224-6.
2. United States Pharmacopoeial Convention, USP 29. Validation of compendial methods. 29 ed. Rockville, Mack Printing; 2006.
3. Guidance for Industry. Analytical Procedures and Methods Validation Chemistry, Manufacturing, and Controls Documentation. FDA/Center for Drug Evaluation and Research. 2001.
4. Guidance for Industry. Analytical Procedure and Methods Validation. Draft Guidance. 2000.
5. International Conference on Harmonization (ICH) of Technical Requirements for the Registration of Pharmaceuticals for Human Use. Validation of analytical procedures: Methodology, ICH-Q2B, Geneva. 1996.
Recibido: 9 de enero de 2008.
Aprobado: 11 de febrero de 2008.
MSc. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605 entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, La Habana, Cuba. Correo electrónico: cinfa@infomed.sld.cu
Empresa Laboratorio Farmacéutico "Saúl Delgado"














