Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.42 n.3 Ciudad de la Habana sep.-dic. 2008
ARTÍCULO DE REVISIÓN
Canabinoides: análogos y perspectivas terapéuticas II
Cannabinoids: analogues and therapeutical perspectivas II
Juan E. Tacoronte MoralesI; Yanier Nuñez FigueredoII; Mayelin MontalbánIII; Laymi Martínez GarcíaIV; Hiran Cabrera SuárezV; Juan A. Mesa DíazVI; Olinka Tiomno TiomnovaVII
IDoctor en Ciencias Químicas. Investigador Auxiliar. Centro de Ingeniería e Investigaciones Químicas. La Habana, Cuba.
IIMaster en Ciencias Farmacéuticas. Investigador Agregado Centro de Investigación y Desarrollo de Medicamentos. La Habana, Cuba.
IIILicenciada en Bioquímica. Oficina Cubana de la Propiedad Industrial (OCPI). La Habana, Cuba.
IVLicenciada en Información Científico-Técnica y Bibliotecología. Centro de Ingeniería e Investigaciones Químicas. La Habana, Cuba.
VMaster en Ciencias Farmacéuticas. Instructor. Facultad de Ciencias Médicas de La Habana "Calixto García". La Habana, Cuba.
VIMaster en Ciencias Químicas. Centro de Ingeniería e Investigaciones Químicas. La Habana, Cuba.
VIILicenciada en Ciencias Químicas. Aspirante a Investigadora. Centro de Ingeniería e Investigaciones Químicas. La Habana, Cuba.
RESUMEN
Actualmente se han generado valiosísimas fuentes de información que correlacionan la especie botánica Cannabis sativa L y sus metabolitos secundarios con la medicina (tratamiento terapéutico), farmacología (modelos experimentales) y química sintética (diseño y generación de nuevas estructuras y análogos bioisósteres), que avalan la significación del estudio de esta planta, sus extractos, metabolitos, precursores y análogos naturales y sintéticos como fuente de agentes terapéuticos. Por tal motivo se presenta una revisión de la información existente sobre las potenciales implicaciones terapéuticas de sistemas moleculares canabinoidales (endógenos, naturales y sintéticos) en el tratamiento de diversas afecciones del sistema nervioso central, que incluye: conceptos de tipos de canabinoides; sistemas de receptores canabinoides CB1 y CB2 y sus ligandos así como evidencias preclínicas de los efectos terapéuticos de canabinoides desde 1970 hasta el 2006.
Palabras clave: Cannabis, canabinoides, potencial terapéutico, ligandos, actividad.
ABSTRACT
At present, a great amount of valuable information and experimental data has been generated that correlate Cannabis sativa and its secondary metabolites with medicine (therapeutic treatment), pharmacology (experimental animal models) and synthetic chemistry (design and generation of new structures and biososteric analogues), showing the importance of the study about this plant, its extracts, metabolite precursors and natural and synthetic analogues as therapeutic agents. Taking theses points into consideration, this article reviews the therapeutic implications of cannabinoid systems (endogenous, natural, and synthetic) on several pathologies of central nervous system, including: cannabinoid type concepts, cannabinoid receptor systems CB1 and CB2 and preclinical studies devoted to therapeutic effects of the cannabinoids since 1970 until 2006
Key words: Cannabis, cannabinoids, therapeutic potential, ligands, activity
ASPECTOS GENERALES
Desde la antigüedad,1 la planta Cannabis sativa (marihuana) ha sido utilizada con diversos fines. La primera referencia documentada sobre la fibra textil, la extracción de aceite de sus semillas y las aplicaciones médicas del cannabis es el libro "Nei Ching" (2600 AC). En la India el cannabis formaba parte de rituales religiosos y se aplicaba como medicina durante el siglo VIII AC. Al principio de la era cristiana, Plinio "el viejo', Dioscórides y Galeno describieron las posibles aplicaciones médicas del cannabis como analgésico y como antiinflamatorio, aunque se indicaba el efecto psicógeno que su uso podía producir. Durante el siglo XIX, se difunden las aplicaciones médicas y lúdicas del cannabis por Europa y Estados Unidos. Su uso en la práctica médica declina durante el siglo XX. A partir de la década de los 60 del siglo XX el interés por los canabinoides resurge debido al descubrimiento del sistema canabinoide endógeno (SCE). Este hallazgo ha orientado la investigación científica sobre las propiedades biológicas y terapéuticas de los canabinoides hacia el desarrollo de derivados sintéticos y el estudio de sus correlaciones estructura-actividad, en los que se trata de separar y potenciar las propiedades farmacológicas en sus interacciones con los receptores del SCE, de sus efectos psicoactivos, lo que inicia una nueva etapa en el conocimiento de los canabinoides y su aplicación terapéutica.2
SISTEMA CANABINOIDE ENDÓGENO
En los últimos años, la investigación de los canabinoides ha experimentado un extraordinario desarrollo, favorecido por el enfoque multidisciplinario del que ha sido objeto. Este esfuerzo conjunto de la química, la bioquímica y la farmacología ha profundizado en el conocimiento de sus mecanismos de acción y la caracterización molecular y estructural del SCE. El SCE, está constituido por 3 elementos fundamentales:
1. ligandos endógenos (endocanabinoides)
2. receptores específicos para estos sistemas moleculares (CB1 y CB2).3
3. un sistema de terminación de la respuesta biológica inducida por la activación que los ligandos endógenos generan sobre sus receptores
Entre los ligandos endógenos se reconocen: anandamida,4 2-araquidonilglicerol5 y el araquidil-2-gliceril éter6 y, el sistema de terminación, compuesto por 2 elementos cuyo funcionamiento coordinado es el responsable de la inactivación fisiológica de los canabinoides. Este sistema consta de un mecanismo de recaptación mediado por un transportador (ANT) específico y selectivo7 localizado tanto en neuronas como en glía el cual se encarga de capturar los endocanabinoides liberados al medio extracelular y transportarlos al interior citoplasmático, seguido de un proceso de hidrólisis enzimática intracelular catalizado por la enzima amido-hidrolasa de los ácidos grasos o FAAH.8
Implicaciones fisiológicas del sistema canabinoide endógeno
La participación de los endocanabinoides y análogos sintéticos en diversas funciones fisiológicas,9 como antinocicepción, control de movimiento, memoria, aprendizaje y desarrollo cerebral, explica algunos de los efectos beneficiosos atribuidos a los canabinoides en el tratamiento de diversas enfermedades que afectan el sistema nervioso central (SNC). La función fisiológica primaria del SCE se observa en la modulación de la actividad neuronal así como en la regulación del apetito que está involucrado en la señalización retrograda inter-neuronal en diversas áreas cerebrales.10 Se considera que los endocanabinoides actúan como mediadores en el proceso de DSI (depolarization-induced supression of inhibition), proceso crucial que posibilita y favorece los mecanismos de aprendizaje y memoria, además de reforzar la función del ANT en la regulación del funcionamiento del SCE, ya que la síntesis tónica de endocanabinoides debe estar equilibrada por la recaptación, que mantiene la concentración extracelular de endocanabinoides en los niveles fisiológicos adecuados en cada momento. Los endocanabinoides, activando los receptores CB1 hipotalámicos, estimulan el apetito (efectos orexígenos) y forman parte del circuito neuronal regulado por la leptina.11
Implicaciones terapéuticas
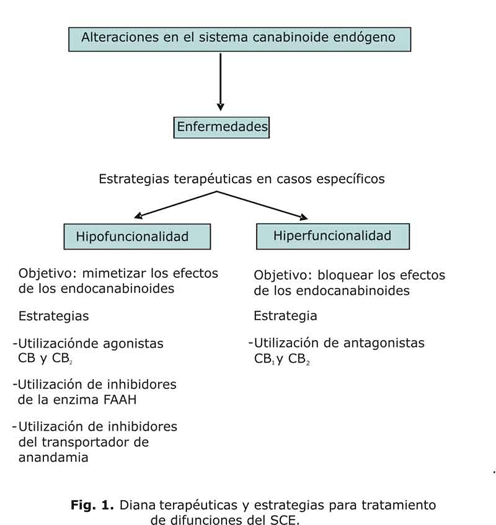
De acuerdo con estas consideraciones, los efectos producidos por los canabinoides podrían estar relacionados con alguna disfunción patológica (demencia, alteraciones de la memoria, funciones motoras o apetito) ya sea por hipo o hiperfunción del SCE. Por tanto, dentro de las posibles dianas terapéuticas a considerar ante un caso de disfunción del SCE existen 2 posibles estrategias en función de que la alteración este ocasionada por una hipofuncionalidad o una hiperfuncionalidad de este (fig. 1). Así, el desarrollo de los compuestos antagonistas constituye el objetivo fundamental para el tratamiento de afecciones ocasionadas por hiperfunción del SCE mientras que la obtención de nuevos agentes farmacológicos capaces de inhibir selectivamente tanto la enzima FAAH como el transportador de anandamida resulta de especial importancia en el caso de la existencia de una hipofuncionalidad en dicho sistema. En particular, con respecto al transportador de anandamida, es importante la obtención de compuestos capaces de impedir su proceso de recaptación y degradación, que aumenten los niveles endógenos de anandamida y una respuesta más favorable y con una menor número de efectos secundarios indeseables asociados con la activación directa de los receptores mediante la administración de fármacos agonistas.12
LIGANDOS
Genéricamente, el término canabinoide designa un grupo de compuestos de origen biosintético mixto que presentan una estructura carbocíclica de 21 átomos, entre los que se incluyen los constituyentes activos (> 400) de la planta Cannabis sativa L. así como sus análogos y productos de transformación. Descritos más de 60 canabinoides naturales distintos, el más representativo y mayor potencia psicoactiva es el D 9-tetrahidrocannabinol o D9-THC (fig. 2).

Debido a la gran importancia fisiológica de estos receptores (CB1 y CB2) y ligandos endógenos, durante 1996-2006 se ha realizado el diseño, síntesis y desarrollo de ligandos (agonistas y antagonistas) de los distintos constituyentes del SCE a fin de obtener nuevos compuestos sintéticos con afinidad, selectividad y potencia predeterminada, optimizando su aplicabilidad terapéutica y, al mismo tiempo, evitar los efectos secundarios indeseables (psicotrópicos). Dentro de estos ligandos sintéticos se podrían destacar, no a partir de una clasificación estructural sino en la proteína diana de la que actúan, los siguientes compuestos:
Ligandos del receptor de canabinoides CB1
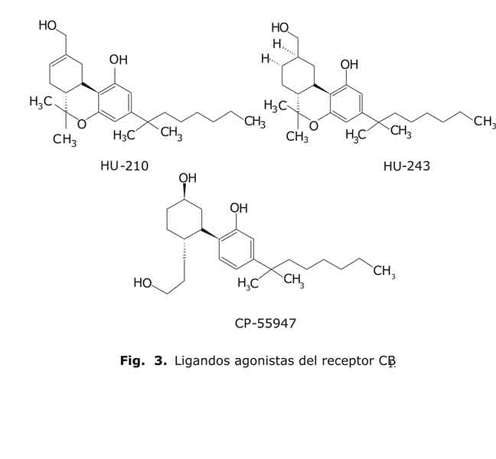
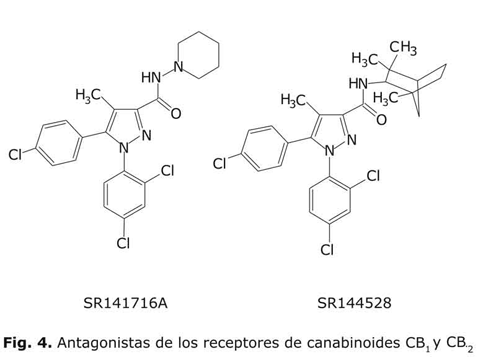
Entre los agonistas de este receptor los más importantes son los derivados HU-210, HU-243, y el CP 55947 (fig. 3). Los dos primeros presentan la estructura tricíclica característica de los canabinoides (análoga a la del D9-THC), de ahí que se consideren canabinoides clásicos. El HU-210 ha sido descrito como uno de los canabinoides más potentes (Ki (CB1)= 0,73 nM; Ki (CB2)= 0,22 nM), al igual que el HU-243 (Ki (CB1)= 0,045 nM; Ki (CB2)= 0,061 nM).13 A diferencia de ambos, el CP-55940 _desarrollado por los laboratorios Pfizer_ presenta una estructura bicíclica. Este ligando también se caracteriza por unirse con una afinidad equipotente a ambos receptores (Ki (CB1)= 0,58 nM; Ki (CB2)= 0,69 nM). 13 Como ligando selectivo de CB1 destaca el antagonista desarrollado por los laboratorios Sanofi, el SR-141716ª (fig. 4), que, con una estructura de diarilpirazol, exhibe una elevada selectividad por este receptor (Ki (CB1)= 5,6 nM; Ki (CB2) > 1000 nM). 13
Ligandos del receptor de canabinoides CB2
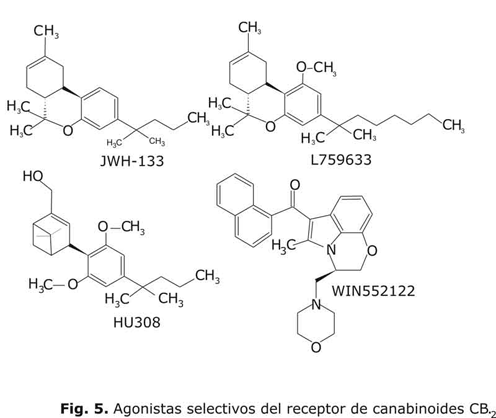
Con respecto a los ligandos del receptor CB2 con una actividad agonista (fig. 5) cabe mencionar el compuesto WIN-552122 (Ki (CB2)= 4,1 nM; Ki (CB1)= 123 nM),13 que pertenece al grupo de los aminoalquilindoles desarrollados por la compañía Sterling-Winthrop. Además, dentro de los agonistas CB2 selectivos, se destacan los descritos 13 HU-308 (Ki (CB2)= 22,7 nM; Ki (CB1) > 1 000 nM), JWH133 (Ki (CB2)= 3,4 nM; Ki (CB1) > 677 nM) y L-759633 (Ki (CB2)= 6,4 nM; Ki (CB1) > 1 000 nM), que constituyen una de las últimas aportaciones en esta área. En relación con los antagonistas (fig. 4) debe destacarse el compuesto SR144528 (Ki (CB2)= 5,6 nM; Ki (CB1) > 1 000 nM)13 -también desarrollado por la Sanofi y derivado de diarilpirazol. La existencia de antagonistas selectivos para los 2 receptores de canabinoides supone una herramienta de incalculable valor para poder discriminar experimentalmente entre los efectos asociados a uno u otro receptor.
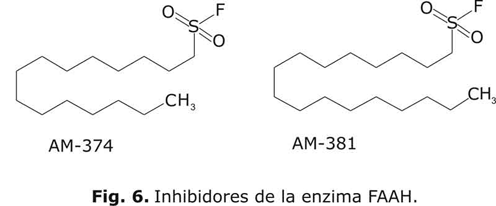
Inhibidores de la enzima amidohidrolasa de ácidos grasos (FAAH)
Dentro de estos inhibidores de la enzima FAAH se destacan los fluoruros de estearilsulfonilo (AM381), de palmitilsulfonilo (AM374) y de fenilmetanosulfonilo (PMSF). Todos ellos se comportan como inhibidores irreversibles13 ya que se interaccionan covalentemente con la enzima, inactivando de una forma directa la serina 241, que es el residuo catalítico responsable de la hidrólisis de los sustratos y se localiza en el centro activo de la enzima. El PMSF es un inhibidor general de serin-proteasas debido a la reactividad de su fragmento de fluoruro de sulfonilo y, por tanto, también de FAAH. Esta capacidad para inhibir la FAAH, sirvió como punto de partida para la obtención de compuestos más potentes y específicos de dicha enzima en concreto. Así, se comenzó a sintetizar compuestos formados por un fragmento de fluoruro de sulfonilo al que se le adiciona una cadena lateral de ácido graso de longitud variable.8 De este modo se obtuvieron los compuestos AM374 y AM381 (fig. 6), derivados de los ácidos palmítico y esteárico respectivamente, que suponen una mejora en la potencia inhibitoria de entre 20 y 1 000 veces, en dependencia del modelo de estudio, con respecto al PMSF. Esta elevada capacidad como inhibidores de la enzima (CI50= 7 y 4 nM respectivamente) está acompañada de selectividad frente a los receptores de canabinoides, 13 por los que muestran una baja afinidad dentro del rango micromolar.
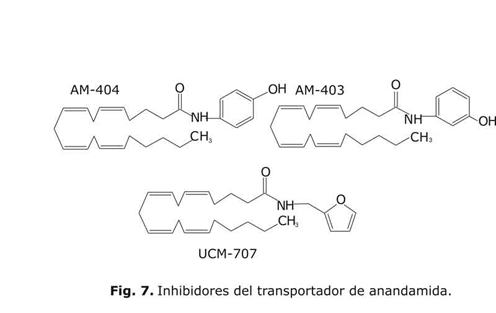
Inhibidores del transportador de anandamida (ANT)
A pesar de la enorme importancia del transportador, no ha sido aún caracterizado completamente a nivel molecular, y solamente se conocen algunos ligandos capaces de inhibirlo de forma potente y selectiva y muy pocos estudios de relación estructura-afinidad (SAFIR) se han desarrollado.14-16 De entre los ligandos existentes, solo el AM-404 (fig. 6) ha sido, hasta la fecha, objeto de un amplio estudio dada su elevada capacidad (CI50= 2,2 ± 0,2 µM)14 para inhibir el transportador. Esto, junto con la enorme sensibilidad que el transportador muestra ante pequeñas modificaciones estructurales como pone de manifiesto la pérdida de efectividad de 10 veces que conlleva la variación del grupo hidroxilo de la posición para en el AM-404 a la posición orto en el compuesto AM-403 (fig. 7) (CI50 = 21,3 ± 3,4 µM)14 justifica la importancia de profundizar en los factores que intervienen de forma tan crítica en la modulación de esta afinidad. En este contexto, se desarrolla el diseño y síntesis de nuevos compuestos derivados del ácido araquidónico con el objetivo de evaluar, paralelamente, su capacidad para inhibir la acción del transportador como su afinidad por los receptores de canabinoides CB1 y CB2.17 Las investigaciones revelan que el compuesto UCM-707 (fig. 7) con CI50 = 0,8 ± 0,4 µM, representa uno de los inhibidores más potentes de transporte de anandamida.
RELACIONES ESTRUCTURA-ACTIVIDAD
Los estudios iniciales se focalizaron en la modificación de la estructura del D9-THC, vía introducción de grupos alquilantes.18 Quince años atrás se generaron canabinoides agonistas basados en sistemas moleculares aminoalquilindólicos, AAI, como el WIN 55,212-2,19 que permitieron desarrollar estudios QSAR y la generación de un nuevo modelo de farmacóforo para las interacciones ligando-receptores CB1.20
El rimonabant (1994), es el primer antagonista selectivo de receptores CB1 y los estudios SAR para sus análogos han sido descritos.21 Sanofi ha desarrollado antagonistas de II generación (SR-147778) con mayor tiempo de acción.22 Estos estudios han revelado la gran significación del sistema pirazólico y grupos ariloxi- como versátiles unidades estructurales en el desarrollo de potenciales ligandos antagonistas para receptores CB1 y CB2.23 No obstante, se requieren aproximaciones computacionales más sofisticadas (incluyendo docking molecular) para optimizar el diseño de NEQ con mayor diversidad estructural como ligandos selectivos para receptores CB1 y CB2. Las principales líneas son: disminución de la energía conformacional y estado R; potenciales fragmentos de aminoácidos involucrados en la activación e inactivación de receptores CB1 y CB2; generación de puentes de hidrógeno ligando-receptor y formación de puentes salinos; incremento o disminución de la lipofilicidad; significación de fragmentos quirales y generación de modelos farmacóforos inversos.24 El concepto de "restricciones conformacionales" es una reconocida estrategia metodológica en química médica para "congelar" las conformaciones bioactivas de compuestos farmacológicamente activos, que permite la optimización de factores entrópicos así como el incremento de la potencia, selectividad y duración del efecto terapéutico. Esta estrategia permitió la obtención de pirazoles policíclicos, serie NESS con mayor rigidez molecular tridimensional y potenciado efecto como ligando de receptores CB1 y CB2.25
En este contexto es necesario considerar el concepto de "estructuras patrón" (scaffold hopping) que ha incentivado la búsqueda de NEQ y NEF. El scaffold hopping es un concepto básico de la química medica que se basa en la comparación computacional (2D- y 3D) de patrones moleculares que permite la generación de compuestos con diferentes fragmentos estructurales tipo bioisósteres (compuestos con diferentes fragmentos moleculares pero similar actividad biológica).26 Derivados bioisósteres para ligandos de receptores CB1 y CB2 han sido descritos profusamente en la literatura de patentes durante 2003-2006 por reconocidas compañías farmacéuticas (Merck, Solvay, Bayer, AstraZeneca, Sanofi-Aventis, Roche, Pfizer), cuyas las estructuras básicas son: 1,1-diarilimidazoles; diariltiazoles; triazoles; derivados terfenílicos; piridínicos; pirimidínicos y aminotetrahidroquinolinas.27
APLICACIONES TERAPÉUTICAS
Las propiedades medicinales del cannabis han sido descritas y utilizadas hace más de 5000 años y los efectos secundarios psicotrópicos han constituido los principales argumentos en contra de su aplicabilidad con fines terapéuticos. El problema fundamental, asociado al tratamiento con canabinoides, radica en la imposibilidad actual de separar los efectos terapéuticos de los secundarios sin significación clínica relacionados con la activación de los receptores CB1 localizados en el SNC. Para el tratamiento de afecciones periféricas la estrategia puede ser el diseño de compuestos selectivos capaces de actuar en los otros componentes del SCE -como el receptor CB2- o bien con agentes incapaces de atravesar la barrera hematoencefálica, es decir, incapaces de actuar en el SNC y que solo activen los recetores CB1 periféricos, que, en general, minimicen los efectos psicotrópicos. Análogamente, estrategias similares serían la administración de inhibidores del transportador o de la enzima FAAH; de este modo se lograría actuar directamente sobre la desregulación fisiológica del SCE que provoca la afección consiguiendo un retorno a los niveles normales de endocanabinoides sin necesidad de recurrir a la activación directa del receptor CB1 responsable de esos efectos indeseables. Sin embargo, en la actualidad se han reportado numerosos estudios que demuestran la capacidad neuroprotectora de los endocanabinoides, asociado principalmente a sus propiedades antioxidantes, antiinflamatorias, antiglutamatérgicas, antiapoptóticas, entre otras y que involucran a los receptores CB1 a nivel central; esta capacidad neuroprotectora puede ser la base para el diseño de nuevos medicamentos eficaces para el tratamiento de enfermedades neurodegenerativas y/o neuropsiquiátricas, en este sentido, modificaciones químicas de sistemas canabinóicos naturales o empleo de estructuras análogas dirigidas a minimizar los efectos colaterales indeseables y potenciar los efectos terapéuticos, puede y debe ser un reto inmediato para los químicos, botánicos, biólogos, farmacólogos, bioquímicas, bioinformáticas y toxicólogos de nuestros tiempos.
La polémica actual sobre la idoneidad y eficacia de nuevos agentes canabinoides sintéticos para el tratamiento de numerosas enfermedades ha puesto de manifiesto la necesidad de obtener nuevos compuestos capaces de interferir, de forma potente y selectiva, con los distintos constituyentes del SCE. La administración de canabinoides ha demostrado efectividad terapéutica en el tratamiento de glaucoma, asma bronquial, ciertos trastornos motores y diversas enfermedades neurodegenerativas.13 Asimismo, es notable su capacidad para inhibir la emesis -asociada a terapias antitumorales- y aumentar el apetito,13 como agentes analgésicos y antinociceptivos12 e incluso su potencial utilidad para inhibir el crecimiento neoplásico de ciertos tumores.28
En la actualidad es objeto de estudios la posibilidad de utilización de inhibidores del sistema de recaptación de anandamida en el tratamiento de la esclerosis múltiple y el corea de Huntington;29 de agonistas CB2 como inhibidores del crecimiento de gliomas;19 de agonistas CB1 -en administración local y periférica- para tratar el glaucoma así como antagonistas CB1 con objeto de reducir la disquinesia provocada por la administración de L-dopa en pacientes con enfermedad de Parkinson y obtener una mejora de las disfunciones cognitivas producidas por la enfermedad de Alzheimer.13
La enorme importancia del SCE como diana terapéutica para el tratamiento de una amplia variedad de enfermedades constituye una novedosa estrategia, mediante la administración de compuestos sintéticos capaces de mimetizar, antagonizar o regular la biosíntesis e inactivación de los endocanabinoides, para el tratamiento de enfermedades de elevada incidencia y que suponen unas de las principales causas de muerte e invalidez en la sociedad contemporánea.
PERSPECTIVAS FUTURAS
Las perspectivas futuras en la temática de los canabinoides se centran en su potencial de aplicabilidad terapéutica. Hasta la fecha solo se ha autorizado la prescripción médica de 2 canabinoides, ambos indicados en el tratamiento de la emesis inducida por quimioterapia. Estos 2 fármacos comercializados en USA y Reino Unido como Marinol® y Cesamet® respectivamente son el dronabinol y la babilona, el primero es D 9-THC en aceite de sésamo y el segundo un análogo sintético de este que contienen un grupo carbonilo en el carbono 9, lo que le confiere un importante efecto antiemético. Dado que el uso medicinal de canabinoides ha estado restringido al dronabinol y la nabilona, las investigaciones actuales proponen una utilización más amplia de los canabinoides y sus análogos iso-estructurales, con el objetivo de optimizar todas sus posibles aplicaciones terapéuticas. Como consecuencia es preciso potenciar la investigación en este campo, tanto desde un punto de vista básico como aplicado; en el primer caso orientando hacia la comprensión de los mecanismos de regulación centrales y periféricos en que este sistema endógeno esta implicado; y en el segundo, para posibilitar el desarrollo de nuevos fármacos agonistas, antagonistas e inhibidores selectivos con una funcionalidad predeterminada para su uso terapéutico racional sin efectos colaterales adversos, cuyo objetivo final sería generar nuevas y fiables estrategias terapéuticas para el tratamiento y curación de un amplio rango de enfermedades, algunas de las cuales no poseen, en la actualidad, ningún tipo de terapia y para las que los canabinoides naturales y sintéticos, así como sus análogos bioisósteres naturales podrían representar el desarrollo de unprometedor tratamiento en un futuro cercano.
REFERENCIAS BIBLIOGRÁFICAS
1. Duran M, Laporte JR, Capellà D. Novedades sobre las potencialidades terapéuticas del Cannabis y el sistema cannabinoide. Med Clin (Barc). 2004;122(10):390-8.
2. Castellarte SL. Cannabis y cannabinoides: Farmacología, toxicología y potencial terapéutico. [s.l.]. 2003. p. 537
3. Russo E, Guy GW. A tale of two cannabinoids: The therapeutic rationale for combining tetrahydrocannabinol and cannabidiol. Medical Hypotheses. 2006;66:234-46.
4. Porter AC, Felder CC. The endocannabinoid nervous system: Unique opportunities for therapeutic interventions. Pharmacol Ther. 2001;90:45-60.
5. Mechoulam R. Endogenous cannabinoid ligand-chemical and biological studies. J Lipid Mediat Cell Signal. 1996;14:45-9.
6. Hanus L. 2-arachidonyl glyceryl ether, an endogenous agonist of the cannabinoid CB1 receptor. Proc Natl Acad Sci (USA). 2001;98:3662-5.
7. Sarne Y, Mechoulam R. Cannabinoids: Between Neuroprotection and Neurotoxicity. Curr Drugs Tragets-CNS & Neurolog Dis. 2005;4:677-84.
8. Giuffrida A. Mechanisms of endocannabinoid inactivation: biochemistry and pharmacology. J Pharmacol Exp Ther. 2001;298;7-14.
9. Howlett AC. Cannabinoid physiology and pharmacology: 30 years of progress. Neuropharmacol. 2004;47;354-8.
10. Fernandez-Ruiz IJ, Berrebdero F, Hernandez ML, Ramos JA. The endogenous cannabinoid system and brain development. Trends Neurosc. 2000;23:14-20.
11. Di Marzo V. The endocannabinoid system and its therapeutic application. Nat Rev Drugs Discov. 2004;410:822-5.
12. Hertzog DL. Recent advances in the cannabinoids. Expert Opin Ther Patents. 2004;14:1435-52.
13. Benavides J. et al, Combination of CB1 ligands and their use in the treatment of Parkinson's disease US Patent 0209861. 2004.
14. Piomelli D. The endocannabinoid system as target for therapeutic drugs. Trends Pharmacol Sci. 2000; 21:218-24.
15. Ramos Atance JA, Fernando-Ruiz J. Canabinoides: propiedades químicas y aspectos metabólicos. Adicciones. 2000;12( Supl. 2):41-56.
16. Gurwitz D, Weizman A. Fatty acid amide hydrolase inhibitors and the marijuana debate. Lancet. 2001;358:1548.
17. López-Rodríguez ML. Inhibidores araquidónicos de CB1-CB2 Patent EP200001920. 2000.
18. Barth F, Rinaldi-Carmona M. The Development of cannabinoid antagonists. Curr Med Chem. 1999;6:745-55.
19. Huffman JW. Cannabimimetic indoles, pyrroles and indenes. Curr Med Chem. 1999;6:705-20.
20. Regio PH. The bioactive conformation of aminoalkylindoles at the cannabinoid CB1 ad CB2 receptors. J Med Chem. 1998;41:5177-587.
21. Lan P. Structure-activity relationship of pyrazole derivatives as cannabinoid receptor antagonists. J Med Chem. 1999;42:769-76.
22. Miscoria G. Pyrazole-3-carboxamide derivatives the preparation and therapeutic uses thereof WO Patent 2004/058744.
23. Sakya SM. Cannabinoid receptor ligands and uses thereof WO Patent 2004/099157-2004.
24. Lange JHM. Synthesis and molecular modeling of novel 3,4-diarylpyrazolines as potent and selective CB1 cannabinoid receptor antagonists. J Med Chem. 2004;47:627-43.
25. Mussinu J. Tricyclic Pirazoles Part 1. Ligands for CB1 and CB2 cannabinoids receptors. Bioorg Med Chem. 2003;11:251-63.
26. Jenkins JL. A 3D similarity method for scaffold hopping from knows drugs or natural ligands to new chemotypes. J Med Chem. 2004;47;6144-59.
27. Lange JMH, Kruse C. Medicinal chemistry strategies to CB1 cannabinoid receptors ligands. Drug Discovery Today. 2005;10(10):693-702.
28. Pertwee RG. Novel pharmacological targets for cannabinoids. Curr Neurophrmacol. 2004;2:9-29.
29. Grotenhermen F. Cannabinoids. Curr Drugs Tragets-CNS & Neurolog Dis. 2005;4:507-30.
Recibido: 25 de abril de 2008.
Aprobado: 2 de junio de 2008.
Dr. C. Juan E. Tacoronte Morales. Centro de Ingeniería e Investigaciones Químicas. Vía Blanca s/n entre Infanta y Palatino, municipio Cerro, La Habana, Cuba. Código Postal 12 000. Correo electrónico: jmorales@ciiq.minbas.cu














