Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.1 Ciudad de la Habana ene.-abr. 2009
ARTÍCULOS ORIGINALES
Glicinato de cobre: una aproximación a su solubilidad
Copper glycinate: an approach to its solubility
Gloria Elena Tobón ZapataI; Julie Fernanda Benavides ArevaloII; Oscar Albeiro Flórez AcostaIII
IDoctora en Química. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín, Colombia.
IIQuímico Farmacéutico. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín, Colombia.
IIIEspecialista en Producción Farmacéutica. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Se estudian los isómeros cis y trans del glicinato de cobre, como parte de un proyecto que pretende elaborar un suplemento nutricional con oligoelementos esenciales, considerando los factores que afectan la disolución y por lo tanto, la biodisponibilidad de los complejos. Con el fin de encontrar, en una etapa temprana de la formulación, una relación entre el proceso de disolución y algún parámetro de medida independiente del tamaño de partícula, se evalúan los descriptores: circularidad, diámetro de feret, área, perímetro y dimensión fractal. Los que menor variación presentan son: circularidad y dimensión fractal, esta última puede relacionarse con el proceso de disolución calculando 2 propiedades relacionadas: la dimensión fractal superficial y la dimensión fractal reactiva. Este trabajo demuestra que en los complejos de glicinato de cobre a mayor tamaño de partícula la velocidad de disolución es mayor si existen grietas en la superficie, lo que se evidencia en una dimensión fractal reactiva mayor que .una dimensión fractal superficial
Palabras clave: Tamaño de partícula, descriptores de forma, perfil de disolución, solubilidad, dimensión fractal, glicinato de cobre.
ABSTRACT
Isomers cis and trans of copper glycinate, as part of a project trying to make a nutritional supplement using essential oligoelements , considering the factors affecting dissolution, and thus, complexes bioavailability. During an early stage of formula, to find a relationship between dissolution process and some measurement parameter regardless of particle size, we must to evaluate following descriptors: circulation rate, feret diameter, area, perimeter, and fractal dimension. Those of a lower variation are: circulation rate and fractal dimension, this latter may be linked with dissolution process calculating two related properties: superficial and reactive fractal dimensions. This paper showed that in copper glycinate complexes, when the particle has a greater dimension, dissolution speed is greater too if there are superficial cracks, evident in a reactive fractal dimension greater than a superficial one.
Key words: Particle size, shape descriptors, dissolution profile, solubility, fractal dimension, copper glycinate.
INTRODUCCIÓN
La falta de un adecuado de consumo de minerales en la dieta diaria puede tener efectos graves sobre la salud y tiene impacto en los índices de morbilidad y mortalidad, especialmente en los países en vía de desarrollo. Este trabajo hace parte de una propuesta, con la que se busca formular un suplemento alimenticio que contenga oligoelementos esenciales unidos a ligandos que mejoren la tolerancia al tratamiento, y que permitan su absorción, para brindar una alternativa en la suplementación de elementos cuya deficiencia afecta la población vulnerable. El consumo de cobre (Cu) en cantidades apropiadas es esencial para el buen funcionamiento cerebral, del sistema nervioso, de los huesos y para garantizar el transporte del hierro en la formación de la hemoglobina, ya que su carencia es una de las principales causas de anemia.1,2 La suplementación de oligoelementos comúnmente se realiza en su forma inorgánica: cloruros, óxidos, carbonatos y sulfatos; estas sales inorgánicas se han relacionado con efectos adversos en la absorción y aprovechamiento metabólico de los oligoelementos, mientras que los complejos (ion metálico unido a un ligando orgánico) aumentan la biodisponibilidad de oligoelementos como el Cu; algunos autores sugieren que esto se debe a un mecanismo de absorción diferente -el mismo mecanismo de los péptidos y aminoácidos -, o a mecanismos de absorción alternos.3
El tamaño de las partículas influye en la solubilidad y la velocidad de disolución de los sólidos, lo que a su vez afecta la biodisponibilidad, estabilidad, reología y uniformidad de contenido de la forma farmacéutica final.4 En el proceso de disolución influyen también las propiedades fisicoquímicas de los grupos funcionales de la superficie, la distribución de sitios activos superficiales y la geometría de esta.5 Los aspectos relacionados con el tamaño y la distribución de partículas están bien definidos por la teoría y son aceptados como criterios universales, pero el problema de la forma aun causa controversia en las mediciones; las aproximaciones a la forma incluyen fórmulas sencillas como la relación de aspecto, relación de elongación, circularidad y redondez; existen además otros métodos como el análisis de fourier y la dimensión fractal.6 En este trabajo se obtienen imágenes bidimensionales, mediante microscopia óptica, por ello se realiza una estimación de la morfología mediante descriptores de diámetro (diámetro de feret y circularidad), también se calcula el área, perímetro y dimensión fractal de las partículas. La circularidad da una idea de la rugosidad del contorno y también de la elongación de una partícula, un valor de uno significa partículas esféricas y de contorno liso, mientras más se acerque a cero la partícula se torna más rugosa e irregular.7 La expresión de Mandelbrot de dimensión fractal (D) se emplea para describir la morfología de una partícula; la autosimilitud (repetición de detalles a diferentes escalas) es una característica importante de los fractales.8,9 A partir de D es posible obtener la dimensión fractal de superficie (Ds), que describe el grado de irregularidad de una partícula. Cuando Ds se aproxima a 2, las partículas se consideran de contorno no rugoso.10 Para calcular la Ds en este estudio, se emplea el método propuesto por Farin y otros,11 según el cual Ds= D + 1. Ya que la D es un descriptor alternativo de la forma de las partículas y una medida de la geometría de la superficie no restringida a una escala de longitudes, puede emplearse para describir el grado de irregularidad que presenta la partícula y su similitud con otra de tamaño diferente, esta similitud entre diferentes tamaños de partícula es útil para describir el proceso de disolución de un compuesto mediante la comparación de su propiedad derivada, Ds, con la dimensión fractal reactiva (DR).6,11,12 DR permite definir la dimensión de la partícula que entra en contacto con el medio durante el proceso de disolución, a través de la ecuación: DR= 3 - m,12 donde m es la pendiente obtenida al graficar el logaritmo natural de la eficiencia de la disolución (Ed) vs. el logaritmo natural del tamaño promedio de las fracciones de las partículas.11 Ed13 es un parámetro amodelístico obtenido experimentalmente realizando un perfil de disolución para cada fracción.
MÉTODOS
Obtención del cis y trans glicinato de cobre y determinación del contenido de cobre
Para la síntesis del cis y trans glicinato de cobre se empleó glicina 98,5 % (SIGMA-ALDRICH), acetato de cobre (II) (MERCK) y etanol grado reactivo (MERCK). 0,01 mol de acetato de cobre se disolvieron en 25 mL de agua desionizada, posteriormente se adicionaron 25 mL de etanol y 0,02 mol de glicina disueltos en 25 mL de agua desionizada (manteniendo una temperatura de 30 ºC). Se agitó durante una hora a 70 °C, la solución se enfrió en un baño de hielo para hacer precipitar los cristales del cis glicinato de cobre. A partir de este isómero se obtuvo la forma trans por calentamiento a 170 °C durante 1 h.14
El contenido de cobre se determinó mediante volumetría con tiosulfato de sodio y también por espectroscopia ultravioleta, por formación de un complejo con amoniaco [Cu(NH3)4], que absorbe a 636 nm.
Caracterización de los complejos
El espectro infrarrojo en KBr se midió en un espectrofotómetro por transformada de Fourier marca Perkin Elmer, entre 4 400 y 450 cm-1; los estudios de calorimetría de barrido diferencial (DSC), del ligando libre y de los complejos se realizaron en un calorímetro DSC 200 PC-phox, marca Netzsch, en un intervalo de 25 a 500 a 10 °C/min, con el empleo crisoles de aluminio.
Análisis de imágenes y ensayos de disolución
Las microfotografías se obtuvieron con un microscopio trinocular adaptado a un computador con cámara digital, de diseño propio y validado,15 con un aumento de 40x. Las imágenes se digitalizaron con el software Imagen,16 con una resolución de 320 x 240 pixeles, procesando 100 proyecciones de las partículas tomadas aleatoriamente. Las mediciones de los factores de forma y dimensión fractal se obtienen con el mismo software. Los ensayos de disolución se realizaron en un equipo disolutor tipo II (paletas), para lo cual se utilizaron aproximadamente 180 mg de muestra en 900 mL de HCl 0,1N, a 75 r·m-1 y a 37 °C; las concentraciones se determinaron mediante espectrofotometría UV. Las muestras para la realización del perfil de disolución de cada fracción se tomaron a intervalos de 1 min durante 5 min (tiempo previamente establecido como el de máxima disolución). Los cálculos, la simulación de las gráficas y la verificación de su aproximación se realizaron con el programa MATLAB.17 DR se calcula con el programa Excel.
RESULTADOS
El promedio del contenido de cobre para el isómero cis del glicinato de cobre fue de 26,9 % por volumetría y de 26,8 % por espectroscopia; para el isómero trans el contenido promedio de cobre fue de 30,3 % por ambos métodos.
Caracterización de los complejos
En el espectro IR los estiramientos antisimétrico y simétrico del grupo carboxilo ionizado de la glicina están en 1 610 y 1 413 cm-1 respectivamente; en el espectro de los isómeros trans y cis del glicinato de cobre se observa el desplazamiento de estas bandas, y una gran complejidad en la región de los estiramientos N-H. El DSC de la glicina presenta 3 picos: endotérmico en 35 °C, exotérmico en 75,0 °C, y endotérmico en 256.4 °C (atribuido al punto de fusión). En el isómero cis se observa 1 pico exotérmico en 280,2 °C y 2 2 endotérmicos entre 50 y 110 °C. En el isómero trans el pico primer pico (exotérmico) aparece aproximadamente a 280 °C y le siguen otros 3 picos exotérmicos entre 283,7 y 326,4 °C.
Análisis de partículas y ensayos de disolución
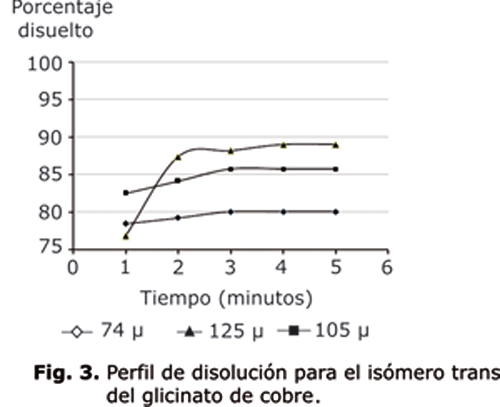
La figura 1 muestra las microfotografías del cis y trans glicinato de cobre. Los tamaños promedio de las 3 fracciones del isómero cis son de 149, 177 y 250 µ, y de 74, 105 y 125 µ para el isómero trans. Después de analizar cada partícula en forma independiente, se obtienen los promedios por fracción para cada parámetro que se muestran en las tablas 1 y 2. Los ensayos de disolución se realizan por duplicado, para cada isómero y fracción, los resultados promedio se muestran en las figuras 2 y 3.
DISCUSIÓN
La deficiencia de Cu se relaciona con procesos de osteoporosis, osteoartritis, desordenes cardiovasculares en adultos y en niños con anemia, retraso en el crecimiento, infecciones frecuentes y coordinación deficiente. La deficiencia de cobre puede prevalecer, aun con la suplementación de Cu, debido a su baja absorción siendo la disolución un factor determinante; se ha demostrado que la solubilidad de los complejos de Cu es mejor que la de sus sales inorgánicas, lo que resulta en un incremento significativo en la concentración sanguínea de Cu.3
De acuerdo con el porcentaje de cobre el isómero cis contiene 1,5 mol de agua [(gly)2 Cu 1,5 H2O], mientras que el isómero trans, al parecer, no contiene moléculas de agua ligadas, lo que está de acuerdo con lo reportado.14 En el espectro IR de ambos isómeros, el desplazamiento de las bandas atribuidas a los estiramientos antisimétrico y simétrico del grupo carboxilo evidencia la complejación con el cobre, adicionalmente la separación de estas bandas es mayor con respecto al ligando libre (220 trans y 213 cis), lo que supone una coordinación monodentada a través de ese grupo del tipo: M-O-C=O. La región de los estiramientos N-H es compleja debido a la presencia del agua y al ensanchamiento de las bandas debido a los puentes de hidrógeno; esta complejidad es más notoria en el complejo cis que además presenta un mayor número de bandas que el isómero trans, como se espera de acuerdo con las consideraciones de simetría, el espectro IR de los isómeros no difiere con los ya reportados.18
En el DSC del isómero cis el pico exotérmico en 280,2 °C se atribuye a la descomposición de la glicina en un solo paso, mientras que los 2 picos endotérmicos aproximadamente entre 50 y 110 °C, se deben a la pérdida de agua presente en la molécula; el DSC del isómero trans no muestra picos atribuibles a la pérdida de agua, y la descomposición se da en varias etapas.
Análisis de partículas y ensayos de disolución
De los parámetros analizados los únicos que presentan variaciones mínimas son la circularidad y la dimensión fractal. Examinando estos 2 parámetros para el isómero cis, se observa que la circularidad presenta un valor cercano a 0,29 para todas las fracciones, lo que está de acuerdo con su forma alargada. La dimensión fractal presenta un valor diferente para las partículas de 250 µ, por lo tanto no hay autosimilitud. Contrario a esto, las partículas del isómero trans muestran variabilidad en los valores de circualridad, sin embargo, el valor obtenido (entre 0,74 y 0,8) refleja su forma cúbica; estas partículas son autosímiles con D= 1,5, por lo tanto es posible determinar un valor único de Ds que corresponde a 2,5.
Con respecto a la disolución, los 3 tamaños del isómero trans presentan una tendencia similar, comenzando con un alto porcentaje de disolución en el tiempo 1, mayor del 75 %, para todas las fracciones con un máximo de 89 % para la fracción de 125 µ, y de 80 % para la fracción de menor tamaño en el tiempo final. Los porcentajes de disolución iníciales para el isómero cis son más bajos (entre el 56 y 66 %), pero con mayor porcentaje disuelto en el tiempo final, llegando aproximadamente al 99 % para las partículas de 177 µ.
Se espera mayor velocidad de disolución para las partículas pequeñas, por tener mayor área superficial expuesta, esta consideración no se cumple para ninguno de los isómeros estudiados; con respecto al isómero trans se observa un comportamiento inverso al esperado (a mayor tamaño, mayor disolución), y para el isómero cis el tamaño intermedio (177 µ) presenta un mayor porcentaje disuelto al tiempo final.
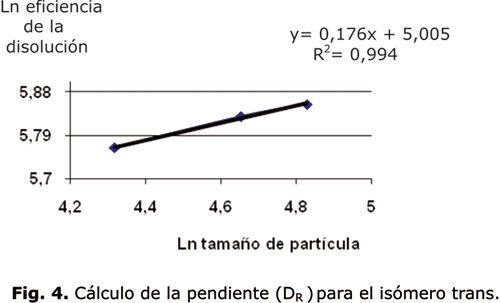
Para el isómero cis no es posible asignar un valor de Ds igual a todas las fracciones debido a que no son autosímiles, por lo que se excluye esta forma del cálculo de DR. Para el isómero trans DR tiene un valor de 2,8238 (fig. 4), que es mayor que el Ds calculado (2,5), lo que implica que el proceso de disolución ocurre selectivamente en grietas superficiales de la partícula donde se generan poros.10
DR involucra información útil para describir los procesos de disolución, en el caso de partículas Brownianas en la disolución influye el movimiento browniano vigoroso y sus valores característicos son: 1,0 £ DR £ 2,0; durante la disolución de partículas no brownianas, la velocidad de choque con las partículas de los alrededores describe la típica disolución fractal, 2,0 £ DR £ 3,0.19 El hecho de que DR sea mayor que Ds implica una reacción heterogénea compleja, si la superficie fuera lisa el proceso de disolución ocurriría en la superficie y no existirían poros o grietas, esto se reflejaría en una DR menor que Ds.
De los parámetros analizados, la circularidad y D reflejan la morfología de la partícula, independientemente del tamaño estos parámetros son los más adecuados para describir la morfología de una partícula. D permite calcular parámetros relacionados, siempre que exista autosimilitud, siendo los valores correspondientes a Ds y DR los de mayor utilidad para la descripción del proceso de disolución.
Este trabajo corrobora la hipótesis de que la eficiencia de un proceso de disolución puede incrementarse aumentando el tamaño de la partícula siempre que existan grietas en su superficie,10 es decir, cuando DR es mayor que Ds, como ocurre para el isómero trans del glicinato de cobre en el cual la superficie real de reacción no se corresponde con el tamaño de la partícula.
Los parámetros de área o diámetro no describen la forma en la que se lleva a cabo un proceso tan complejo como la disolución de las partículas, tampoco D por si misma cumple con este propósito, se requiere el cálculo de sus parámetros relacionados para lograr una descripción del proceso de disolución. Si bien el isómero trans presenta mayor porcentaje disuelto al inicio de la disolución que el isómero cis, al tiempo final este último alcanza un porcentaje de disolución mayor del 90 %, para los 3 tamaños estudiados, llegando casi al 99 % para las partículas con tamaño promedio de 177 µ; lo que hace que el isómero cis sea el más adecuado para la suplementación de cobre, con respecto a las partículas del isómero cis el tamaño óptimo está entre 177 y 250 µ (fig. 2), ya que con ellos se obtiene una disolución del 99 y 96 %, respectivamente, al tiempo final (5 min).
AGRADECIMIENTOS
Los autores agradecen al Comité para el Desarrollo de la Investigación (CODI) la financiación del proyecto que origina este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Prohaska JR. Changes in Cu, Zn- superoxide dismutase, cytocrome c-oxidase, glutathione peroxidase and glutathione transferase activities in copper-deficient mice and rats. J Nutr.1991; 121:355-63.
2. Harris E. Basic and Clinical Aspects of Copper. Crit Rev Clin Lab Sci. 2003; 40(5):247-86.
3. Novotný J, Pisti J, Eliás D, Seidi H, Kovác G, Bobcek R. Effects of diet supplemented with some trace elements on the concentration of the elements and immune indices in pigs. Bull Vet Inst Pulawy. 2003;47:559-66.
4. Carstensen Jens T. Advanced Pharmaceutical Solids. vol 110. New York: Ed. Marcel Dekker, Inc.; 2001. p. 61-85.
5. Huang Lian-Feng, Tong Wei-Qin. Impact of solid state properties on develop ability assessment of drug candidates. Adv Drug Delivery Rev. 2004;56:321-34.
6. Albertini B, Cavallari C, Passerini N, Gonzáles-Rodriguez ML, Rodríguez L. Evaluation of b-lactose, PVP K12 and PVP K90 as excipients to prepare piroxicam granules using two wet granulation techniques. Eur J Pharm Biopharm. 2003;56:479-8.
7. Bouwmana AM, Bosmaa JC, Vonkb P, Wesselinghc JA, Frijlinkd HW. Which shape factor(s) best describe granules? Powder Technology 2004;146:66-72
8. Herzfeld U, Overbeck C. Analysis and simulation of scale dependent fractal surfaces with application to seafloor morphology. Computers Geosciences 1999; 25:979-1007.
9. Russ J. Fractal surfaces. New York: Plenum; 1994. p. 18-9; 120-37.
10. Holgado MA, Fernández-Arévalo MJ, Tabasco AM. Use of fractal dimensions in the study of excpients: application to the characterization of modified lactoses. Intern J Pharmaceutics. 1995; 121:187-93.
11. Farin D, Avnir D, Reactive Fractal Surface. J Phys Chem. 1987; 91:5517-21.
12. Farin D, Avnir D. Use of fractal geometry to determine effects of surface morphology on drug dissolution. J Pharm Sci. 1992; 81:54-7.
13. Boza Rivera A, González Hernández R, Novoa de Armas H, Cuellar Alizastegi D, Valdés Losada M. Physicochemical and solid-state characterization of secnidazole. Il Farmaco. 2000; 55:700-7.
14. O´Brien P. The preparation and characterization of the geometric isomers of a coordination complex: cis- and _trans glycinato copper complex (II). J Chem Educ. 1982;59-12:1052-3.
15. Florez O, Tobón G, Baena J. Validación de la técnica de análisis del tamaño de partículas mediante un microscopio de luz óptica asistido por un computador personal. Rev Vitae. 2002;9(1):43-50.
16. Rasband WS. Software ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, 1997-2007.
17. Programa MATLAB17 versión 5.3.0.10183 (r11), 21 Junio, 1999
18. Nakamoto K. Infrared and raman spectra of inorganic and coordination compounds. 4th ed. New York: John Wiley and Sons; 1986. p. 231-4.
19. Momonaga M, Stávek J, Ulrich J. Interpretation of dissolution rates by the reation fractal dimensions. J Crystal Growth. 1996;166:1053-7.
Recibido: 5 de octubre de 2008.
Aprobado: 6 de noviembre de 2008.
Dra. Gloria Elena Tobón Zapata. Universidad de Antioquia. Facultad de Química Farmacéutica. Departamento de Farmacia. AA 1226, Ciudad Universitaria, oficina 1-157. Medellín, Colombia. Correo electrónico: getobon@farmacia.udea.edu.co