Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.2 Ciudad de la Habana Mayo-ago. 2009
PRODUCTOS NATURALES
Validación de puntos críticos de la producción de Surfacen®
Validation of critical features of Surfacen production®
Yamilka Riverón AlemánI; Nivian Montes de Oca MartínezII; María del Carmen Travieso NovellesIII; Wilma Alfonso LorenzoIV; Elaine Díaz ValiñoV; Danay Gónzalez GarcíaVI; Amalia Nuñez DrakeVII; Alejandra Villoch CambasVIII
ILicenciada en Microbiología. Máster en Ciencias. Centro Nacional de Sanidad Agropecuaria (CENSA). La Habana, Cuba.
IIDoctora en Ciencias. Licenciada en Microbiología. CENSA. La Habana, Cuba.
IIIDoctora en Ciencias. Licenciada en Farmacia. CENSA. La Habana, Cuba.
IVLicenciada en Farmacia. Máster en Ciencias. CENSA. La Habana, Cuba.
VDoctora en Ciencias. Ingeniera Química. CENSA. La Habana, Cuba.
VIIngeniera Química. CENSA. La Habana, Cuba.
VIIEspecialista en Microbiología. CENSA. La Habana,. Cuba.
VIIIDoctora en Farmacia. Licenciada en Farmacia. CENSA. La Habana, Cuba.
RESUMEN
El Surfacen® es un medicamento utilizado en el tratamiento del síndrome de dificultad respiratorio del recién nacido, causa importante de mortalidad y morbilidad neonatal. Este se fabrica en el Centro Nacional de Sanidad Agropecuaria (La Habana, Cuba) bajo un Sistema de Gestión de la Calidad y Buenas Prácticas de Fabricación. El pulmón porcino constituye la materia prima fundamental, y es a partir de su calidad microbiológica y la del proceso productivo que se garantiza un producto final libre de contaminantes microbianos y de pirógenos. A partir del diseño de protocolos específicos y de las regulaciones existentes se demostró que la crianza de cerdos, su proceso de sacrificio y los materiales utilizados en la obtención de los lavados pulmonares, permiten alcanzar una calidad microbiológica definida y bajo control. El proceso de producción fue capaz de eliminar la carga microbiana presente en los lavados pulmonares que junto al resto de las operaciones de preparación de materiales estériles, su traslado, uso, al igual que la limpieza y desinfección de las áreas limpias, el llenado aséptico y el personal garantizaron la esterilidad del producto final. Todos estos resultados permiten concluir que los procesos críticos de la producción de Surfacen® están validados y garantizan que este sea estéril, libre de pirógenos y sin residuales tóxicos, lo que demuestra su seguridad, reproducibilidad y consistencia.
Palabras clave: Surfacen®, surfactante pulmonar, síndrome de dificultad respiratorio del recién nacido, validación de procesos, fosfolípidos, producto natural, pulmón de cerdo.
ABSTRACT
Surfacen® is a drug used in treatment of newborn respiratory distress syndrome, a significant cause of neonatal mortality and morbidity. This drug is manufactured by National Center of Farming and livestock Hygiene (La Habana, Cuba) under a Management System of Quality and Good Practices of Manufacture. Pig lung is the essential raw material, and it is from microbiologic quality and that of productive process, that a free of microbial contaminant and pyrogen end product is guaranteed. From design of specific protocols and of the available regulations, it was demonstrated that pig breeding, its sacrifice process, and materials used in achievement of lung lavages, allow us to obtain a defined microbiologic quality and under control. Production process was able to eliminate microbial charge present in lung lavages, which together with the remainder preparation tasks of sterile materials, its transfer, use, as well as cleaning and disinfection of clean areas, the aseptic filling, and staff guaranteed sterility of end product. All these results allow us to conclude that the critical processes of Surfacen® production are validated and guarantee that this one be sterile, pyrogen-free, and without toxic residuals, demonstrating its safety, reproducibility and consistence.
Key words: Surfacen®, lung surfactant, newborn respiratory distress syndrome, processes validation, phospholipid, natural product, pig lung.
INTRODUCCIÓN
El Surfacen® es un medicamento utilizado en el tratamiento del síndrome de dificultad respiratorio del recién nacido (SDRN), causa importante de mortalidad y morbilidad neonatal. Se caracteriza por ser un extracto orgánico obtenido del lavado pulmonar de cerdos, que contiene aproximadamente un 93 % de fosfolípidos y 1 % de proteínas de peso molecular pequeño.1 Todo el proceso de producción se realiza bajo rigurosos requisitos de calidad para garantizar no solo la efectividad del medicamento sino su seguridad. A la par de la producción se ha desarrollado un sistema de gestión de la calidad con énfasis en el cumplimiento de las Buenas Prácticas de Fabricación (BPF).
El pulmón porcino constituye la materia prima fundamental de este producto, y es a partir de la calidad microbiológica de este y del proceso productivo que se garantiza un producto final libre de contaminantes microbianos y de pirógenos. En su obtención se involucran varios procesos donde intervienen 4 áreas de crianza de cerdos que aplican con rigurosidad los requisitos del Manual de Crianza Porcina.2
El proceso de producción de Surfacen®se divide en una fase no aséptica y otra aséptica. La primera se caracteriza por operaciones de centrifugación, extracción y purificación con el uso de solventes orgánicos, y la segunda cuenta con una etapa de filtración, eliminación de los solventes, llenado y liofilización.3
En todos los procesos antes mencionados existe riesgo de contaminación microbiana y por consiguiente, una fuente de presencia de pirógeno, elementos indeseables en este producto liofilizado e inyectable. Teniendo en cuenta los requisitos del producto se propone demostrar la seguridad del proceso a través de la validación de todos los puntos críticos del proceso de producción del Surfacen®.
MÉTODOS
Validación del proceso no aséptico
- Caracterización microbiológica de lavados pulmonares de cerdos:
Muestras: agua, recipientes y solución salina (triplicado), lavados pulmonares de cerdos (30; 2 mataderos). Métodos: determinación de unidades formadoras colonias por mililitro: Límite microbiano.4 Determinación de pirógenos: LAL (Lisado de Amebocitos de Limulus).4 Aislamiento e identificación de agentes causales de neumonías en cerdos: Mycoplasma spp.;5 Pasteurella multocida, Streptococcus suis tipo 2,6 síndrome respiratorio y reproductivo del cerdo, el virus de la influenza porcina, el virus de la enfermedad de Aujeszky y el circovirus porcino tipo II.7 Análisis estadístico: ANOVA para la comparación entre mataderos y cartas de Shewart.8
- Evaluación de la capacidad del proceso de inactivar o eliminar bacterias, hongos:
Muestras M1: producto del extracto orgánico, M2: producto de la precipitación y M3: producto después de la filtración. Preparación de la muestra: a 5 mL de las muestras sin diluir se le añadió 1mL con 108 UFC/mL de las cepas de Aspergillus niger (ATCC 16404), Bacillus subtilis (ATCC 6633) y Acholeplasma laidlawii (R-10) por separado. Se tomó 1 mL y se depositó en un tubo con triptona soya caldo (TSC) y en placas con triptona soya agar (TSA) y agar sabouraud maltosa (ASM). Método: siembra por placa vertida (48 h a 37 °C y 7 d a 25 °C respectivamente).4 Interpretación de los resultados: las muestras que no permitieron el crecimiento microbiano se le realizaron diluciones y se repitió el procedimiento. A partir de la dilución que permitió el crecimiento se determinó la presencia o no de microorganismos en las muestras M1, M2 y M3.
Validación del proceso aséptico
- Preparación de los materiales y su traslado:
Muestras: de 4 bandejas que contenían 220 bulbos, se tomaron de forma aleatoria 40 bulbos y 40 tapones de cada una. Método: prueba de esterilidad.4 Momento de evaluación: antes de la salida de las instalaciones donde se realiza su preparación y a la llegada a la planta de producción. Este ensayo se realizó por triplicado.
- Limpieza y desinfección de las áreas limpias:
Muestras: aire y superficie. Métodos: placas expuestas, placas de contacto Rodac e hisopaje. 9,10 Momentos: antes de la producción, durante la producción y después de la limpieza. Interpretación de los resultados: resultados permisibles según Anexo 4 de la Regulación 16: 2000.9
- Llenado aséptico:
Método: llenado con medio de cultivo.10,11 Interpretación de los resultados: ningún bulbo contaminado en 3 corridas consecutivas.10, 11
RESULTADOS
En la caracterización microbiológica de los lavados pulmonares solo se encontró crecimiento de bacterias de los géneros Bacillus spp y Micrococcus spp, sin la presencia de levaduras, hongos ni virus, independiente del lugar de sacrificio. En ninguno de los lavados pulmonares estudiados se obtuvieron aislamientos de Pasteurella multocida, Streptococcus spp, específicamente Streptococcus suis tipo 2. Tampoco se aisló Micoplasma spp, ni los virus causante del síndrome respiratorio y reproductivo del cerdo, el virus de la influenza porcina, el virus de la enfermedad de Aujeszky y el circovirus porcino tipo II, microorganismos informados como agentes causales de neumonía en el cerdo.
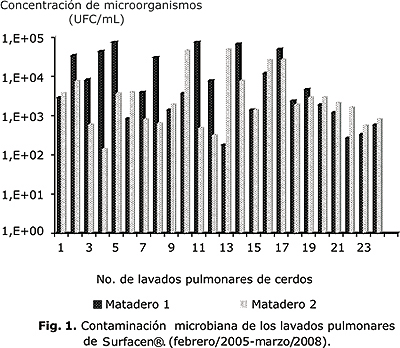
En la figura 1 se observan los resultados en los 2 mataderos, los que no difieren significativamente para p £ 0,05 en cuanto a la concentración de unidades formadoras colonias por mililitro.
Los valores de concentración microbiana oscilaron entre 1,4 x 102 y 7 x 104 UFC/mL. En el último período de junio de 2007 a marzo de 2008 todos los valores se mantuvieron por debajo de 5 x 103 UFC/mL. Estos lavados formaron parte de 14 lotes de Surfacen®, a los que se les determinó pirógeno como control de la calidad del proceso, sin presentarse rechazo por este concepto.
En la figura 2 se observa el límite máximo de control establecido para la concentración microbiana de los lavados pulmonares de cerdos.
Los gráficos muestran que ningún valor está fuera de los límites de control, no existe una tendencia definida y todos los valores se presentan alrededor de la línea central, por lo que la variabilidad del proceso es constante y se encuentra bajo control estadístico. Con estos valores se estableció el límite de aceptación, lo que significa que cuando se obtengan valores mayores de 1 x 105 UFC/mL deben ser alertados los inspectores y productores para tomar medidas correctivas que permitan mantener esta operación bajo control.
En este proceso también intervienen otros elementos como son: el fregado de los recipientes, la solución salina (0,9 %) y el agua que se involucra en estas operaciones. Las evaluaciones sistemáticas realizadas demostraron que la calidad del agua obtenida es adecuada para la preparación de la solución salina (0,9 %), y la higienización y desinfección de los recipientes es efectiva, lo que minimizó el aporte de microorganismos y pirógenos al proceso de obtención de los lavados pulmonares.
A partir de los resultados anteriores se elaboraron las especificaciones de calidad para esta materia prima como parte integral de la estrategia para asegurar la calidad y consistencia del producto, lo cual se convirtió en un punto crítico de control de calidad específico para este material.
Para la evaluación de la capacidad del proceso de inactivar o eliminar bacterias y hongos, se definió la condición de preparación de las muestras, donde el producto del extracto orgánico (M1), producto de la precipitación (M2) y producto después de la filtración (M3) presentaron inhibidores del crecimiento microbiano, por lo que fue necesario diluir la muestra para detectar el posible crecimiento.
En el caso de M1 la dilución escogida es 1/100 y en M2 y M3 es 1/10. Esta diferencia puede deberse a la concentración, tipo de solvente orgánico presente y tiempo de exposición de estos. Para todas las muestras estudiadas se observó un efecto antimicrobiano frente a A. laidlawii y A. Níger; no se comportó de igual manera para B. subtilis que se expresó en todas las muestras sin diluir.
Después de diluidas las muestras según las condiciones anteriores, no se observó presencia de microorganismos por el ensayo de esterilidad, lo que demuestra que el proceso es capaz de eliminar la concentración de microorganismos inicial en los lavados pulmonares de cerdos (7,5 x 104 UFC/mL) y en el resto de las etapas hasta la filtración. De igual manera se obtuvieron resultados similares que demuestran la eficacia del proceso de producción de Surfacen® para aclarar o eliminar virus (Enrique Noa Romero. Comunicación personal. Laboratorio de Investigaciones del SIDA [LISIDA]). Esto demuestra que estos niveles de contaminación son permisibles para cumplir el requisito de ausencia de pirógenos en este producto.
En cuanto a la etapa de validación del proceso aséptico, los 3 procesos de traslado del material estéril evaluados fueron satisfactorios, tanto a las muestras tomadas en el área de preparación, como a su llegada a la planta de producción. Se demostró la eficiencia y consistencia de los servicios brindados por esta instalación, así como la validez de los procedimientos de transportación y manipulación, que aseguran la esterilidad de estos al introducirse en la producción de Surfacen®.
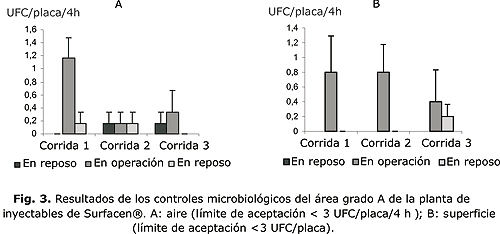
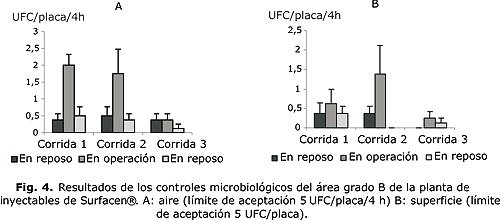
Los resultados de la validación de los procedimientos de limpieza e higienización, se presentan en los gráficos de las figuras 3 y 4, a partir de los promedios de las unidades formadoras colonias por placa para cada punto de muestreo de las diferentes áreas limpias evaluadas (grado A, B, C, D).
Como se puede observar los puntos evaluados en la zona grado A, cumplen con las especificaciones de calidad. En esta área se realizan las operaciones de alto riesgo como son: la filtración, la roto-evaporación, dispensado del producto y la ubicación de las bandejas de bulbos en la liofilizadora.
El área grado B es también una zona crítica que rodea todas las zonas grado A. En la figura 4 se puede observar que todos los puntos muestreados cumplen con los límites de aceptación establecidos para este tipo de área.
El área grado C es una zona limpia para realizar fases menos críticas de la fabricación de productos estériles. En este caso, en esta zona se encuentran los locales de la esclusa de entrada y salida del personal y material. Los resultados de todos los puntos muestreados fueron inferiores a los límites de aceptación de 50 UFC/placa/4 h para el aire y de 25 UFC/placa para superficie. De igual manera se comportaron los resultados de los controles microbiológicos del área grado D (límite de aceptación 200 UFC/placa/4 h en aire) y los valores obtenidos en la evaluación del vestuario (antebrazo y pecho) y manos enguantadas del personal (< 3 UFC/placa).
Los microorganismos encontrados durante estos controles son bacilos y cocos grampositivos, comúnmente aislados en este tipo de área. El nivel de partícula de 0,5 µm/m3 en el aire tanto en reposo como en operación para estas áreas, se ha mantenido en los niveles permisibles, evidenciado por los resultados históricos obtenidos anualmente en la calificación realizada por el Grupo Nacional de Validación.
Los resultados de la validación de llenado con medio de cultivo de los 3 últimos años cumplen con el indicador de 0 % de contaminación exigido en las regulaciones.
En todas estas operaciones ha sido vital la preparación y concientización del personal que participa en este proceso, integrado principalmente por obreros (6), técnicos medios (5), especialistas (6) y biotecnólogos (4). De ellos, cuatro ostentan el grado de Máster en Ciencias y cinco de Doctor en Ciencias en diferentes especialidades. Todos tienen más de 10 años de experiencia en este proceso y mantienen actualizada su capacitación con cursos especializados para cada función y reciben anualmente los cursos de Buenas Prácticas de Laboratorio y de Fabricación.
DISCUSIÓN
En el proceso de obtención de los lavados pulmonares son diversas las causas que aportan contaminación microbiana, una de ellas es la posible presencia de focos neumónicos en el pulmón, la que se minimiza a través de la inspección visual por un personal altamente especializado. Esta inspección en el matadero está basada en una evaluación morfopatológica de pulmones de cerdos afectados con neumonías, según el método de puntos modificado, que permite la clasificación de los pulmones en: sanos, con lesiones leves, moderadas y severas, de los cuales solo se utilizan los clasificados como sanos y que no presenten además otras alteraciones como son: cambios hemolíticos, daños en la tráquea o cortes en el parénquima pulmonar.12
El establecimiento de mejoras en los sistemas de crianza y en el tratamiento de la neumonía13,14 e inspección continua, han permitido un mínimo nivel de rechazo de pulmones en esta última etapa y se han obtenido porcentajes de hasta 70 % de pulmones útiles, resultado sorprendente si se tiene en cuenta los informes de la literatura entre un 60 a un 100 % de prevalencia de esta afección en crianzas de cerdos en condiciones tropicales.15
A partir de los pulmones sanos comienza la extracción de la sustancia surfactante (principio activo), proceso que requiere de una gran manipulación, por lo que se realiza con manos enguantadas, vestuario adecuado, en un área independiente separada del ambiente del matadero, con medidas generales de limpieza, desinfección y temperaturas de 18 a 22 ºC.
Los resultados evidencian que tanto el proceso de obtención de los pulmones de cerdos y el lavado pulmonar así como el sistema de inspección establecido son eficientes para prevenir la presencia de microorganismos patógenos y por consiguiente se minimiza la presencia de pirógenos en esta etapa.
Las validaciones realizadas al proceso aséptico demostraron que todos los controles realizados a la preparación de los materiales, su traslado y los muestreos realizados al aire, superficie y el personal, cumplieron con los límites establecidos en las regulaciones, lo que confirma que la limpieza, desinfección y el Programa de Monitoreo Ambiental (PMA) establecido para este proceso son efectivos. Paralelamente se demostró también el alto grado de preparación y conciencia del personal, elemento de vital importancia en el trabajo en áreas asépticas, lo que influye de manera directa en la seguridad del producto final.
Otros estudios relacionados con la seguridad de Surfacen®, demostraron que el producto final no contiene residuos de solventes orgánicos (María del Carmen Travieso. Comunicación personal. Dirección de Calidad, CENSA). No se puede dejar de mencionar las evaluaciones in vitro realizadas al Surfacen® en concentraciones de 1, 10 y 20 mg/mL, incubado durante 5 h frente a las bacterias grampositivas: Streptococcus agalactiae, Streptococcus pneumoniae y Staphylococcus aureus y las gramnegativas: Klebsiella pneumoniae y Escherichia coli que demostraron las propiedades antimicrobianas de este producto.16
Estos resultados permiten concluir que los procesos críticos de la producción de Surfacen® están validados y garantizan que este sea estéril, libre de pirógenos y sin residuales tóxicos, lo que demuestra su seguridad, reproducibilidad y consistencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Manzanares D, Díaz E, Alfonso W, Escobar A, Colomé H, Muñoz MC, et al. Surfactante pulmonar natural porcino. Patente, 1997;A 61 K 35-42.
2. Instituto de Investigaciones Porcinas (IIP). Manual de crianza porcino. La Habana: Instituto de Investigaciones Porcinas. Ministerio de la Agricultura; 2001. p. 133.
3. Díaz E, Alfonso W, Montes de Oca N, Travieso MC, Abeledo MA, Blanco O. Surfacen®: Desarrollo a ciclo completo de un producto farmacéutico cubano. Premio anual de la salud 2006. La Habana: Editorial Ciencias Médicas; 2007. p. 72-82.
4. USP 30. United States Pharmacopoeial Convention, Inc. 30 ed. Rockville: Mack Printing; 2007.
5. Farmacopea Europea. Mycoplasma. Suplemento 5.8. Monografía 2.6.7. Disponible en: http://www.edqm.eu/medias/fichiers/Pharmeuropa_Contents_143.pdf
6. Espinosa I, Pérez, M, Duran R, Rueda D, Bulnes D. Identification of different bacterial agents in pig's lungs and evaluation of susceptibility in vitro to chlortetracycline. Rev Salud Animal. 2004;26(2):92-6.
7. Utrero V. El complejo respiratorio porcino ¿es en realidad tan complejo? Venezuela Porcina. 2006;60:42.
8. ISO 8258. Shewhart control charts. Internacional Standards (ISO) 1991. Available from: http://www.iso.org/iso/iso_catalogue/catalogue_tc/catalogue_detail.htm?csnumber=15366
9. CECMED: Regulación 16: 2000. Directrices sobre Buenas Prácticas de Fabricación de productos farmacéuticos Anexo 4. Fabricación de Productos Estériles, 2000. Disponible en: http://www.cecmed.sld.cu/Docs/RegFarm/DRA/BPPF/2003-2006/Reg /Reg_16-00Anexo-04.pdf
10. PIC. PIC, 007-1: Pharmaceutical inspection convention. Recommendation on the validation of aseptic processes. PIC/S Secretariat, Geneva. July, 2001. p. 16.
11. PIC. PIC, 007-2: Pharmaceutical inspection convention. Recommendation on the validation of aseptic processes. PIC/S Secretariat, Geneva. July, 2004. p. 16.
12. Rueda D, Bulne C, Durand R, Bustamante P. Morphological evaluation of porcine pneumonias in slaughtherhouses by using a store method. Rev Salud Anim. 2002; 24 (3):208-11.
13. Pérez Ruano M, Bulnes C, Abeledo MA, Rueda D, Durand R. Reducción de la incidencia de neumonías en cerdos al sacrificio mediante la aplicación de un esquema de tratamiento basado en el uso de Aivlosin fg 50 + Chlortet fg 150. Rev Salud Anim. 2003;25(1):162-6.
14. Pérez Ruano M, Vega E, Abeledo MA, Bulnes C, Rueda D, Durand R, et al. Efecto del tratamiento con Aivlosin fg 50 + Chlortet fg 150 y la vacunación contra Mycoplasma hyopneumoiae sobre la afectación por neumonías, el peso y la edad al sacrificio en cerdos de cruce comercial en Cuba. Rev Salud Anim. 2005;27(1):8-14.
15. Tielen L. Prevention of respiratory diseasesthrough optimal environmental control .Pigs-Misset. 1995;June:30-1.
16. Blanco O, Riverón Y, de Armas E, Sánchez J, Faure R, Fernández O. Surfacen® inhibe el crecimiento de bacterias causantes de infecciones respiratorias. Biotecnología Aplicada. 2005;22:279-81.
Recibido: 12 de enero de 2009.
Aprobado: 17 de febrero de 2009.
Lic. Yamilka Riverón Alemán. Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba. Correo electrónico: nivian@censa.edu.cu